SHP-2抑制剂药效团模型的构建与应用
2015-10-22魏会宇金媛媛王梅燕朱立勤
魏会宇,金媛媛,王梅燕,朱立勤,3
(1.天津医科大学眼科医院药剂科,天津医科大学眼视光学院,天津医科大学眼科研究所,天津300384;2.天津医科大学药学院,天津300070;3.天津市第一中心医院药学部,天津300192)
蛋白酪氨酸磷酸酶SHP-2(s rchomology 2 domain containing phosphotyrosine phosphatase 2)是一种由蛋白酪氨酸磷酸酶N11(PTPN11)基因编码的蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTPase),其分子结构由两个 Src同源区(N-SH2和C-SH2)、一个具有蛋白酪氨酸磷酸酶催化活性功能域和一个包含多个酪氨酸磷酸化位点及一个富含脯氨酸Motif的C端尾巴组成[1]。SHP-2属于蛋白酪氨酸磷酸酶家族成员之一,作为细胞因子、生长因子及其它胞外刺激因素的下游信号分子,表达于机体的各种组织和细胞中,与许多重要的细胞生命活动(如细胞增殖、分化、移动、死亡的调控)密切相关[2-3]。近年来的系列研究发现,由PTPN11基因突变产生的SHP-2突变体与幼年型儿童粒单细胞白血病及其它类型白血病发病有关,SHP-2异常活化参与成年人白血病细胞恶性增殖病理过程,很可能是一个新的抗白血病药物靶分子[4-5]。近年来,大量新型SHP-2抑制剂被报道出来[6-11],这为进一步研究SHP-2抑制剂的结构特征,确定其结构中对活性起关键性作用的药效团以及设计、搜寻新型SHP-2抑制剂打下了基础。本研究采用Discovery Studio 3.5中的药效团模块构建SHP-2抑制剂的三维药效团模型,用于指导下一步新型结构的先导物的搜寻。
1 材料与方法
1.1 药效团模型构建 计算工作所用软件为Accelrys公司的Discovery Studio 3.5商用软件包,所用参数设定除特别指明外均为默认值。所有计算均在Linux操作系统中完成。从文献[6-7,12-13]报道中选择用于构建基于配体分子共同特征三维药效团模型的训练集分子(图1)。定义活性最好分子的Principal值为2,其余均为1,而活性最好的分子的Max Omit Feat值定义为0,其余均为1。采用featuremapping模块选择以下化学特征进行药效团模型构建:氢键供体(HBD)、氢键受体(HBA)、疏水中心(HY)、芳环中心(RA)以及负电中心(NI)。

图1 SHP-2抑制剂训练集化合物分子结构及其抑制活性Fig1 ThestructuresandactivitiesofSHP-2inhibitorsfor trainingset
用于构建基于受体-配体晶体复合物药效团模型的SHP-2复合物(PDB ID:3O5X)是从Protein Data Bank(PDB)数据库中获取的。首先,对蛋白分子进行加氢去水等准备工作,然后利用DS的Receptor-ligand pharmacophore generation模块产生药效团,并用其自带的验证工具Validation验证模型的可靠性。
1.2 虚拟筛选 本次虚拟筛选选用公共免费库ZINC数据库(2013年)。由于ZINC数据库中化合物的数量非常庞大,因此本实验只筛选了其中的一部分大约1 600万个分子。首先以HipHop算法产生的药效团模型为提问结构,对ZINC数据库进行搜索,对匹配药效团特征的化合物进行基于匹配值 fit value的排序,保留其中得分最高的一部分小分子化合物,再以CBP算法产生的药效团模型为提问结构,对被保留下来的化合物进行匹配,最终得到同时符合两种药效团特征的优选化合物。
1.3 ADME预测 Schrodinger Suite 2009软件中的QikProp模块可以预测化合物的吸收、分布、代谢、排泄性质。在QikProp模块中,分子自动成中性状态。在正常模式下,此模块可以分析油水分配系数,水溶性,毒性。本实验对 logPo/w、PSA、logS、PMDCK进行预测。PSA指极化表面积,与膜渗透相关的另一个参数;logPo/w指油水分布系数,改变药物的油水分布系数达到提高其生物利用度的目的;logS指水溶性,改变药物的水溶性提高药物在血液中转运速度;PMDCK指狗肾细胞培养,与肠通透性有关的参数。
2 结果
2.1 基于配体分子共同特征的药效团模型结果HipHop算法的计算结果一共产生了10个药效团模型,这10个药效团模型的结果参数见表1。
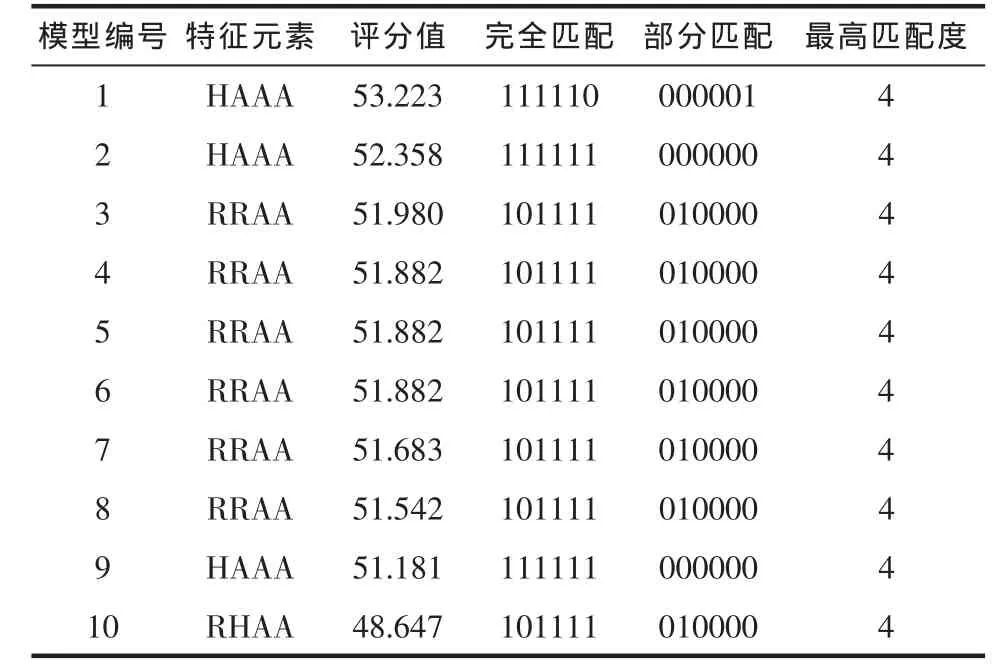
表1 10个基于分子共同特征的药效图的结果参数Tab1 Theparametersof ten common featuresof pharmacophore
2.2 基于受体配体复合物结构的药效团模型结果 CBP算法的计算结果一共产生了6个药效团模型,这6个药效团模型的结果参数见表2。

表2 基于受体配体复合物的药效团结果Tab2 The resultsof com plex-based pharm acophore
2.3 药效团的验证 ROC分析可用于检验一个药效团模型是否具有从一系列非活性分子中挑选出活性分子的能力。本实验选取了47个已报道的SHP-2的小分子抑制剂作为活性分子,并在ZINC数据库中随机选取了987个小分子化合物作为非活性分子,分别导入到Pharmacophore Generation模块Validation部分的Active Ligands和Inactive Ligands中,用于药效团模型的验证。两种方法产生的药效团模型的验证结果分别显示在表3、4中。

表3 基于配体共同特征的10个药效团模型的ROC分析结果Tab3 TheROC resu ltsof 10 comm on featuresof pharm acophore

表4 基于受体配体复合物结构的6个药效团模型的ROC分析结果Tab4 TheROC resu ltsof 6 com plex-based pharm acophore
敏感度与特异性两数值分别表示模型对活性分子以及非活性分子的识别能力。两量化指标的具体定义如下:

两者得分越高,说明模型区分活性与非活性化合物能力越强。需要综合评估,具体可从ROC曲线判断,如图2。曲线下面积值代表最后的统计结果,图中最上方描述的Accuracy即为曲线下面积,该值应大于0.5,越大代表模型区分能力越强。综合分析后,我们选取模型5作为基于配体共同特征方法产生的最优药效团模型,其包括4个药效团元素:2个氢键受体(HBA)和2个芳环中心(RA);选取模型1作为基于受体配体复合物结构方法产生的最优药效团模型,其包括3个药效团元素:1个负电中心(NI)、1个氢键受体(HBA)和1个疏水中心(HY)。
2.4 虚拟筛选结果 最终我们筛选得到35个小分子化合物(图3),这些化合物和两个药效团模型都能很好地匹配,很有可能具有SHP-2抑制活性,是潜在的SHP-2小分子抑制剂。选取筛选得到的35个化合物之一ZINC08683953分别与两个药效团模型匹配示范如图4所示。

图2 Pharm acophore_05与Pharmacophore_01的ROC曲线图Fig 2 The ROC curve of Pharm acophore_05 and Pharm acophore_01

图3 药效团虚拟筛选结果Fig 3 The resultsof pharm acophore-based virtualscreening

图4 先导物与药效团的匹配举例Fig 4 The examples of lead com poundsmatching the pharm acophores
2.5 ADME预测结果 应用Schrodinger2009软件包中的QikProp模块对35个新设计及6个已报道的SHP-2抑制剂与药效相关的5个性质进行预测。结果如表5所示(新设计的化合物只选取了10个代表性的结构)。与6个已报道的SHP-2抑制剂分子相比,新设计的化合物的 PSA、logPo/w、logS、PMDCK均在合理的范围内。

表5 ADME预测Tab5 Physiochem icaldescriptorscalculated by QP
3 讨论
训练集分子选取的原则:输入分子的结构具有多样性,从而能够代表不同系列同系物的结构特征;化合物数目在2~32个,6个左右比较理想;尽量选择活性最强的化合物;选择结构刚性大的分子效果比柔性分子好。ADME预测结果显示,已报道的6个化合物PMDCK偏低,而logS偏高,而本文中新设计化合物的PSA、logPo/w、logS、PMDCK均在合理的范围内。该结果表明已报道的这6个化合物肠吸收差且水溶性偏高,可能是由于这6个化合物中存在过多的亲水性基团(羟基、羧基、磺酸基)引起的,而笔者设计的部分化合物却很好地改善了这方面的结构缺陷。
本文从配体小分子的共同特征和受体-配体晶体复合物两方面出发,成功构建了药效团模型并进行了数据库搜索,得到同时符合两种药效团特征的化合物。本文的创新之处在于以文献报道的SHP-2小分子抑制剂和已知配体-受体复合物晶体结构为基础,筛选得到理论上更具研究价值的潜在先导化合物,既避免了传统的分子对接的随意性,又避免了单纯的基于配体的药效团模型筛选可能会产生的假阳性问题,为化合物的虚拟筛选研究提供了一种新的思路和方法。
[1]Poole AW,JonesM L.A SHPing tale:Perspectiveson the regulation of SHP-1 and SHP-2 tyrosine phosphatases by the C-terminal tail[J].Cell Signal,2005,17(11):1323
[2]Qu C K.The SHP-2 tyrosine phosphatase:signaling mechanisms and biological functions[J].CellRes,2000,10(4):279
[3]Zheng H,Alter S,Qu C K.SHP-2 tyrosine phosphatase in human diseases[J].Int JClin Exp Med,2009,2(1):17
[4]Chan G,Kalaitzidis D,Neel B G.The tyrosine phosphatase Shp2(PTPN11)in cancer[J].CancerMetastasisRev,2008,27(2):179
[5]Loh M L.Recentadvances in the pathogenesisand treatmentof juvenilemyelomonocytic leukaemia[J].Br JHaematol,2011,152(6):677
[6]StuibleM,Doody KM,Tremblay M L.PTP1B and TC-PTP:regulators of transformation and tumorigenesis[J].CancerMetastasis Rev,2008,27(2):215
[7]Lee JY,Kim JK,ChoM C,etal.Cytotoxic flavonoidsasagonistsof peroxisome proliferator-activated receptor on human cervical and prostate cancer cells[J].JNatProd,2010,73(7):1261
[8]Yu ZH,Chen L,Wu L,etal.Smallmolecule inhibitorsof SHP2 tyrosine phosphatase discovered by virtual screening[J].Bioorg Med Chem Lett,2011,21(14):4238
[9]Liu W,Yu B,Xu G,etal.Identification of cryptotanshinone as an inhibitor of oncogenic protein tyrosine phosphatase SHP2(PTPN11)[J].JMed Chem,2013,56(18):7212
[10]Yu B,LiuW,YuW M,etal.Targeting protein tyrosine phosphatase SHP2 for the treatmentof PTPN11-Associatedmalignancies[J].Mol Cancer Ther,2013,12(9):1738
[11]Duan Y Q,Ma Y,Wang X J,etal.Design potential selective inhibitors for treating cancer by targeting the Src homology 2(SH2)domain-containing phosphatase 2 (Shp2)with core hopping approach[J].Protein Pept Lett,2014,21(6):556
[12]BhattaraiBR,Shresthaa S,Ham SW,etal.2-O-Carboxymethylpyrogallol derivatives as PTP1B inhibitorswith antihyperglycemic activity[J].BioorgMed Chem Lett,2007,17(19):5357
[13]Shrestha S,Bhattarai B R,Chang K J,etal.Methylenedisalicylic acid derivatives:new PTP1B inhibitors that confer resistance to diet-induced obesity[J].BioorgMed Chem Lett,2007,17(10):2760
