化学反应速率、化学平衡的图象
2015-10-21索海山
索海山

化学反应速率、化学平衡的图象是高考高频高点之一,而学生解该类图象试题时无从下手,不会审题,致使丢分严重,现本人就将该类题的解法介绍如下:
一、解答速率、平衡图象题的一般思路
1.要看清并读懂图象
一要看清楚横坐标和纵坐标所表示的物理量;
二要看懂线的走向、变化趋势;
三要注意变化点,如线是否通过原点,两条线的交点及线的拐点;
四要善于借助辅助线(如等温线、等压线);
五要看清楚定量图象中有关量的多少。
2.要学会联想规律
3.能正确判断
即依题意仔细分析进行正确判断。
二、图象类型及分析方法
1.化学反应浓度速率图象
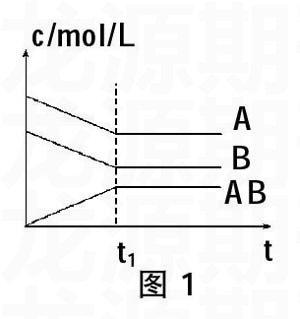
(1)浓度—时间图
该类图象能说明平衡体系中各组分在反应过程中的变化情况。如图1所示,解该类图象题要注意各物质曲线出现折点(达到平衡)的时刻相同,各物质浓度变化的内在联系及比例符合化学方程式中的化学计量数关系,正确书写出化学方程式:aA+bB■cAB。
(2)速率—时间图
如Zn与足量盐酸的反应,反应速率随时间的变化出现如图2所示的情况,解释原因:AB段(v渐增),因反应为放热反应,随着反应的进行,温度渐高,导致反应速率增大;BC段(v渐小),则主要原因是随反应的进行,溶液中c(H+)渐小,导致反应速率减小?圳故分析时要抓住各阶段的主要变化规律,认真分析。
2.化学平衡移动图象
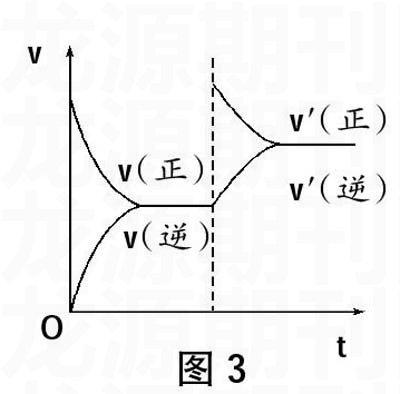
(1)速率—时间图,即v-t图
图3特点:该图象的横坐标是时间,纵坐标为速率,图象表示的是改变条件时,v(正)、v(逆)与时间的关系.
分析方法:
首先,看v(正)、v(逆)的大小判断移动的方向,若v(正)>v(逆),平衡向正反应方向移动;若v(正)
其次,看v(正)、v(逆)的连续或断点,判断影响平衡的条件,如果v(正)、v(逆)有一个连续,有一个断点,那么一般是因改变浓度条件引起的;如果v(正)、v(逆)同时有断点,则可能是压强、温度或催化剂等条件改变引起的。
(2)压强(温度)—温度(压强)—物质的含量图
图4特点:该图象的横坐标是压强或温度,纵坐标是反应物或生成物中一种物质的含量,图象表示的是随压强或温度变化时,物质的含量的变化。
分析方法:
“定一議二”,当有多条曲线及两个以上条件时,要固定其中一个条件,分析其他条件之间的关系,必要时作辅助线分析。
(3)物质的含量—时间图
图5特点:该图象的纵坐标是反应物或生成物中一种物质的含量,横坐标是时间,图像表示的是在不同的压强或温度下,反应达到平衡时所需的时间与平衡时物质含量的关系。
首先,用斜率绝对值大小判断压强大小或温度高低,即斜率绝对值越大,表示反应速率越大,所以对应的压强越大或温度越高(如上图中p1
其次,利用两平衡线高低判断正反应是吸热反应还是放热反应,或者是化学方程式中气体物质反应前后计量数的大小。
参考文献:
张广智.酸雨监测哨[J].化学教学,1994(1).
