内生真菌—鸭茅互作对宿主植物抗盐性的影响
2015-10-21姬承东周芸芸
姬承东 周芸芸


摘要 [目的] 探讨内生真菌对鸭茅植株抗盐性的影响。[方法]以感染内生真菌的鸭茅为试验材料,以无内生菌的鸭茅植株为对照,模拟梯度浓度的盐胁迫环境进行室内盆栽试验,比较带内生真菌E+与不带内生真菌E的鸭茅在相同环境下不同浓度NaCl胁迫下的生长与生理指标变化。[结果] 随盐胁迫浓度的增加, 感染和未感染内生真菌鸭茅植株脯氨酸含量和过氧化物酶活性均显著升高(P<0.05),单株生物量的干、鲜重均显著降低(P<0.05)。与未感染内生菌的鸭茅植株相比,感染内生真菌可使植株的地上生物量和叶片可溶性糖含量显著增加(P<0.05),并使过氧化物酶活性显著降低(P<0.05)。在盐胁迫环境下内生菌对鸭茅叶片中叶绿素和丙二醛的含量无显著影响。[结论]感染内生真菌的鸭茅植株能够增强其对盐胁迫的生理生化适应能力。
关键词 鸭茅;内生真菌;盐胁迫;抗盐性
中图分类号 S432.3+1 文献标识码
A 文章编号 0517-6611(2015)05-109-04
Effects of Interaction between Endophytic Fungi and Dactylis glomerata on the Salt Resistance of Host Plants
JI Chengdong1,2, ZHOU Yunyun1 (1. Hunan Golf and Tourism College, Changde, Hunan 415900; 2. Changsha Hawaii Grass Industry Co. Ltd., Changsha, Hunan 410200)
Abstract [Objective] The research aimed to discuss the effects of endophytic fungi on the salt resistance of Dactylis glomerata plants. [Method] Taking D. glomerata infected with endophytic fungi as test materials and D. glomerata plants without endophytic fungi as control, the salt stress environment was simulated with different concentration gradients to carry out the indoor pot experiment. The changes of the growth and physiological indices of D. glomerata plants with and without endophytic fungi under the same environment with salt stress with different concentrations of NaCl were compared. [Result] With the increasing of salt concentration, the proline content and peroxidase activity in D. glomerata plants with and without endophytic fungi were significantly increased(P<0.05), and the dry weight and wet weight of single plant biomass were all significantly decreased(P<0.05). Compared with D. glomerata plants without endophytic fungi, the aboveground biomass and soluble sugar content in the leaves of D. glomerata plants with endophytic fungi were significantly increased(P<0.05)and their peroxidase activity in D. glomerata plants was significantly decreased(P<0.05). Under the salt stress environment, the endophytic fungi had no significant effect on the contents of chlorophyll and malondialdehyde in the leaves of D. glomerata. [Conclusion] The physiological and biochemical adaptability of D. glomerata plants infected with endophytic fungi to salt stress was significantly enhanced.
Key words Dactylis glomerata;Endophytic fungi; Salt stress;Salt resistance
基金项目 公益性行业(农业)科研专项(20120304205)。
作者简介 姬承东(1979- ),男,甘肃金昌人,讲师,硕士,从事高尔夫球场草坪养护管理。
收稿日期 20141219
土壤盐渍化是严重影响农业生产和生态环境的问题,在盐胁迫条件下植物的生长缓慢,代谢受到抑制,盐胁迫严重时出现盐斑、叶子萎蔫,甚至死亡[1]。盐渍土在我国有着广泛分布和较大的面积。尤其在新疆地区,盐渍土分布范围廣,改良和发展潜力大,但大多数还未得到合理有效地开发和利用[2-3]。目前,盐渍土的综合利用是旱区和荒漠区农业研究的热点问题,而盐生植物的抗盐性则成为其中的重点之一[2],对于加快盐渍土的开发利用、促进区域经济发展和盐渍土壤的生态恢复具有重要意义。鸭茅(Dactylis glomerata)又称鸡脚草、果园草,竞争适应能力较强,可与部分豆科草和禾本科草形成稳定、高产的混生群落,适宜放牧、刈割,且通过人工摘顶可以提高人工草地中鸭茅种群的适应性。近20年来,通过抗性选育、组织培养及转基因技术等方法已经获得大量优良的品种[3-4],但不同产地的鸭茅品种其耐盐性和耐寒性因原产地不同存在显著差异。近年来,有学者发现内生真菌对牧草的耐盐性具有明显的促进作用。内生真菌是一类在植物体内渡过大部分或全部生命周期,而寄主植物不表现出外部症状的一类真菌,菌丝生长于植物组织的细胞间,其中叶鞘和种子中菌丝含量最多[5-6]。迄今为止,已在许多高等植物中发现内生真菌的存在,但以禾本科植物尤为常见[6]。由于内生真菌长期生活在植物体内的特殊环境中,并与宿主协同进化,在长期进化过程中能与宿主植物形成互惠关系[7]。大量研究表明,内生真菌能够能提高宿主植物对干旱[8]、高温[9]、低温[10]、锌的毒害[11]和盐碱[12]等非生物胁迫的抗性。
国内外有关内生真菌对禾草耐盐性的研究已有报道,但主要介绍禾本科植物内生真菌抗盐胁迫方面的研究,集中于研究事例、问题以及研究前沿等[13-14]。李倍金等分析了内生真菌对宿主野大麦耐盐性的影响,指出内生真菌能提高野生大麦在田间环境下的耐盐性。彭清青和南志标等指出在不同酸碱胁迫环境下内生真菌能显著促进3种禾草种子的胚芽生长。在黑麦草种子萌发的过程中,内生真菌也产生了相似的效果[15-17]。
1 材料与方法
1.1 试验材料 试验所用的鸭茅材料品种为楷模(Dactylis glomerata. Cambria),种子由甘肃农业大学曹致中教授提供。种子净度为98%,发芽率为89%。
1.2 试验方法
1.2.1 种子发芽率的测定。
在每个培养皿中放入圆形滤纸及均匀分开的50粒鸭茅种子,浇水至滤纸湿润,每天浇水,将内生菌株制成浓度为109cfu/ml的菌悬液,用该菌液浸泡种子30 min ,置于垫有湿润滤纸的培养皿内。于恒温箱内28 ℃遮光培养,7 d后观察种子的发芽情况,以无菌水浸种作为对照,每个处理重复4次。按照以下公式计算种子发芽率:发芽率=发芽数/种子总数×100%
1.2.2 鸭茅幼苗植株的获得。
在直径14 cm的圆形育苗盘内加入5 cm厚的营养土压平备用,并以6×12的排列种植鸭茅种子,每穴播3粒种子。每3 d浇水1次,出苗后在光照培养室内栽培,光照时间12 h,20 ℃;黑暗条件下12 h,15 ℃,连续培养4~6周,待分蘖期时进行内生真菌的分离和检测。
1.2.3 分蘖期内生真菌的检测。
鸭茅幼苗生长到分蘖期时,植物材料经75%乙醇表面消毒后,用镊子取叶鞘表皮细胞置于载玻片上,参照文献[18]的方法以0.8%的乳酸苯胺蓝染色,并在尼康D40显微镜下以40倍目镜观察,根据菌丝体的有无判断是否存在内生真菌。对携带内生真菌的植株具体位置予以标记。例如,第1盆的第2列第3颗有内生真菌则记录为1-B3E+。
1.2.4 无内生真菌植株的获得。
取苗盆植株,由叶片至根系用50 ml 喷瓶雾状喷洒1∶300浓度的甲基托布津,连续喷洒7 d,每次1 ml,培养7 d后检测是否全部杀死内生真菌。检测结果为100%杀死植株内生真菌。
1.2.5 鸭茅分类移栽。
将带菌和不带菌的鸭茅植株均匀移栽于高9 cm、直径14 cm、盛有蛭石粉(蛭石材料由石河子市农贸市场购得)的花盆内。带菌植株每盆移栽5株,每4盆为1个处理,每组4次重复,各处理分别编号为E+—1、E+—2、E+—3和E+—4;不带菌的也同样移栽4组,共计16个花盆,各组编号为E-—1、E-—2、E-—3、E-—4组,以Hoagland营养液补充养分,在光照12 h、20 ℃,黑暗12 h、15 ℃的光照培养室内培养并进行胁迫试验。
1.2.6 盐分胁迫处理。
同时对E+和E-盆移栽苗设置0.3%、0.6%和0.9%共3个盐胁迫处理组,以仅浇Hoagland营养液的处理作为对照,根据各处理的设置要求每隔12 h以含不同浓度NaCl的1/2 Hoagland营养液进行处理,对照用普通1/2 Hoagland营养液进行处理。胁迫过程中每天采用称量差量法用蒸馏水及时补充蒸腾损失水分并维持胁迫浓度。每天观察鸭茅植株的长势,拍照并记录数据。胁迫1周后测定植株的耐盐生理指标,处理60 d后用自来水无损洗下植株,使用直尺测定株高,150 ℃下杀青10 min ,105 ℃条件下烘干至恒重后称量测定地上生物量、地下生物量鲜重和干重。
1.2.7 生理指标的测定。叶绿素a、b含量的测定采用丙酮法;可溶性糖的测定参照李合生[19]以蒽酮比色法测定;脯氨酸含量参照张殿忠等[20]、李树伟等[21]和肖雯等[22]以磺基水杨酸法测定;丙二醛含量参照李树伟等[21]采用以硫代巴比妥酸(TBA)法测定;过氧化物酶(POD)活性测定参照李合生[19]采用愈创木酚法测定。
1.3 数据处理 试验数据用Excel 2003进行数据整理和作图,采用DPS 3.0数据处理软件中的新复极差法进行方差分析。
2 结果与分析
2.1 生物量分配的变化
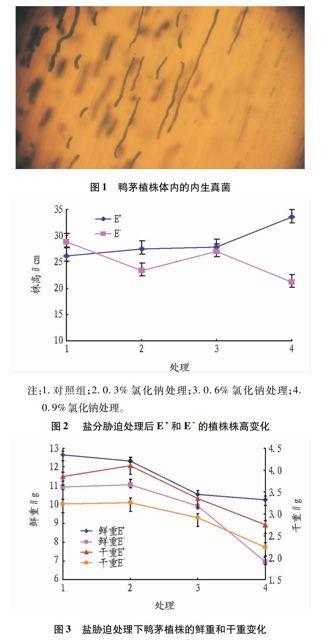
在显微镜下对无内生真菌的鸭茅盆栽植株进行复检,存在内生真菌菌丝的为带菌植株(图1),在杀菌剂处理后处理植株均已无内生菌存在,保证了试验结果的可靠性。在盐胁迫条件下,携带内生真菌与无内生真菌的鸭茅植株的实际生长状况。感染内生真菌的植株高度高于相同盐浓度下的未感染内生真菌的植株(图2),其生物量干鲜重也显著高于未感染内生真菌的植株(P<0.05),而植株地下部分的生物量干重及鲜重却均显著低于无内生真菌的植株(图3~4)。
2.2 叶绿素a、b含量的变化 从图5~6可以看出,
脅迫条件下感染内生真菌与未感染内生真菌的植株叶绿素含量均无明显的变化规律且无显著差异(P>0.05)。当盐浓度为0.3%时,未感染内生真菌的植株叶绿素a、b含量都达到最高,但处理间差异并不显著(P>0.05)。
2.3 可溶性糖含量的变化 从图7可以看出,
随着盐浓度的升高,未感染植株可溶性糖含量降低;感染内生真菌植株的可溶性糖含量先升高再降低,在0.6%的盐处理浓度下达到最高,其中0.6%和0.9%NaCl感染植株的可溶糖含量高于未感染植株,其中0.9%NaCl处理可溶性糖差异达显著水平。
2.4 脯氨酸含量的变化 从图8可以看出,随着盐浓度升高,感染内生真菌与未感染的植株脯氨酸的含量均显著升高。在对照和盐浓度为0.3%处理中,感染内生真菌和未感染的植株脯氨酸的含量未显著升高,而且相同处理条件下感染植株和未感染植株脯氨酸含量无显著差异(P>0.05),当盐浓度为0.9%时感染内生真菌和未感染的植株脯氨酸含量均显著升高(P<0.05)。
2.5 丙二醛含量的变化 从图9可以看出,含内生真菌与无内生真菌的植株在不同盐浓度胁迫处理下的丙二醛含量与对照无显著差异(P>0.05),相同处理下感染内生真菌与未感染植株之间丙二醛含量也无显著差异(P>0.05)。感染内生真菌植株脯氨酸含量越高,植物的耐盐性也越高。
2.6 过氧化物酶的变化 从图10可以看出,感染内生真菌植株的过氧化物酶活性低于未感染植株。感染内生真菌和未感染植株的过氧化物酶活性都随着盐浓度的增加而呈现出增强趋势,盐分胁迫促使鸭茅植株抗氧化物酶的活性升高,从而提高对逆境的抗性,相同处理下感染植株的过氧化物酶显著低于未感染植株,差异达显著水平,但盐度0.9%的NaCl处理,差异不显著。
3 讨论与结论
内生真菌能使植株地上生物量及株高增加,但降低了地下部分的生物量干鲜重,这与缑小媛[23]的研究结果相一致,内生真菌对盐胁迫下的鸭茅植株营养生长有积极作用。内生真菌感染通常会影响宿主植株的光合性能[24],但该研究中盐胁迫条件下感染内生真菌的植株叶绿素含量与未感染内生真菌的植株无明显变化规律,且无显著差异。盐浓度为0.3%时未感染内生真菌的植株叶绿素a、b的含量都达到最高,表明0.3%的盐浓度对鸭茅植株有促进叶绿素合成和积累的作用。随着盐浓度的升高,植物逐渐表现出生长受到抑制,为维持渗透压,植物体中的大分子淀粉逐渐分解为小分子糖类,导致植物叶片内可溶性糖含量增加。
感染内生真菌的植株可溶性糖含量显著高于无内生菌的植株。内生真菌能促进可溶性糖的转化和形成,从而调节鸭茅叶片内的渗透压,最终增强植株的耐盐能力。在低浓度条件下感染内生真菌植株含糖量显著低于不感染内生真菌植株(P<0.05),这可能是由于内生真菌与宿主的互惠共生关系造成的,内生真菌会利用宿主植株作为碳源,而在高浓度的盐分胁迫条件下内生真菌感染会提高宿主植物的抗盐性。这与前人的研究结果一致,植物叶片内可溶性糖含量的增加能提高宿主植株的抗性[18]。脯氨酸的累积能有效强化植株对渗透胁迫的耐受性[25]。感染内生真菌植株与未感染植株在高盐浓度0.9%胁迫下脯氨酸的含量均显著升高,说明在盐浓度0.9%的高盐胁迫下鸭茅植株通过大量产生脯氨酸来提高其耐盐性,但感染内生真菌植株只有在0.3%的低盐浓度胁迫时脯氨酸含量高于无内生真菌植株的含量,其具体机理尚不明确。
植物在逆境条件下常常发生膜脂过氧化作用,造成植物体内的自由基代谢平衡失调,导致丙二醛积累,对细胞膜结构和功能造成破坏。丙二醛作为脂质过氧化作用的产物。王宝山等[26]研究表明丙二醛含量可反映膜损伤程度,膜透性是直接反映出细胞膜伤害程度,而丙二醛间接反映出膜受损状况。
作为脂质过氧化的产物,丙二醛含量反映膜脂過氧化的程度。遭受胁迫时植物体内丙二醛的含量与其耐受盐胁迫的能力呈负相关[25]。该试验中盐胁迫下感染内生真菌与未感染植株间的丙二醛含量无显著差异(P>0.05),而与无胁迫的对照相比也无显著差异(P>0.05)。这有可能是因为盐胁迫的浓度和时间尚未使植株叶片膜系统产生严重伤害,因此无法反映出鸭茅的抗盐性是否提高,需要以更高浓度盐胁迫的试验予以探讨。
过氧化物酶、超氧化物歧化酶和过氧化氢酶能够消除自由基,减缓膜脂过氧化、降低逆境对植物的伤害。在植株可耐受的胁迫范围内,过氧化物酶的活性与受到的胁迫呈正相关[22]。该研究中鸭茅植株过氧化物酶的活性随着盐胁迫浓度的增加而升高,但感染内生真菌植株的过氧化物酶活性显著低于无内生真菌的植株。以上生理和生长指标均指出内生真菌对于提高植株的抗逆性有积极作用。
感染内生真菌的植株能够增强对盐胁迫的生理生化适应能力。盐分胁迫下感染内生真菌植株和未感染植株的脯氨酸、过氧化物酶都随着盐浓度的升高而升高,盐胁迫下内生真菌感染可导致鸭茅叶内的可溶性糖含量显著增加,地上产量增加。根的鲜重和干重随着盐浓度的升高而减少。
参考文献
[1]
徐鲜钧,沈宝川,祁建民.植物耐盐性及其生理生化指标的研究进展[J].亚热带农业研究,2007(4):275-280.
[2] 俞仁培, 陈德明. 我国盐渍土资源及其开发利用[J]. 土壤通报, 1999, 30(4): 158-159
[3] 郗金标, 张福锁, 毛达如, 等. 新疆盐渍土分布与盐生植物资源[J]. 土壤通报, 2005, 36(3): 299-303.
[4] 唐于银,乔海龙.我国盐渍土资源及其综合利用研究进展[J].安徽农学通报,2008(8):19-22.
[5] 彭燕,张新全.鸭茅种质资源多样性研究进展[J].植物遗传资源学报,2003,4(2):179-183.
[6] 缑小媛. 内生真菌对醉马草耐盐性影响的研究[D].兰州: 兰州大学, 2007
[7] 彭燕,张新全.鸭茅生理生态及育种学研究进展[J].草业学报,2005(4):8-14.
[8] SIEGEL M R,JOHNSON M C,VARNEY D R,et al.A fungal endophyte in tall fescue : incidence and dissemination[J]. Phytopathology,1984,74:932-937.
[9] 杜永吉,曾会明,韩烈保.羊茅属植物内生真菌研究进展[J].生物技术通报,2008(6):20-23.
[10] SCHARDL C L,LEUCHTMANN A,CHUNG K R,et al.Coevolution by common descent of fungal symbionts(Epichloe spp.)and grass hosts[J].Molecular,Biology and Evolution, 1997,14:133-143.
[11] 宋梅玲,李春杰,彭清青.温度和水分胁迫下内生真菌对野大麦种子发芽的影响[J].草地学报,2010,18(6):833-837.
[12] MARKS S,CLAY K.Physiological responses of Festuca arundinacea to fungal endophyte infection[J]. New Phytologist, 1996,133: 727-733.
[13] 陈娜.醉马草遗传多样性及内生真菌对其抗寒性影响[D].兰州:兰州大学,2008.
[14] MONNET F,VAILLANT N,HITMI A,et al.Endophytic Neotyphodium lolii induced tolerance to Zn stress in Lolium perenne[J]. Physiol Plant,2001,113: 557-563.
[15] 李倍金, 罗明, 周俊, 等. 几种禾草内生固氮菌的分离及固氮活性测定[J]. 草业学报, 2008, 17(5): 37-42.
[16] 彭清青, 李春杰, 宋梅玲, 等.不同酸碱条件下内生真菌对三种禾草种子萌发的影响[J]. 草业學报, 2011, 20(5): 72-78.
[17] 张萍萍, 胡龙兴, 傅金民. 内生真菌侵染对盐胁迫下黑麦草种子萌发的影响[J]. 草业科学, 2012, 29(7): 1094-1099.
[18] 王正凤,李春杰,金文进.内生真菌对野大麦耐盐性的影响[J].草地学报,2009(1):88-92.
[19] 李合生.植物生理学实验指导[M].北京:高等教育出版社, 2003:260-261.
[20] 张殿忠,汪沛洪,赵会贤.测定小麦叶片游离脯氨酸含量的方法[J].植物生理学通讯,1990(4):62-65.
[21] 李树伟,张俭云,陈水红.生物化学实验[M].北京:科学出版社,2012.
[22] 肖雯,贾恢先,蒲陆梅.几种盐生植物抗盐生理指标的研究[J]. 西北植物学报,2000(5):818-825.
[23] 缑小媛.内生真菌对醉马草耐盐性的影响研究[D].兰州:兰州大学,2007.
[24] 张兆英,于秀俊.植物抗盐性评价生理指标的分析[J].沧州师范专科学校学报,2006(4):51-53.
[25] 吐尔逊娜依,高辉远,安沙舟.8种牧草耐盐性综合评价[J].中国草地,1995(1):30-32.
[26] 王宝山.生物自由基与植物膜伤害[J].植物生理学通讯,1988(2):12-16.
责任编辑 刘月娟 责任校对 李岩
