脑心通对脑缺血再灌注损伤大鼠脑组织Glu、NMDA—R1的影响
2015-10-21杜培坤李妍怡王艳玲
杜培坤 李妍怡 王艳玲


摘要:目的:探讨脑心通对缺血再灌注导致神经细胞损伤的保护机制。方法:采用反复夹闭双侧颈总动脉结合鼠尾放血引起循环血量减少的方法制备拟脑缺血再灌注损伤大鼠模型,观察大鼠脑组织中Glu含量及大鼠海马组织NMDA-R1表达数量的变化。结果:脑心通组脑组织Glu含量明显降低(P﹤0.01,与模型组相比),并且大鼠脑海马组织内NMDA-R1表达明显减弱(P﹤0.01,与模型组相比)。结论:脑心通能够减少脑缺血再灌注损伤后Glu的合成或释放,抑制脑缺血再灌注损伤后NMDA-R的表达,防止Glu对NMDA-R的过度激活,从而起到防止兴奋性氨基酸毒性作用,保护神经细胞。
关键词:脑心通;缺血再灌注;谷氨酸
急性缺血性脑血管病是危害人類生命与健康的常见病和多发病之一,具有较高的致死率、致残率。近年来研究发现,脑缺血再灌注能引起一系列病理和生化的变化,主要表现为脑组织能量代谢障碍、兴奋性氨基酸(EAA)释放增加、细胞内Ca2+超载、自由基产生、细胞肿胀和凋亡等[1,2]。本实验用反复夹闭双侧颈总动脉结合鼠尾放血引起循环血量减少的方法制备拟脑缺血再灌注损伤大鼠模型,观察脑心通胶囊对大鼠脑组织中Glu含量及大鼠海马组织NMDA-R1表达数量的变化,探讨其治疗急性缺血性脑血管病的部分作用机制,为临床应用中药复方制剂提供实验依据。
1实验主要材料
选用四月龄无特定病原体(SPF)级SD大鼠50只,体重300±20g,雌雄各半,由甘肃中医学院SPF级实验动物中心提供。步长脑心通胶囊; Glu试剂盒;NMDA-R1免疫组化试剂盒。
2实验方法
2.1动物分组
选取大鼠50只,雌雄各半,随机分为空白组10只和假手术组10只,余30只造模。采用卒中指数评分标准选取20只造模成功的大鼠,随机分模型组10只、步长脑心通组10只。
2.2模型制备
采用由Nordtrom建立的2VO阻断缺血模型,加鼠尾放血改良后用于本实验模型制备[3]。要求术前禁食水。用水合氯醛腹腔内注射麻醉大鼠,仰卧固定,被皮,消毒,沿颈正中线皮肤切口,再用神经剥离器分离与颈总动脉伴行的迷走神经,完全暴露出双侧颈总动脉,用无创动脉夹闭颈总动脉,阻断血流10min,然后恢复血流,间隔10min,共2次。阻断的同时,剪鼠尾放血,以造成全脑低灌注,放血后热凝止血,造成急性脑缺血再灌注损伤模型。
假手术组:麻醉及手术和实验过程与造模组操作过程大致相同,但不阻断颈总动脉亦不放血。
2.3评价造模成功的标准
采用卒中指数评分标准[4]。卒中指数评分如下:毛发脏乱、颤抖各1分,运动减少或迟钝1分,耳触觉迟钝为3分,眼固定状睁开为3分,后肢外展呈八字为3分,上睑下垂为1分,转圈为3分,惊厥或爆发运动为3分,极度虚弱为6分。总分25分,﹥10分明显有损伤。选取卒中指数﹥10分的动物为造模成功的动物。
2.4 Glu、NMDA-R1的检测
采用比色法检测脑组织中Glu的含量。采用免疫组织化学法检测脑海马组织内NMDA-R1免疫反应细胞的表达。免疫组化SABC染色法,DAB显色,苏木素轻度复染,脱水,透明,封片。切片中免疫组化显色的神经细胞定量,采用显微镜计数法。
2.5统计学处理
数据采用SPSS15.0统计软件处理,结果以均数±标准差(X±s)表示,多组均数间均采用单因素方差分析(One-Way ANOVA)。
3实验结果
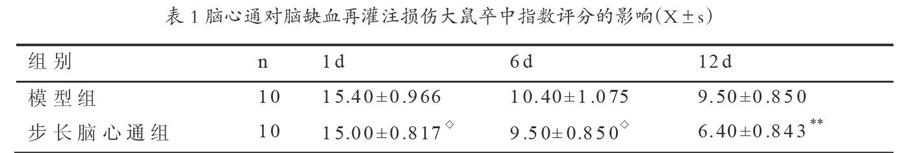
3.1脑心通对脑缺血再灌注损伤大鼠卒中指数评分的影响
表1显示大鼠的卒中指数评分步长脑心通组比模型组低,且随时间推移呈递减趋势。第1天,步长脑心通组与模型组比较无统计学意义,提示脑缺血再灌注损伤模型制备成功,并且各用药组动物选取无差异;第6天,步长脑心通组与模型组比较无统计学意义;第12天,步长脑心通组与模型组比较组比较有显著性差异,说明步长脑心通都能显著改善模型大鼠神经行为症状和体征,有较好疗效,说明中药治疗作用起效慢。
3.2脑心通对脑缺血再灌注损伤大鼠脑组织Glu含量的影响
脑缺血再灌注后,与空白组、假手术组相比,模型组大鼠脑组织Glu含量明显升高,说明模型组发生了明显的兴奋性氨基酸毒性作用;与模型组比较,脑心通组较模型组Glu含量均下降,有显著差异,说明脑心通可有效缓解脑缺血再灌注损伤后的EAA毒性作用。见表2。
3.3脑心通对脑缺血再灌注损伤大鼠脑海马组织NMDA-R1表达数量的影响
脑缺血再灌注后,与空白组、假手术组相比,模型组大鼠脑海马组织内NMDA-R1的表达数量均明显低于空白组,说明脑组织内NMDA-R1在脑缺血再灌注过程中被激活,导致受体门控通道开放,造成神经细胞的坏死;与模型组比较,步长脑心通组NMDA-R1的表达数量明显高于模型组,说明步长脑心通可以抑制脑缺血再灌注损伤后NMDA-R的表达,保护及修复神经细胞的作用。见表3。
4讨论
兴奋性氨基酸是中枢神经系统的主要兴奋性神经递质,它们对缺血脑细胞具有兴奋毒性作用,是缺血脑损害的重要环节。近年来,引起神经元死亡的兴奋性氨基酸毒性理论已成为神经细胞损伤的重要学说[5]。脑缺血再灌注损伤时,突触前神经末梢和星型胶质细胞过量释放Glu至细胞外,过度刺激Glu受体,特别是NMDA受体,引起神经兴奋性毒性作用,经研究克隆出来的NMDA-R的亚型NMDA-R1是受体复合物的主要亚单位,具有NMDA-R的全部功能特点[6]。兴奋性毒性作用不仅引起急性坏死,同时也启动迟发型坏死,还与缺血后炎症反应有关[7]。此外,Glu还可通过抑制细胞膜上的谷氨酸/胱氨酸转运体产生细胞毒性作用。胱氨酸在体内还原成半胱氨酸(CYS),CYS又是谷胱甘肽(GSH)的合成原料及限速因素,当胞外Glu过多时可抑制谷氨酸/胱氨酸转运体的功能,导致GSH合成减少,而GSH又是脑内重要的活性氧清除剂,因此引起细胞内氧自由基(如NO)堆积而产生细胞毒性作用[8];NMDA受体的激活与线粒体形成活性氧自由基有关;NMDA受体激活后可以破坏细胞内外钾离子的平衡从而诱导细胞凋亡,谷氨酸受体依赖型钙通道和钠通道同时向钾离子开放,因而暴露于NMDA的神经元因细胞内钾离子降低可最终导致细胞凋亡,其机制尚存争议。可能的机制有:1)细胞内钾离子低于正常只可激活Caspase-3而诱导凋亡[9]。2)钾离子外流长时程兴奋性突触后电位可激活细胞内的钙离子依赖性蛋白,降解酶等,使神经元脂膜、细胞骨架蛋白、核酸等重要结构解体。总之,EAA造成的神经细胞毒性作用主要包括三个方面:一是参与脑内多种代谢过程,使三羧酸循环受阻,ATP生成减少,加重对细胞的毒性作用;二是缺血再灌注后介导的大量Na+及H2O的内流,造成细胞毒性脑水肿;三是通过激活NMDA-R,介导Ca2+大量内流,导致细胞内Ca2+超载,激发一系列瀑布样病理生理过程,进一步导致神经元的迟发性死亡。
