新信息条件下化学反应方程式的书写
2015-10-21刘跃慧
刘跃慧
摘 要:化学反应方程式是重要的化学用语。要求学生对化学基础知识融会贯通,有正确复述、再现、辨认的能力,对教材中出现过的“示知方程”则要求学生有类比、迁移的能力。
关键词:复述;再现;辨认;类比;迁移
新课程改革的背景下,化学试题在稳定中不断创新,新情景下化学方程式的书写类试题出现的频率高、分值多。高中教材中的化学反应方程式虽然数目众多,但究其本质无外乎两类:氧化还原和非氧化还原。常见的考查方式是在无机综合试题中与元素或物质相结合,常见题型有化学(离子)反应方程式的书写、电离或水解反应方程式的书写、电极反应方程式的书写等。本文对这部分考题特点进行归纳总结。
一、非氧化还原反应类化学反应方程式的书写
1.复分解反应类型
考查知识:复分解反应发生的条件是:①有难溶的物质生成;②有难电离的物质生成;③有易挥发的物质生成,三者具備其一。
书写原则:①客观事实原则;②原子守恒原则;③原子守恒原则;④共存性原则。
注意事项:①参加反应或生成的微粒的存在形式;②反应所处的介质;③参加反应的反应物的量。
2.考查弱酸弱碱的电离和盐类的水解
考查知识:①多元弱酸分步电离,以第一步电离为主,多元弱酸酸根分步水解,以第一步水解为主。
②水解实质:弱酸根结合H+生成弱酸,弱碱阳离子结合OH-生成弱碱。
二、氧化还原反应类化学反应方程式的书写
1.氧化还原反应化学反应类型
氧化还原反应因为包含内容十分丰富而备受青睐。解决这类题目的关键是要深刻理解氧化还原反应的本质和与之相关的重要概念,结合题目提供信息正确找出氧化剂、还原剂、氧化产物、还原产物以及参与反应的介质,并牢牢抓住“得失电子守恒”这一重要原则。
考查知识:①知道常见元素的化合价,能够用元素价态律推断不熟悉元素的化合价。
②知道常见氧化剂还原剂对应的产物。
常见还原产物:MnO4-(H+)→Mn2+,ClO-→Cl-,H2O2→H2O等。
常见氧化产物:SO42-(SO2)→Mn2+,Fe2+→Fe3+,H2O2→O2等。
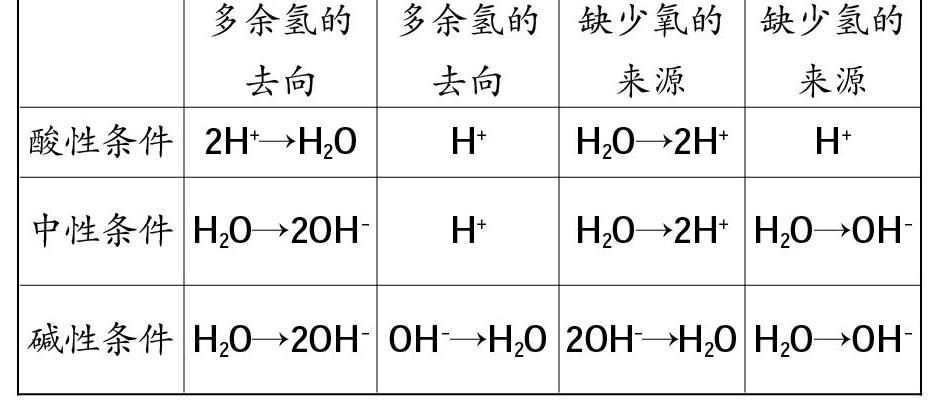
③常见非变价元素一般是氢和氧,在水溶液中一般规律如下:
2.电极反应方程式
考查知识:①能够分析原电池和电解池工作原理,抓住负氧正还,阳氧阴还利用氧化还原反应知识解答相关问题。
②电化学电极反应方程式多数是考查燃料电池的书写,应掌握五类电极反应方程式的书写。
新课程改革下的化学试题来源于课本又不拘泥于课本,新形式下化学方程式的书写大多是新情景下的化学方程式的书写。如果清楚书写原则,掌握合理思维过程,就能轻松愉悦地解决这类问题。
编辑 温雪莲