甘蔗TB1基因的克隆与生物信息学分析
2015-10-21李旭娟林秀琴刘洪博李纯佳徐超华刘新龙
李旭娟 林秀琴 刘洪博 李纯佳 徐超华 刘新龙
摘 要 以负调控禾本科植物分蘖的关键基因TB1为研究对象,根据水稻、玉米、高粱TB1同源基因保守序列设计引物,使用RT-PCR方法和RACE技术从甘蔗茎尖处克隆到该基因的同源基因ScTB1。ScTB1 cDNA全长1 668 bp,包含274 bp的5′ UTR,1 149 bp的CDS和245 bp的3′ UTR。生物信息学分析表明该基因可编码382个氨基酸残基,编码产物含有保守的SP区、TCP区和R区,属于TCP家族转录因子。其分子量为40.7 ku,理论等电点为8.55,蛋白亚细胞定位预测其主要定位于细胞质。系统进化分析表明ScTB1属于CYC/TB1亚族蛋白,与高粱TB1和玉米TB1聚为一个亚类。根据序列的保守性和预测结果可推测ScTB1很可能也参与了甘蔗分蘖性状的调控。
关键词 甘蔗;分蘖;TB1基因;克隆;生物信息学分析
中图分类号 S566.1 文献标识码 A
Abstract In this study, TB1 homolog of sugarcane was cloned from the stem apex by using RT-PCR and RACE method referring to the conserved sequence of TB1 homologs in rice, maize and sorghum. The cDNA length of ScTB1 is 1 668 bp, which contains 274 bp 5′ UTR, 1 149 bp CDS and 245 bp 3′ UTR. Bioinformatics analysis showed that ScTB1 belonged to the TCP family of transcription factors, which is composed of 382 amino acid residues and contains three conservative domains(SP, TCP and R domains). The molecular weight and theoretical isoelectric point of ScTB1 was 40.7 ku and 8.55, respectively, and the gene was likely located in cytoplasm. Phylogenetic tree analysis indicates that ScTB1 belonged to CYC/TB1 subfamily and had a very close relationship with TB1 homologs of maize and sorghum. Based on the sequence conservation, it is suggested that ScTB1 may be required for the regulation of tillering trait. This study provides important information for further research on the functional analysis and regulating mechanisms of ScTB1 in future.
Key words Sugarcane; Tillering; TB1 gene; Cloning; Bioinformatics analysis
doi 10.3969/j.issn.1000-2561.2015.11.010
甘蔗(Saccharum spp.)是主產于热带和亚热带区域的重要糖料经济作物,全世界近80%以上的食糖来自于甘蔗。此外,甘蔗还因蕴含较高的生物量而成为世界上最重要的能源作物之一[1-2]。甘蔗属无性繁殖作物,蔗茎为其主要收获产品,主要由单一的主茎和有效分蘖茎组成,其中有效分蘖茎数量的多少对于甘蔗最终产量的大小具有重要影响,由此可见,分蘖性状表现对于甘蔗产量具有举足轻重的作用。而从甘蔗分蘖性状着手,研究其分子基础,对于利用分蘖性状改良甘蔗品种产量具有重要意义。
TB1(TEOSINTE BRANCHED 1)基因,是一个作用于独脚金内酯(Strigolactones, SLs)下游的基因,属植物所特有的TCP家族转录因子,编码含有不典型的螺旋-环-螺旋结构(non-canonical basic-Helix-Loop-Helix strueture,bHLH)的DNA结合蛋白,主要在分生组织中起作用,与细胞分化和生长有很大的关系[3]。研究发现,TB1对禾本科植物侧枝的发生有着重要的作用,是多条信号调节通路的一个节点,它和上下游基因互作共同参与禾本科植物分蘖性状的调控[4-6]。TB1最先从玉米中克隆出来[4],后又在水稻[7]、高粱[8]、拟南芥[9]等作物中克隆出其同源基因并进行了功能分析,结果表明TB1在单子叶植物和双子叶植物中结构和功能方面都表现出高度的保守性。目前有关甘蔗TB1基因的研究报道还十分少,Pribil等[10]曾在研究报道中简单提到转入水稻或甘蔗TB1基因的转基因甘蔗株高有显著增加,但分蘖数有所降低;Aitken[11]等检测了一个从甘蔗TB1基因EST序列开发的EST-SSR标记,发现该标记对甘蔗分蘖性状影响的效应较小;而关于甘蔗TB1基因的结构和功能尚不清楚,限制了利用甘蔗TB1基因调控甘蔗品种分蘖性状表现、形态建成和产量改良。鉴于TB1基因在植物分枝(蘖)调控中的重要作用和在甘蔗研究中的滞后,本研究采用RT-PCR和RACE技术克隆到甘蔗TB1基因(ScTB1),并对其开展生物信息学分析,以期初步探索ScTB1的结构和功能,为后续该基因的功能解析、分子调控机制研究和分子辅助育种利用奠定良好的基础。
1 材料与方法
1.1 材料
以国内甘蔗主栽品种新台糖22号(ROC22)为研究材料,选分蘖盛期的分蘖苗茎尖组织部位,用于后续RNA的提取,所有研究材料由国家甘蔗种质资源圃提供。
1.2 方法
1.2.1 总RNA的提取及反转录 取甘蔗品种ROC22分蘖苗茎尖新鲜组织于液氮中迅速研磨成粉末,使用全式金TransZolTM Plant RNA提取试剂盒提取总RNA,并用1.0%的琼脂糖凝胶和Bio Drop Lite PC超微量可见紫外分光光度计检测RNA质量和浓度,然后使用反转录试剂盒Trans Script One-step gDNA Removal and cDNA Synthesis Super Mix反转录成cDNA,于-20 ℃保存备用。
1.2.2 基因克隆 (1)基因片段扩增。使用Primer Premier 5.0软件,根据水稻、玉米、高粱等作物TB1基因保守区序列设计RT-PCR引物:ScTB1-113-F和ScTB1-815-R(见表1)。以上述反转录cDNA为模板,使用Trans Taq DNA Polymerase High Fidelity(HiFi)PCR扩增获得相应片段,并用pEASY-T5 Zero Cloning Kit进行连接后转化大肠杆菌DH5α感受态细胞,选取5个克隆交由深圳华大基因研究院测序,测序结果使用DNAMAN软件进行比对分析。
(2)RACE扩增ScTB1 3′和5′端。以比对正确的克隆序列为模板,设计3′和5′ RACE基因特异引物(GSP)(见表1),使用SMARTERTM RACE cDNA Amplification Kit试剂盒获得5′ RACE cDNA和3′ RACE cDNA模板,按照试剂盒说明书进行5′ RACE和3′ RACE产物PCR扩增,PCR产物回收、连接转化、测序和序列比对同上。使用Vector NTI 11.5软件将基因片段与比对正确的RACE产物序列拼接得到甘蔗ScTB1 cDNA全长序列,根据所拼接的cDNA序列的编码区外侧设计引物ScTB1-131-F和ScTB1-1609-R扩增真实的ScTB1编码区序列,测序分析进一步验证拼接序列的正确性。
1.2.3 生物信息学分析 首先利用在线工具ORF Finder查找所得序列的开放阅读框(ORF);然后使用ExPASy服务器中的ProtScale和ProtParam软件、SOP-MA在线软件、PSORT软件、ProtFun软件、TMHMM软件和SIGNA-IP软件分别预测ScTB1的理化性质、二级结构、亚细胞定位、功能、跨膜结构和信号肽;再通过DNAMAN和MEGA等生物学软件对TB1同源蛋白进行系统进化分析。
2 结果与分析
2.1 总RNA提取及ScTB1基因片段扩增
总RNA提取后电泳结果显示3条完整的条带(如图1-A), OD260/280在1.98~2.00之间,OD260/230在2.00~2.20间,表明所提RNA质量完整,盐离子去除干净,符合实验要求。RT-PCR产物电泳后在750 bp上下处有一条带(图1-B),回收克隆测序并比对分析证实其为ScTB1基因的部分片段,长706 bp。
2.2 RACE扩增ScTB1基因3'端和5'端
ScTB1 RACE结果如图2所示,3′ RACE经两轮PCR反应在500 bp附近出现2条条带(图2-B),大片段回收测序比对后为ScTB1基因的3′端序列,长度为479 bp。5′ RACE经两轮PCR反应在700 bp左右出现一条带(图2-D),回收测序比对后为ScTB1基因的5′端序列,长度为670 bp。RT-PCR获得片段和两段RACE产物序列拼接后得到ScTB1基因的cDNA全长序列,该序列总长为1 668 bp,包含274 bp的5′ UTR,1 149 bp的CDS和245 bp的3′ UTR。利用cDNA编码区全长引物RT-PCR扩增得到1条长度为1 478 bp的片段(图2-E),回收测序比对后为正确序列,证实所拼接获得的cDNA序列正确,同时将序列提交至GenBank数据库,登录号:KP137673.1。
2.3 ScTB1基因序列的生物信息学分析
2.3.1 ScTB1编码氨基酸序列结构和理化性质分析
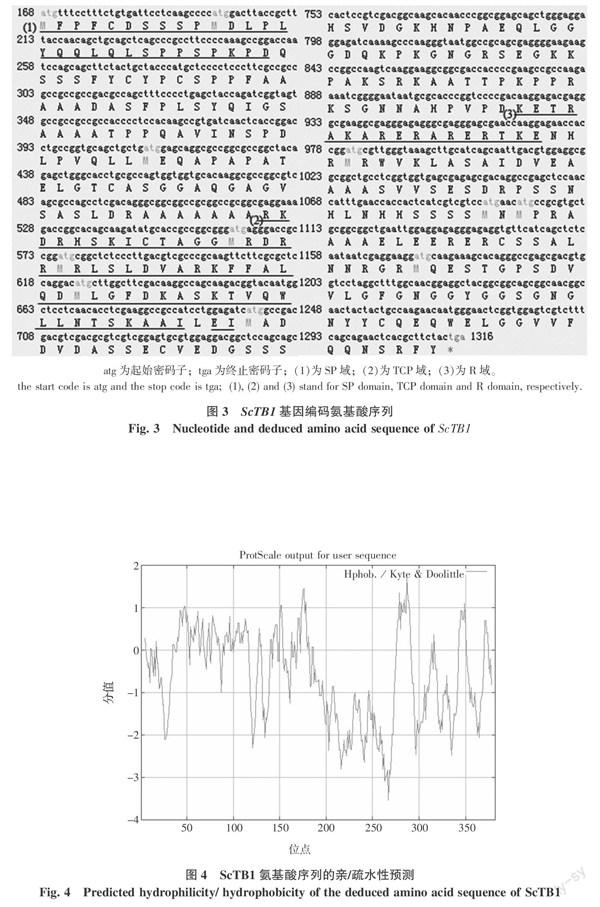
通过在线工具找到ScTB1中最大的ORF并翻译成氨基酸序列,如图3所示。该ORF长1 149 bp,共编码382个氨基酸,其中包括SP、TCP、R 3个保守结构域(图3中加下划线部分即为相应结构域),其中R域可能形成一个亲水性α螺旋,这与Lukens等[12]的研究报道一致。
ScTB1蛋白质的理化性质预测结果表明该蛋白不稳定,不稳定系数为50.51;平均疏水性为-0.621,推测其可能是亲水性氨基酸[13],其亲/疏水信号如图4,图4中峰值分布在-0.5以下的比分布在0.5以上的多,再次表明该蛋白为亲水性蛋白。
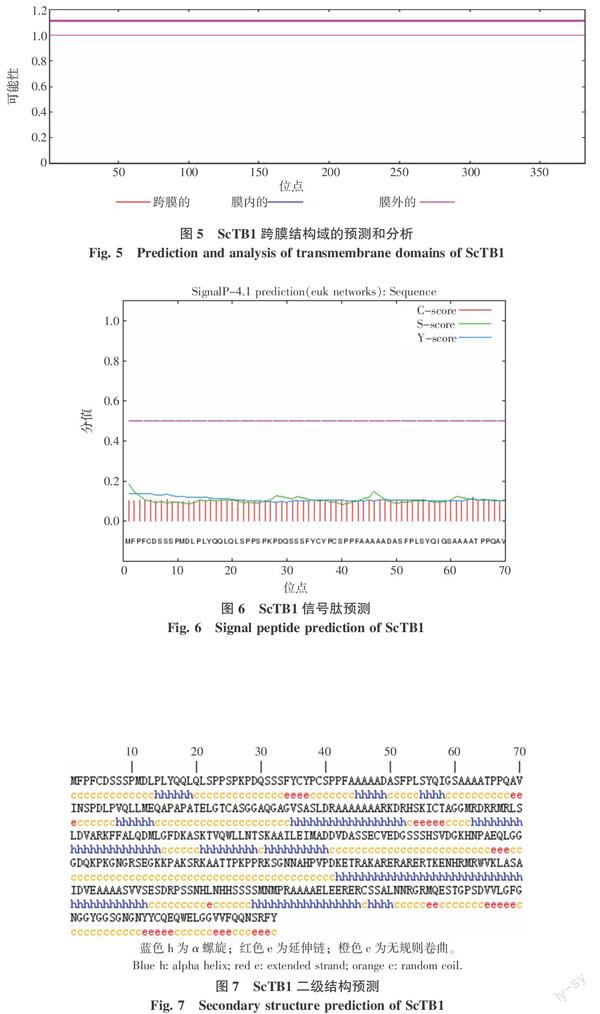
2.3.2 ScTB1蛋白亚细胞定位、跨膜结构域和信号肽预测 ScTB1蛋白亚细胞定位预测结果显示该蛋白可能定位于细胞质、线粒体基质和溶酶体,其概率分别为0.650、0.100和0.100,分布在细胞质的可能性较大。跨膜结构和信号肽预测结果(图5、6)表明ScTB1不存在跨膜结构和信号肽,可初步判断ScTB1不属于膜蛋白也不属于分泌蛋白,因而可能定位于细胞质或细胞器基质中,這与上述亚细胞定位结果相吻合。
2.3.3 ScTB1的二级结构和功能预测 ScTB1的二级结构预测结果如图7所示,该蛋白主要由 α 螺旋(h)、延伸链(e)和无规则卷曲(c)构成,其中无规则卷曲最多(53.93%),α螺旋次之(37.17%),延伸链最少(8.90%)。ScTB1功能预测结果表明,该基因行使复制和转录作用概率为0.373,调控作用概率为0.257,参与中心代谢的概率为0.153,参与翻译的概率为0.077,推测其可能为转录因子。
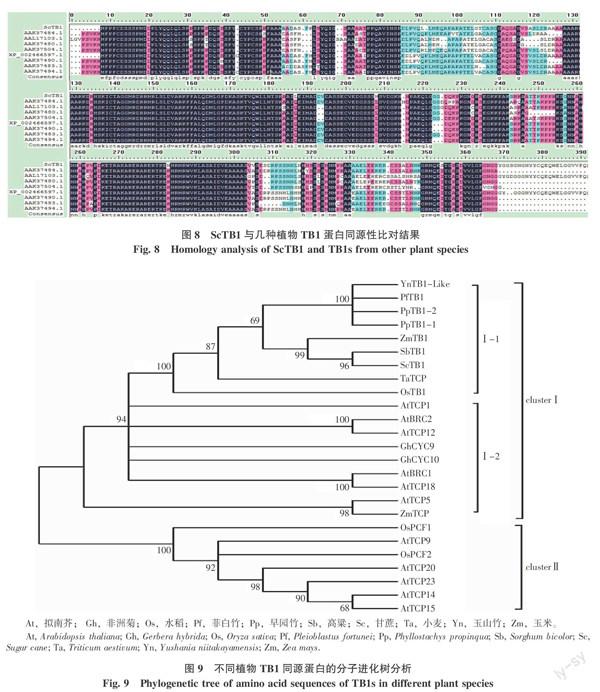
2.3.4 ScTB1同源性分析 為了进一步明确ScTB1的功能,了解它与其他植物TB1同源基因的系统进化关系,笔者选择了高粱(GenBank: XP_002466597.1、AAK37490.1、AAK37494.1和AAK37483.1)、玉米(AAL17103.1)、Chionachne koenigii(GenBank:AAK37504.1)、Tripsacum cundinamarcae(GenBank: AAK37480.1)、薏苡(Coix lacryma-jobi)(AAK37484.1)等几种植物TB1蛋白序列与ScTB1蛋白序列进行序列比对分析,结果见图8,发现它们在保守结构域上氨基酸相似度很高,非保守结构域上存在一定变化。
TCP家族转录因子根据功能、进化差异等可分为两个亚家族(CYC/TB1和PCFs),CYC/TB1亚族与植物顶端优势的维持和分蘖发生密切相关,PCFs亚族主要参与植物细胞周期调控[14]。本研究使用MEGA 6.06软件,选择邻接法构建了竹类、水稻、小麦、拟南芥等植物TCP家族蛋白的系统进化树(见图9)。根据系统进化树,可将25个TCP家族蛋白聚为明显的两个大类群(clusterⅠ和clusterⅡ),大类群下又可聚为不同的亚类群,而且多数类群bootstrap值超过90%。ClusterⅠ主要由CYC/TB1亚家族蛋白组成,内部又可分为两个亚类,第1亚类主要由竹类、高粱、玉米、甘蔗、小麦和水稻等禾本科植物TB1家族蛋白组成,第2亚类主要由拟南芥、菊类的部分TCP家族基因组成。clusterⅡ主要由以水稻PCF1、PCF2和拟南芥部分TCP转录因子为代表的PCFs亚家族蛋白组成。ScTB1蛋白被归到clusterⅠ类群,与高粱TB1和玉米TB1聚为一个亚类,并得到99%的bootstrap,因此属于CYC/TB1亚族,由此推测ScTB1可能参与了植物顶端优势的维持和分蘖性状的调控。
3 讨论与结论
分蘖性状是甘蔗品种重要的农艺性状,对于最终产量的形成具有重要作用,因此挖掘调控甘蔗分蘖性状表现的基因,对于利用基因工程和分子育种手段精准调控甘蔗有效分蘖茎数和理想株型的塑造都具有重要意义,本研究旨在初步预测ScTB1的结构和功能,以期最终阐明其功能后通过基因沉默等分子技术将其运用于甘蔗生产。TB1属于TCP家族蛋白,是调控植物分枝(蘖)的关键调控基因[4-9]。TCP家族蛋白属植物特有转录因子,含有不典型bHLH DNA结合蛋白,根据其结构和功能可将TCP家族分为两个亚家族(CYC/TB1和PCF),CYC/TB1亚家族主要参与植物器官形态建成,PCF亚家族参与细胞周期调控[14]。TCP家族具SP、TCP和R结构域,其中TCP和SP结构域为两个亚家族共有,而R结构域仅存在于CYC/TB1亚家族的某些基因当中[3]。本研究克隆到的ScTB1编码蛋白含有R结构域,显然属于CYC/TB1亚族,在系统进化上,其与玉米、水稻、高粱等TB1蛋白聚为一类,也初步证实笔者克隆的ScTB1属于CYC/TB1亚族。
文中对ScTB1进行亚细胞定位预测结果显示其主要可能定位于细胞质,这与其属于转录因子这一说法似乎矛盾,但软件预测结果只能作为初步参考,而且李超[15]硕士论文中也明确指出TCP家族蛋白在细胞质中的分布较细胞核中多,说明预测结果也具备一定参考性。此外,李超[15]论文中也指出TCP结构域的碱性区域包含一个核定位信号,所以,TB1蛋白也可能定位于细胞核中,与其属于转录因子一说吻合。生物信息学分析结果只是一个初步的预测,具体亚细胞定位还有待实验进一步证实。
前人研究表明TB1基因与分蘖的发生密切相关[16],Doebley等[17]和Hubbard等[18]研究表明TB1基因在玉米叶腋分生组织表达,抑制侧芽的生长。水稻OsTB1基因过表达植株表现出分蘖芽萌发受抑制和分蘖茎明显减少现象[7],玉米、小麦TB1基因在水稻中过表达水稻也表现出分蘖减少的现象[6]。Kebrom等[8]针对高粱TB1基因的功能分析也表明SbTB1对高粱分蘖芽的萌发具有明显的抑制作用。本研究所克隆的ScTB1基因与高粱、玉米和水稻的TB1在基因序列和蛋白结构上表现出较高的保守性,系统进化树上聚为较为紧密的一类,加之TB1蛋白理化性质、结构和功能预测等可初步推测ScTB1可能参与了甘蔗分蘖性状的调控,该作用机制将在后续的功能分析中得到验证。
参考文献
[1] Henry R J, Kole C. Genetics, genomics and breeding of sugarcane[M]. Science Publishers, Inc, 2010.
[2] 陈如凯. 现代甘蔗遗传育种[M]. 北京: 中国农业出版社, 2011: 1-19.
[3] Cubas P, Lauter N, Doebley J, et al. The TCP domain: a motif found in proteins regulating plant growth and development[J]. The Plant Journal, 1999, 18(2): 215-222.
[4] Doebley J, Stec A, Hubbard L. The evolution of apical dominance in maize[J]. Nature, 1997, 386: 485-488.
[5] Finlayson S A. Arabidopsis TEOSINTE BRANCHED1-LIKE 1 regulates axillary bud outgrowth and is homologous to monocot TEOSINTE BRANCHED1[J]. Plant and Cell Physiology, 2007, 48(5): 667-677.
[6] Choi M S, Woo M O, Koh E B, et al. Teosinte Branched 1 modulates tillering in rice plants[J]. Plant Cell Reports, 2012, 31(1): 57-65.
[7] Takeda T, Suwa Y, Suzuki M, et al. The OsTB1 gene negatively regulates lateral branching in rice[J]. The Plant Journal, 2003, 33(3): 513-520.
[8] Kebrom T H, Burson B L, Finlayson S A. Phytochrome B represses Teosinte Branched1 expression and induces sorghum axillary bud outgrowth in response to light signals[J]. Plant Physiology, 2006, 140(3): 1 109-1 117.
[9] Aguilar-Martínez J A, Poza-Carrión C, Cubas P. Arabidopsis BRANCHED1 acts as an integrator of branching signals within axillary buds[J]. The Plant Cell, 2007, 19(2): 458-472.
[10] Pribil M, Hermann S, Dun G, et al. Altering sugarcane shoot architecture through genetic engineering: prospects for increasing cane and sugar yield[J]. Proceedings of the Conference of the Australian Society of Sugar Cane Technologists, 2007, 29: 251-257.
[11] Aitken K S, Hermann S, Karno K, et al. Genetic control of yield related stalk traits in sugarcane[J]. Theoretical & Applied Genetics, 2008, 117(7): 1 191-1 203.
[12] Lukens L, Doebley J. Molecular evolution of the teosinte branched gene among maize and related grasses[J]. Molecular Biology and Evolution, 2001, 18(4): 627-638.
[13] 付海輝, 辛培尧, 许玉兰, 等. 几种经济植物UFGT基因的生物信息学分析[J]. 基因组学与应用生物学, 2010, 30(1): 92-102.
[14] 王玉红, 徐立华, 李 军. 玉米TCP家族基因生物信息学鉴定与分析[J]. 山东农业科学, 2014, 46(4): 1-6.
[15] 李 超. 农杆菌介导的豌豆花瓣瞬间表达系统的建立及利用该系统对百脉根TCP基因亚细胞定位的研究[D]. 上海: 上海交通大学, 2009.
[16] Hu W, Zhang S, Zhao Z, et al. The Analysis of the Structure and Expression of OsTBl Gene in rice[J]. Journal of Plant Physiology and Molecular Biology, 2002, 29(6): 507-514.
[17] Doebley J, Stec A, Gustus C. teosinte branched1 and the origin of maize: evidence for epistasis and the evolution of dominance[J]. Genetics, 1995, 141(1): 333.
[18] Hubbard L, McSteen P, Doebley J, et al. Expression patterns and mutant phenotype of teosinte branched1 correlate with growth suppression in maize and teosinte[J]. Genetics, 2002, 162(4): 1 927-1 935.
