苦瓜皂苷、南瓜多糖和苦荞黄酮改善HepG2/IR的联合作用研究
2015-10-21冯超尤玲玲何庆锋肖萍刘金福
冯超,尤玲玲,何庆锋,肖萍,刘金福,*
(1.天津农学院动物科学与动物医学学院,天津300384;2.天津农学院食品科学与生物工程学院,天津300384;3.天津市农副产品深加工技术工程中心,天津300384)
苦瓜皂苷、南瓜多糖和苦荞黄酮改善HepG2/IR的联合作用研究
冯超1,2,尤玲玲2,3,何庆锋2,3,肖萍2,3,刘金福2,3,*
(1.天津农学院动物科学与动物医学学院,天津300384;2.天津农学院食品科学与生物工程学院,天津300384;3.天津市农副产品深加工技术工程中心,天津300384)
探讨苦瓜皂苷、南瓜多糖和苦荞黄酮单一组分及联合使用对胰岛素抵抗的改善作用。建立胰岛素抵抗人肝癌细胞模型,设立正常组、胰岛素抵抗组、盐酸吡格列酮阳性对照组、苦瓜皂苷、南瓜多糖和苦荞黄酮单独干预组,苦瓜皂苷和南瓜多糖、苦瓜皂苷和苦荞黄酮、南瓜多糖和苦荞黄酮联合干预组,测定葡萄糖消耗量、高密度脂蛋白、低密度脂蛋白、谷草转氨酶和谷丙转氨酶的含量,MTT法评价细胞活性,蛋白免疫印迹法检测细胞葡萄糖转运体4的表达。结果表明,多数生理生化指标、细胞活性和GLUT4的表达联合组与单一组分相比有显著性差异(P<0.05);采用析因分析,苦瓜皂苷、南瓜多糖和苦荞黄酮联合在改善葡萄糖消耗量和谷丙转氨酶上具有交互协同作用(P<0.05)。
胰岛素抵抗;苦瓜皂苷;南瓜多糖;苦荞黄酮;HepG2/IR模型;联合作用;析因分析
胰岛素抵抗作为一种常见的病理状态,是2型糖尿病(T2DM)等多种疾病的共同发病基础,其发生的主要原因是由于高热量饮食或体力活动的减少,以及应激状态、遗传因素等导致机体对胰岛素作用的反应性减弱,使其维持血糖的能力下降,而引起糖、脂肪和蛋白质等多种物质代谢障碍[1]。因此,对于T2DM的治疗应建立在降低胰岛素抵抗的基础上。建立胰岛素抵抗细胞模型,可从细胞水平探讨改善胰岛素抵抗的途径和效果。肝脏是胰岛素抵抗产生的主要部位,而HepG2细胞源于人的肝胚胎瘤细胞,是一种表型与肝细胞极为相似的肝胚胎瘤细胞株,在高水平的胰岛素条件下会导致HepG2细胞表面胰岛素受体的数目下降,因此HepG2是研究改善胰岛素抵抗效果的理想细胞模型,被广泛应用[2-3]。
研究表明,来自于苦瓜、南瓜和苦荞的苦瓜皂苷(Momordica charantia saponins,MCS),南瓜多糖(Cucurbita moschata polysaccharide,CMP)和苦荞黄酮(Fagopyrum tataricum flavones,FTF)3种植物活性成分,均能不同程度的发挥降血脂、降血糖,改善胰岛素抵抗的功效[3-4],但联合复配作用效果研究报道较少。本文通过建立HepG2/IR细胞模型,考察MCS,CMP和FTF联合复配使用改善胰岛素抵抗的效果。
1材料与方法
1.1 材料和试剂
苦瓜皂苷、南瓜多糖提取物,实验室自制;苦荞黄酮,购于开鲁县昶辉生物技术有限责任公司;HepG2细胞:中国医学科学院肿瘤细胞库;DMEM高糖培养基、标准胎牛血清:美国HyClone;牛胰岛素、胰蛋白酶(1∶250)、二甲基亚砜(DMSO)、蛋白质含量测定试剂盒、硝酸纤维素膜:北京Solarbio;MTT、一抗为兔抗GLUT-4、二抗为辣根过氧化物酶标记的兔抗羊IgG:天津博美科生物技术公司;葡萄糖测定试剂盒:北京普利莱基因技术有限公司;盐酸吡格列酮:北京太洋药业有限公司;低分子量蛋白Marker:美国Thermo公司;ECL显色液:英国Advansta公司;HDL、LDL、AST和ALT测定试剂盒:中生北控生物科技公司。
1.2 仪器
蛋白质电泳仪、转膜仪器、凝胶成像系统:美国Bio-Rad公司;ELX800型全自动酶标仪:美国Bio-Tek公司;3111型CO2细胞培养箱:美国Thermo Forma公司;IX51倒置相差荧光显微镜:日本Olympus公司;GLAMOUR3000型魅力全自动生化仪:美国MD公司。
1.3 方法
1.3.1 三种活性成分的制备
苦瓜皂苷提取物采用醇提法制备,经AB-8型大孔吸附树脂纯化后纯度为58.5%。提取物中皂苷含量通过以人参皂苷Rg1为标准品,采用香草醛-冰乙酸-高氯酸紫外显色法进行测定[5]。
南瓜多糖提取物采用水提醇沉的方法制备,纯度为48.3%。多糖含量为提取物中总糖含量和还原糖含量之差。其中南瓜多糖和还原糖含量测定分别采用蒽酮比色法和3,5-二硝基水杨酸比色法[6]。
购买的苦荞黄酮提取物经AB-8型大孔吸附树脂纯化后纯度达72.3%。以芦丁为标准品,分光光度法进行测定含量[7]。
1.3.2 HepG2/IR模型的建立及分组
课题组前期试验得到高浓度胰岛素诱导HepG2细胞建立胰岛素抵抗模型的最佳作用时间为36 h,最佳胰岛素浓度为30μg/mL[8]。以细胞密度为2×105个/mL接种于96孔板,每孔100 μL,培养12 h,分别设立NC、IR、4 μg/mL PH、750 μg/mL MCS、500 μg/mL CMP和500μg/mLFTF单独干预组,750μg/mLMCS和500μg/mL CMP、750 μg/mL MCS和500 μg/mL FTF、500 μg/mL CMP和500 μg/mL FTF联合干预组,孵育12 h后进行相应指标的测定,各提取物干预剂量为前期试验测得的缓解胰岛素抵抗的最佳剂量。
1.3.3 葡萄糖消耗量和培养液生化指标的测定
孵育结束后,3 600 r/min离心10 min,取细胞培养上清液。按葡萄糖试剂盒测定方法测定细胞培养液中葡萄糖含量,计算葡萄糖消耗量。公式如下:
葡萄糖浓度(mmol/L)=标准品浓液×(样品管OD-空白管OD)/(标准管OD-空白管OD)
用自动生化仪测定上清液中HDL、LDL、AST和ALT的含量。
1.3.4 细胞活性的测定
MTT法测定细胞活性[9]。
1.3.5 免疫印迹实验
设立NC、IR、MCS、CMP和FTF单独组,MCS和CMP、MCS和FTF、CMP和FTF联合组,浓度设置同1.3.2。
提取各组细胞蛋白质[10],BCA法测定总蛋白的浓度。经12%分离胶和5%浓缩胶进行SDS-PAGE分离蛋白。在4℃下,采用湿转法,用含有5%脱脂奶粉TBST封闭1 h,按1∶500稀释GLUT-4一抗,4℃过夜。洗膜,按1∶1000稀释的辣根过氧化物酶标记的二抗,室温1 h,洗涤,与ECL显色液反应5 min,曝光。利用凝胶成像系统中Image Lab软件分析进行定量分析,计算蛋白条带与β-actin的光密度比值[11]。
1.4 统计方法
使用SPSS 13.0进行统计学分析。计量数据以均数±标准差(x±S)表示,组间均数比较用t检验,析因分析采用F检验,P<0.05表示差异具有显著性,P<0.01表示差异具有极显著性。
2结果与分析
2.1 三种活性成分单独和联合对HepG2/IR细胞葡萄糖消耗量和细胞活性的影响
三种活性成分单独和联合对HepG2/IR细胞葡萄糖消耗量的影响见图1。
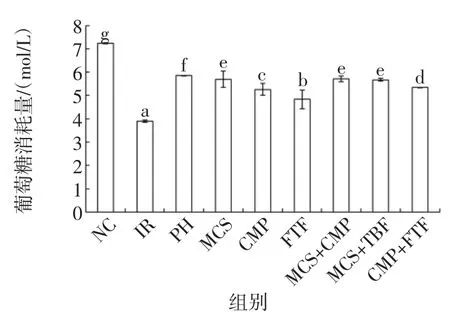
图1 苦瓜皂苷、南瓜多糖和苦荞黄酮单独及联合对葡萄糖消耗量的影响Fig.1Single operation and combined effect of MCS,CMP and FTF on the glucose consumption(x±S,n=6)
图1所示,干预12 h后,MCS,CMP和FTF单独组和联合组葡萄糖消耗量与IR组比较,差异性显著(P<0.05),说明活性成分提取物促进了细胞对葡萄糖的吸收,显著改善了胰岛素抵抗的状态(P<0.05)。CMP在联合了MCS或FTF后,其消耗葡萄糖情况显著优于单独作用的CMP或FTF组(P<0.05);MCS和FTF联合组与单独作用的FTF组比较具有显著性差异(P<0.05)。总的来说,两种物质联合可以进一步促进HepG2/IR细胞葡萄糖消耗,缓解胰岛抵抗的效果更明显。
三种活性成分单独和联合对HepG2/IR细胞细胞活性的影响见图2。
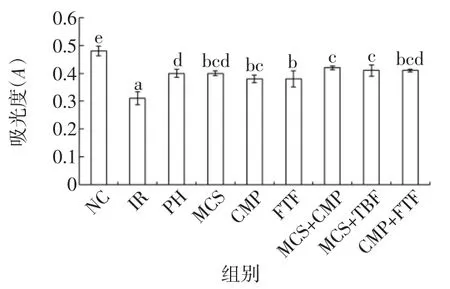
图2 苦瓜皂苷、南瓜多糖和苦荞黄酮单独及联合对细胞活性的影响Fig.2Effect of cell survival of MCS,CMP and FTF on HepG2/IR(x±S,n=6)
由图2可以看出,与NC组相比,IR组、PH组、MCS,CMP和FTF单独组和联合组,细胞活性均低于NC组,可能是因为胰岛素抵抗作用降低了HepG2细胞的活性;各提取物组与IR组比较,细胞活性均有所提高,MCS和FTF联合组细胞活性提高显著高于FTF组(P<0.05);其余联合组与单一组比较虽差异性不显著(P>0.05),但活性均有所改善。
从葡萄糖消耗量与细胞活性两个方面综合考虑,联合组可能更好地通过提高细胞对胰岛素的敏感性、修复细胞的损伤,而增加葡萄糖的摄取和利用[12]。联合组葡萄糖消耗量与单一组相比,均有不同程度的增加,说明联合组对于胰岛素抵抗所产生的葡萄糖细胞内的糖代谢紊乱功能的改善效果更好一些,从而促进糖酵解功能的发挥,提高了葡萄糖消耗量。
2.2 三种活性成分单独和联合作用对HepG2/IR细胞上清液中生化指标的影响
三种活性成分单独和联合作用对HepG2/IR细胞上清液中生化指标的影响见表1。
表1 苦瓜皂苷、南瓜多糖和苦荞黄酮单独及联合对HepG2/IR细胞上清液中生化指标的影响Table 1Single operation and combined effect of MCS,CMP and FTF in the physiological and biochemical parameters of HepG2/IR cell(±S,n=6)
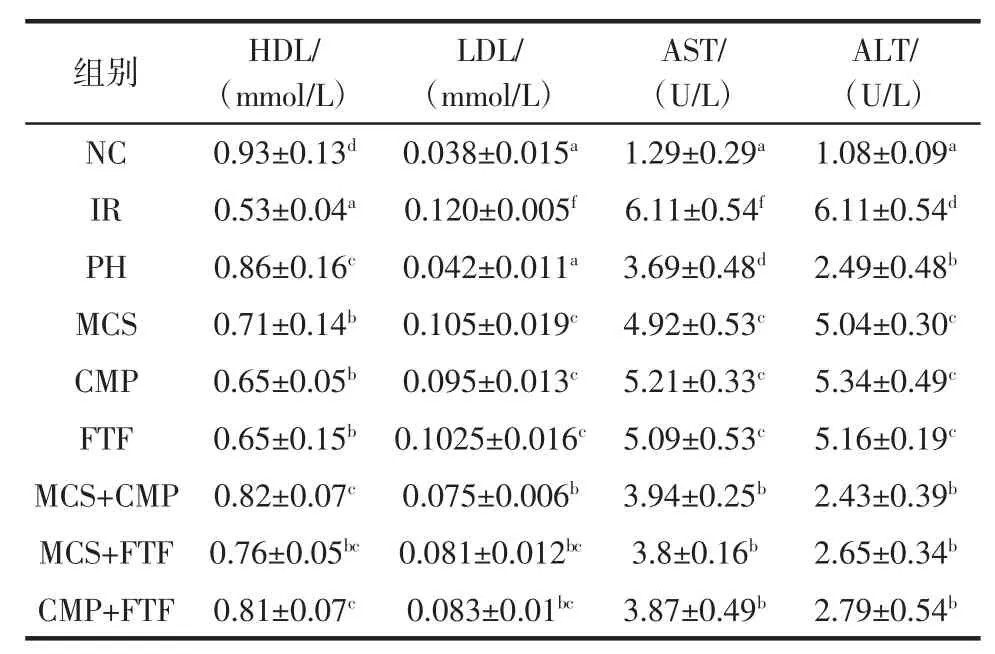
表1 苦瓜皂苷、南瓜多糖和苦荞黄酮单独及联合对HepG2/IR细胞上清液中生化指标的影响Table 1Single operation and combined effect of MCS,CMP and FTF in the physiological and biochemical parameters of HepG2/IR cell(±S,n=6)
注:同一肩注不同字母者表示比较组之间有显著差异P<0.05(字母顺序按平均值由大到小依次对应),同一肩注含有相同字母者表示比较组之间无显著差异P>0.05。
ALT/(U/L)NC0.93±0.13d0.038±0.015a1.29±0.29a1.08±0.09aIR0.53±0.04a0.120±0.005f6.11±0.54f6.11±0.54dPH0.86±0.16c0.042±0.011a3.69±0.48d2.49±0.48bMCS0.71±0.14b0.105±0.019c4.92±0.53c5.04±0.30cCMP0.65±0.05b0.095±0.013c5.21±0.33c5.34±0.49cFTF0.65±0.15b0.1025±0.016c5.09±0.53c5.16±0.19cMCS+CMP0.82±0.07c0.075±0.006b3.94±0.25b2.43±0.39bMCS+FTF0.76±0.05bc0.081±0.012bc3.8±0.16b2.65±0.34bCMP+FTF0.81±0.07c0.083±0.01bc3.87±0.49b2.79±0.54b组别HDL/(mmol/L)LDL/(mmol/L)AST/(U/L)
糖、脂代谢紊乱是胰岛素抵抗的主要原因。从表1中可见,IR组的AST、ALT和LDL的含量显著高于NC组,HDL含量低于NC组(P<0.05),说明胰岛素抵抗严重影响到细胞内物质的代谢。给予提取物作用12 h后,AST、ALT和LDL的含量均不同程度的降低,HDL含量有所提升,说明在胰岛素抵抗的状态下,MCS,CMP和FTF可以改善糖、脂代谢等紊乱现象。MCS在联合CMP或FTF时,对于AST和ALT两个指标的改善作用优于各单一成分组(P<0.05),对于LDL改善,MCS和CMP组显著优于单一组(P<0.05);CMP与FTF联合对于HDL、AST和ALT的改善作用优于各单一成分(P<0.05)。
HepG2/IR细胞受损,胞膜破裂,细胞中的AST、ALT含量高于正常组,由实验结果我们可以推测,联合组比单一组更利于改善HepG2/IR细胞损伤程度,从而保护细胞膜的完整性,使得膜上胰岛素受体更好地结合,进而增强了细胞对胰岛素的敏感性;同时,通过HDL、LDL的含量变化,说明联合组能更好的促进细胞内的脂类物质分解消除,缓解脂代谢紊乱而起到改善胰岛素抵抗的发生[13-15]。
2.3 三种活性成分联合作用的析因分析
为进一步了解联合作用的方式,两种物质之间是否存在协同交互作用,采用2*2析因设计,分析细胞上清液中的各种生化指标,结果如表2~表4。
当联合组P<0.05,证明两种物质之间有协同作用。析因分析结果表明,在葡萄糖消耗量与ALT两个指标的改善上,联合组中两个物质之间存在协同的作用。葡萄糖消耗量代表着细胞对于葡萄糖的利用摄取能力,ALT作为反映肝细胞损伤程度的指标,ALT的增加则说明细胞对糖类物质的代谢和转化能力增强,两者均为糖代谢的指标,说明植物活性成分配伍使用可通过改善糖代谢缓解胰岛素抵抗。而对于其他三种指标不存在协同作用,可能是由于物质间叠加的量效关系导致指标的改善。
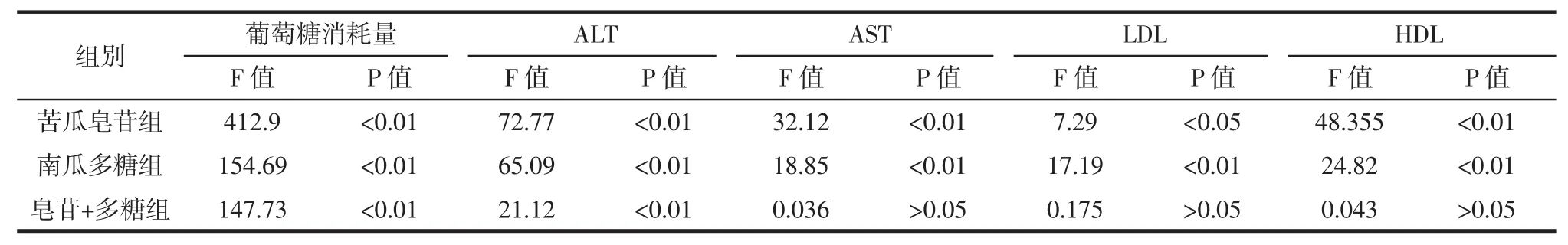
表2 苦瓜皂苷和南瓜多糖联合对葡萄糖消耗量、AST、ALT、LDL和HDL析因分析结果Table 2Combined effect of MCS and CMP on the glucose consumption,AST,ALT,LDL and HDL in factorial analysis
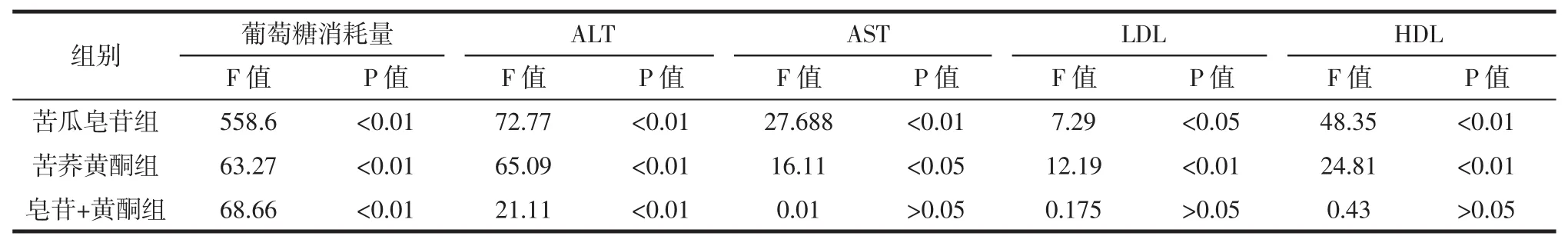
表3 苦瓜皂苷和苦荞黄酮联合对葡萄糖消耗量、AST、ALT、LDL和HDL析因分析结Table 3Combined effect of MCS and FTF on the glucose consumption,AST,ALT,LDL and HDL in factorial analysis

表4 南瓜多糖和苦荞黄酮联合对葡萄糖消耗量、AST、ALT、LDL和HDL析因分析结果Table 4Combined effect of CMP and FTF on the glucose consumption,AST,ALT,LDL and HDL in factorial analysis
2.4 三种活性成分单独和联合作用对HepG2/IR细胞GLUT4表达的影响
三种活性成分单独和联合作用对HepG2/IR细胞GLUT4表达的影响见图3~图5。
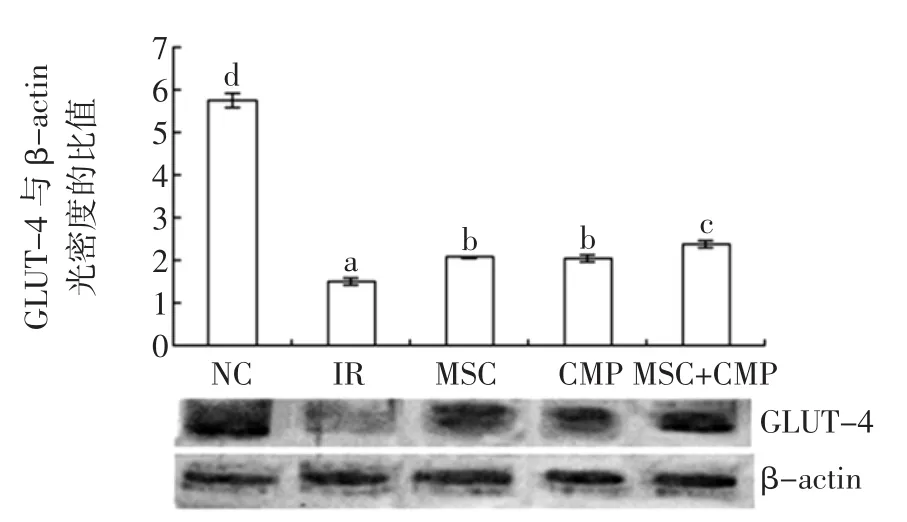
图3 苦瓜皂苷与南瓜多糖对HepG2/IR细胞GLUT4表达的影响Fig.3Western blot analysis of GLUT4 expression in MCS and CMP groups
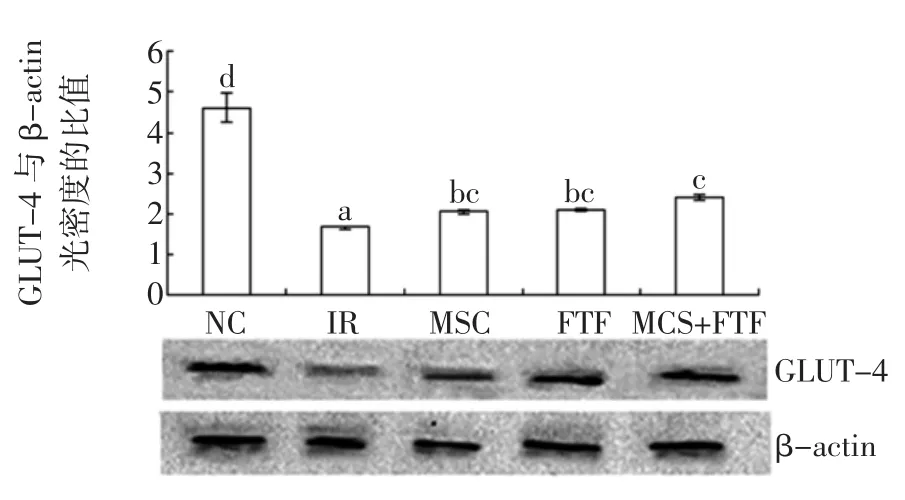
图4 苦瓜皂苷与苦荞黄酮对HepG2/IR细胞GLUT4表达的影响Fig.4Western blot analys is of GLUT4 expression in MCS and FTF groups
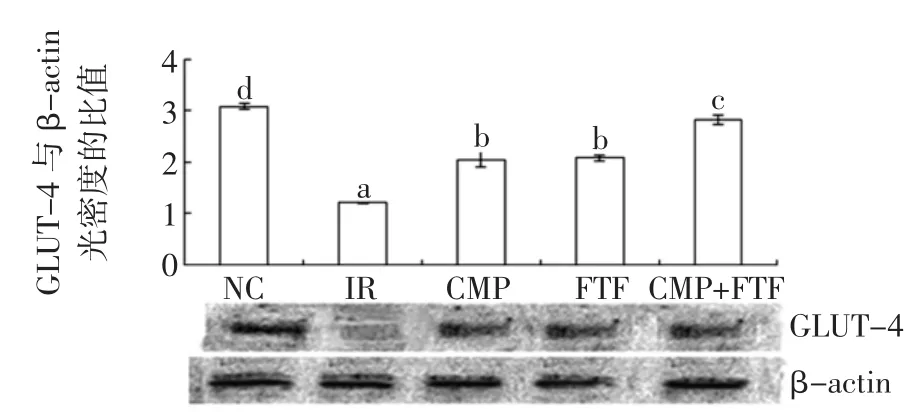
图5 南瓜多糖与苦荞黄酮对HepG2/IR细胞GLUT4表达的影响Fig.5Western blot analysis of GLUT4 expression in CMP and FTF groups
图3~图5显示了NC组、IR组以及苦瓜皂苷、南瓜多糖和苦荞黄酮单独及联合中GLUT4的表达。正常HepG2细胞GLUT4表达呈一条较强的条带,HepG2/ IR细胞GLUT4表达呈一条较弱的条带,两组光密度比较差异有统计学意义(P<0.05)。GLUT4是胰岛素抵抗的重要分子基础之一,负责摄取受胰岛素调节的葡萄糖,在胰岛素抵抗状态下GLUT4转位受到障碍,不能与胰岛素相应抗体结合导致细胞对葡萄糖摄取以利用减少,从而阻碍了其表达。单独和联合较IR组相比,对于GLUT4表达有显著性提高(P<0.05)。CMP与MCS或FTF联合,对于提高GLUT-4表达联合组优于单一组(P<0.05),可能是当MCS、CMP或FTF联合使用时,加速对细胞葡萄糖的利用与转运,从而改善胰岛素抵抗现象的发展[16]。
3结论
通过建立HepG2/IR模型,从葡萄糖消耗量、细胞活性、AST、ALT、LDL、HDL以及GLUT4表达量等方面,采用单因素方差分析和析因分析方法,探讨苦瓜皂苷、南瓜多糖和苦荞黄酮联合改善胰岛素抵抗的作用效果,结果显示,联合组对于改善胰岛素抵抗的效果优于单一组;且联合组在改善葡萄糖消耗量和ALT中存在着协同交互作用,为进一步研究植物活性成分在改善胰岛素抵抗方面的联合作用提供了借鉴。
[1]Muoio D M,Newgard C B.Mechanisms of disease:molecular and metabolic mechanisms of insulin resistance and beta-cell failure in type 2 diabetes[J].NatRev Mol Cell Bio,2008,9(3):193-205
[2]方飞,吴新荣,罗明俐,等.HepG2细胞胰岛素抵抗模型的建立及在筛选桑叶有效部位中的应用[J].医药导报,2012,31(6):691-694
[3]LI Jian,HUANG Yan,CHEN Zhu-Juan,et al.The research progress on biological activities of momordicosides[J].Food Research and Development,2008,29(3):144-146
[4]BI Xin-Ying,WANG Jian-Nan,JIANG Ling-Ling,et al.Research progress of multiple physiological effects of pumpkin polysaccharide[J].Journal of biology,2014,31(1):78-81
[5]张玉婵.苦瓜皂苷的提取及活性成分的防癌和降血糖作用的研究[D].新疆:石河子大学,2010
[6]彭红,黄小茉,欧阳友生.南瓜多糖的提取工艺及其降糖作用的研究[J].食品科学,2002,23(8):260-262
[7]谢果,张强国.用正交试验优选葛根总黄酮的提取工艺研究[J].重庆科技学院学报:自然科学版,2006,1(8):48-51
[8]尤玲玲,陈永慧,冯超等.苦瓜皂苷对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响[J].食品工业科技,2013,35(5):338-345
[9]Dhananjay G,Shailly V,Ramji L K.Long-term effects of tumor necrosis factor-α treatment on insulin sigalling pathway in HepG2 cells overexpressing constitutively active Akt/PKB[J].Cell Biochem,2007,100(3):593-607
[10]Zhaofan Luo,Ying Zhang,Fangping Li,et al.Resistin induces insulin resistance by both AMPK-dependent and AMPK-independent mechanisms in HepG2 cells[J].Original Article,2009,36(1):60-69
[11]刘晓海,董志,傅洁民,等.倍他福林对胰岛素抵抗HepG2细胞模型的作用及其初步机制[J].中国新药杂志,2008,17(12):1026-1029
[12]李纯诚,胡娟.观察二甲双胍联合罗格列酮应用对2型糖尿病者血糖影响[J].糖尿病新世界,2012,8:11
[13]Watanabe M,Ayugase J.Effects of buckwheat sprouts on plasma and hepatic parameters in type 2 diabetic db/db mice[J].Food Sci,2010,75(9):294-299
[14]Mehmet Tuzcu,Nurhan Sahin,Cemal Orhan,et al.Impact of chromium histidinate on high fat dietinduced obesity in ratst[J].Nutrition and Metabolism,2011(8):28
[15]Nafisa P C,Chakradhar V,Vandana S,et al.An experimental evaluation of the antidiabetic andantilipidemic properties of a standardized Momordica charantiafruit extracts[J].Complementaryand Alternative Medicine,2007(7):29
[16]戚琛晔,席守民,马灵筠,等.栀子苷对胰岛素抵抗HepG2细胞葡糖转运体4表达的影响[J].中国临床药理学杂志,2014,30(6):537-539
Combined Effects of Momordica Charantia Saponins,Cucurbita moschata Polysaccharide and Fagopyrum Tataricum Flavones on the Insulin Resistance HepG2 Model
FENG Chao1,2,YOU Ling-ling2,3,HE Qing-feng2,3,XIAO Ping2,3,LIU Jin-fu2,3,*
(1.Animal Science and Veterinary Medicine College,Tianjin Agricultural University,Tianjin 300384,China;2.Food Science and Bioengineering College,Tianjin Agricultural University,Tianjin 300384,China;3.Tianjin Engineering and Technology Research Center of Agricultural Products Processing,Tianjin 300384,China)
The effects of Momordica charantia saponins(MCS),Cucurbita moschata polysaccharide(CMP)and Tartary buckwheat flavones(FTF)on insulin resistance were investigated in this study.HepG2/IR model was established and randomly divided into the nine groups(NC,IR,PH,MCS,CMP,FTF,MCS and CMP,MCS and FTF,CMP and FTF groups).Afterwards,the contents of GC,HDL,LDL,AST and ALT were determined. The cell survival was estimated by MTT method and GLUT4 expression was detected by Western blot.The results showed that most of physiological and biochemical indexes,cell survival and the expression of GLUT4 were significant different between the combined groups and single component in cell model(P<0.05).To improve on the glucose consumption and ALT(P<0.05)by factorial analysis in MCS,CMP and FTF.
insulin resistance;Momordica charantia saponins;Cucurbita moschata polysaccharide;Fagopyrum tataricum flavones;HepG2/IR model;combined effect;factorial analysis
10.3969/j.issn.1005-6521.2015.09.003
2015-04-09
天津市科技支撑计划项目(13ZCZDNC01800)
冯超(1989—),女(汉),硕士研究生,研究方向:动物性食品安全。
*通信作者:刘金福(1961—),男(汉),教授,硕士,研究方向:天然产物化学与功能食品。
