重组人铜锌超氧化物歧化酶在大肠杆菌中的表达研究
2015-10-21王岚刘新张帆肖纯凌
王岚,刘新,张帆,肖纯凌
(1.辽宁省环境污染与微生态重点实验室,辽宁沈阳 110034;2.沈阳医学院基础医学院病原生物学教研室;3.沈阳医学院基础医学院临床医学专业2011级2班)
重组人铜锌超氧化物歧化酶在大肠杆菌中的表达研究
王岚1,2,刘新1,2,张帆3,肖纯凌1*
(1.辽宁省环境污染与微生态重点实验室,辽宁沈阳 110034;2.沈阳医学院基础医学院病原生物学教研室;3.沈阳医学院基础医学院临床医学专业2011级2班)
目的:构建人铜锌超氧化物歧化酶(hCu,Zn-SOD)原核表达载体并诱导其表达,纯化及鉴定目的蛋白,为其临床应用奠定基础。方法:根据已报道的hCu,Zn-SOD基因序列,采用RT-PCR技术从外周血单个核细胞(peripheral blood mononuclear cells,PBMC)中获得SOD cDNA序列。将所得的PCR产物插入原核表达载体pET22b(+)中,重组质粒经酶切、PCR及测序鉴定正确后,将其转化至大肠杆菌Rosseta(DE3),通过异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG)诱导表达出目的蛋白,经镍固定金属亲和层析纯化。采用黄嘌呤氧化酶法测定SOD生物学活性。结果:序列分析表明SOD基因成熟肽编码区含有465 bp与GenBank(X02317)中已报道序列一致的SOD核苷酸。经IPTG诱导表达,十二烷基磺酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分析显示表达的目的蛋白分子量约为19 kD,免疫印迹分析显示其与商品化的His-tag抗体呈特异性反应,但主要以包涵体形式表达,可溶性蛋白表达量很少。经Ni2+-NTA琼脂糖纯化获得SDSPAGE电泳下单一条带。可溶蛋白酶活力为460 U/ml(SOD的酶比活力为630 U/mg)。结论:在大肠杆菌中获得了人源SOD的高效表达,为研究其生物学功能及广泛应用奠定了基础。
超氧化物歧化酶;大肠杆菌;表达
超氧化物歧化酶(superoxide dismutase,SOD)是体内抗氧化物酶系的主要成员之一,广泛存在于自然界的动物、植物以及一些微生物体内,由蛋白质和金属离子组成。1938年Mann等[1]首次从牛红细胞中得到一种含铜蛋白-血铜蛋白,1969年MeCord等[2]发现此蛋白能够使超氧阴离子自由基O2-发生歧化反应,证实其具有清除生物体内氧自由基的特异性生物活性,因而将其定名为SOD并受到广泛重视,已被美国FDA批准为安全的基因工程受体生物。因此,本研究拟将人源SOD基因克隆并表达于大肠杆菌中,以提高其表达量,不仅有着重要的理论意义,而且具有重要的实用价值。
1 材料与方法
1.1 菌株与试剂 大肠杆菌E.coli DH5a菌株由中国医科大学提供,Rosseta(DE3)感受态菌株购自北京康为世纪科技有限公司;原核表达质粒pET22b(+)由沈阳化工学院研究所提供;限制性核酸内切酶EcoR I,Hind III及T4 DNA连接酶(美国Promega公司);Trizol试剂(美国Invitrogen公司);镍离子亲和层析柱(英国Amersham Pharmacia Biotech公司);质粒提取试剂盒、DNA凝胶回收试剂盒(日本Takara公司);SOD活性测定试剂盒(黄嘌呤氧化酶法)购自南京建成生物工程研究所。
1.2 寡核苷酸引物设计与合成 根据GenBank(X02317)的hCu,Zn-SOD的cDNA序列,设计编码该基因片段的5′和3′端寡核苷酸引物,引物序列P1:5′-CGGAATTC TTGGGCGATCCCAATTAC-3′(划线部分为HindⅢ酶切位点)。委托大连宝生物工程公司合成。
1.3 RT-PCR扩增及测序 Trizol试剂从经IL-2刺激的人外周血单个核细胞中提取总RNA,RT-PCR得到hCu,Zn-SOD基因双链DNA,PCR参数:98℃5 min;98℃30 s,59℃30 s,72℃15 s,循环次数30次;72℃5 min。1.5%琼脂糖凝胶电泳鉴定并回收PCR产物,将纯化后PCR产物克隆至表达载体pET22b(+),构建的重组质粒pET22b-SOD转化至感受态细菌E.coli DH5a,经过抗性筛选、酶切鉴定、PCR鉴定,初筛阳性克隆菌株。委托大连宝生物工程公司测序。
1.4 表达菌株的构建 提取测序正确的重组质粒pET22b-SOD,转化至感受态细胞Rosseta(DE3),抗性筛选阳性克隆,提取质粒酶切鉴定。
1.5 pET22b-SOD的诱导表达 挑选4个重组菌单菌落分别接种于2 ml LB液体培养基37℃,160 r/min振摇过夜,次日以1∶100接种于5 ml LB液体培养基中37℃,230 r/min异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG)培养至吸光度600值为0.6,加入终浓度为0.1 mmol/L IPTG,0.1 mmol/L ZnSO4,0.1 mmol/L CuSO4,于37℃ GCCACCATGGCGACGAAGGCCGTG-3′(划线部分为EcoRⅠ酶切位点);P2:5′-CCAAGCTT诱导表达4 h,4℃12 000 r/min IPTG离心15 min收集菌体,溶于1 ml PBS中,用超声仪300 W超声1 h,13 000 r/min离心15 min,取上清,沉淀加入10倍体积8 mol/L尿素溶解,各取30 μl进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate-polyacrylamidegelelectrophoresis,SDS-PAGE)分析。
1.6 可溶性SOD表达条件优化 对转化重组质粒pET22b-SOD的DE3菌株进行小诱条件摸索,特别是不同诱导温度(37℃、20℃)及不同诱导时间,用SDS-PAGE分析结果。
1.7 Western blotting分析 将上述37℃对照组和处理组裂解上清及沉淀,同时将20℃过夜诱导对照组和处理组样品裂解上清及沉淀,各取20 μl进行Western blotting验证。
1.8 目的蛋白纯化和复性 按照上述最佳诱导条件培养50 ml工程菌后,超声破碎收集上清液(400 W,破5 s,停5 s,反复30个循环),4℃12 000 r/min离心20 min后获得蛋白的包涵体。将蛋白包涵体用变性裂解缓冲液重悬,镍凝胶亲和层析纯化目的蛋白,洗脱的蛋白采用氧化型/还原型谷胱甘肽体系进行复性。
1.9 表达产物生物活性测定 收集复性、浓缩后的目的蛋白溶液,测定总体积并使用BCA蛋白测试试剂盒测定蛋白含量。利用SOD活性测定试剂盒(黄嘌呤氧化酶法)测定重组蛋白的生物学活性。
2 结果
2.1 hCu,Zn-SOD基因的克隆及测序结果 RTPCR扩增结果见图1。1.5%琼脂糖凝胶电泳结果显示,在约465 bp处有与预期大小一致的DNA条带,测序结果(DNA序列测序号ccs2370)与GenBank(X02317)报道一致,见图2。
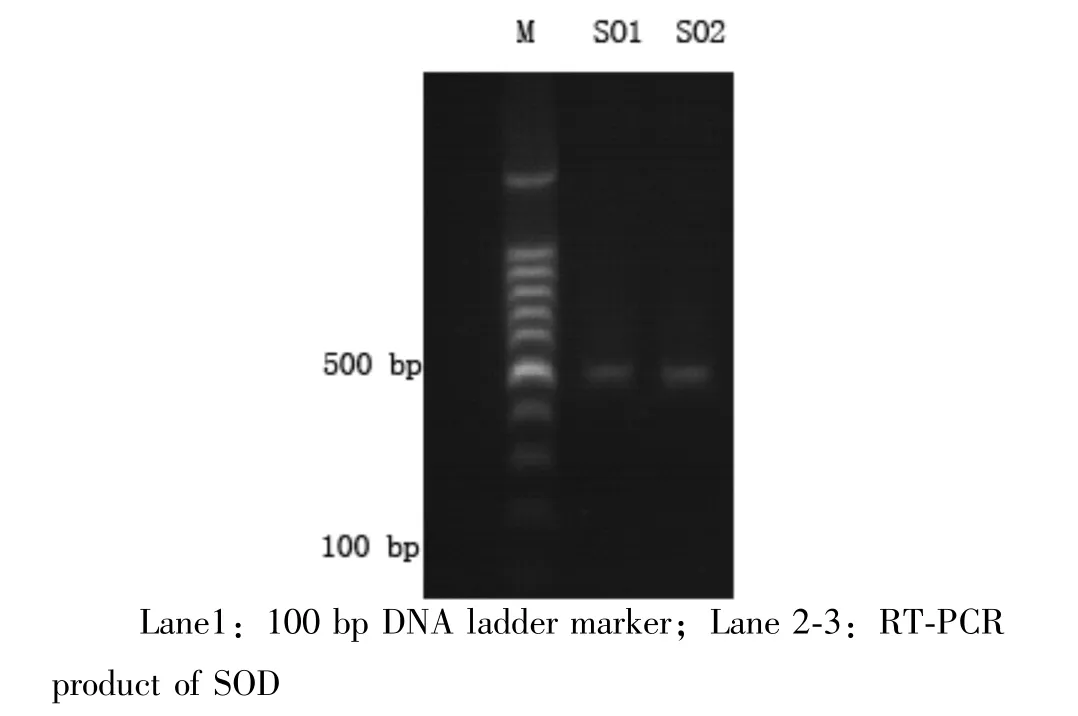
图1 SOD的RT-PCR扩增产物的琼脂糖凝胶电泳

图2 重组质粒pET22b-SOD中SOD基因的测序结果比对
2.2 重组表达质粒鉴定 构建获得的重组质粒同时进行PCR并经EcoRⅠ和HindⅢ双酶切后均产生预期大小的目的片段,见图3、4。
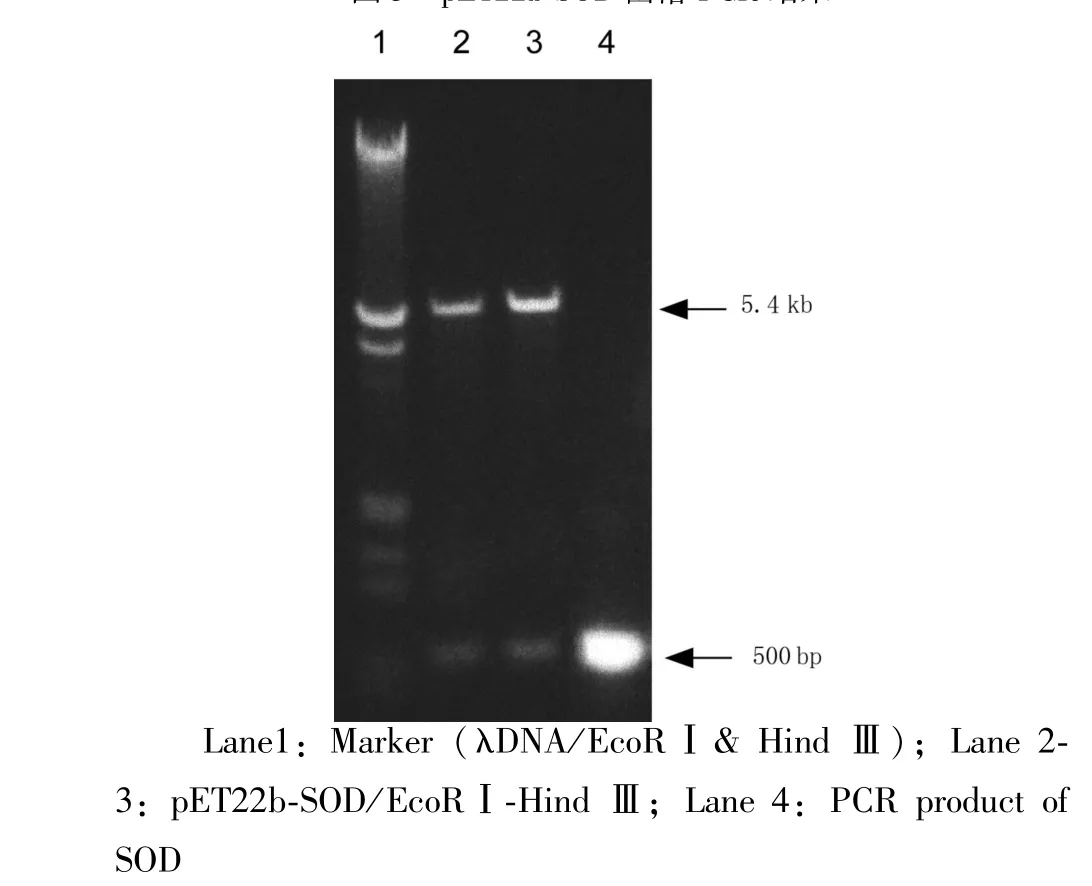
图3 pET22b-SOD菌落PCR结果
2.3 重组蛋白的表达 将重组表达质粒转化至Rosseta(DE3)后,小诱条件摸索:结果表明SOD在无诱导情况下即可表达,且主要以包涵体形式(沉淀)存在,见图5。
为验证目的蛋白是否表达,并提高可溶性蛋白的表达量。将上述37℃对照组和处理组裂解上清及沉淀,同时将诱导温度降至20℃,过夜诱导对照组和处理组样品裂解上清及沉淀,各取20 μl进行Western blotting验证,结果表明pET22b-SOD最佳表达条件为:0.1 mmol/L IPTG,0.1 mmol/L ZnSO4,0.1 Mmol/L CuSO4,20℃过夜诱导,可溶性蛋白表达量较37℃有所提高,见图6。
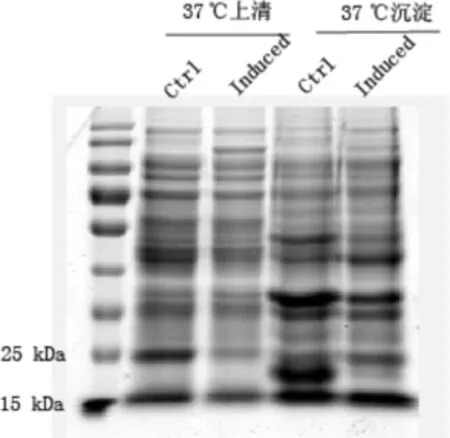
图5 pET22b-SOD 37℃诱导表达结果

图6 Western blotting检测不同温度诱导下SOD的表达
2.4 镍凝胶纯化目的蛋白 经超声破碎离心后获得的包涵体用变性裂解缓冲液重悬,使包涵体变性可溶。包涵体溶解后的上清液,用镍亲和层析柱纯化,将上清液过滤后,与亲和层析介质充分结合,宿主菌Rosseta(DE3)多数杂蛋白因不与Ni2+结合用1×Binding Buffer冲洗时直接从柱中流出,再分别以含20 mmol/L、100 mmol/L和200 mmol/L咪唑的Eluting Buffer洗脱其余杂蛋白,重组蛋白由于具有His-tag,与Ni2+-螯合亲合柱的结合力最强,在咪唑浓度达到500 mmol/L时被洗脱,见图7。
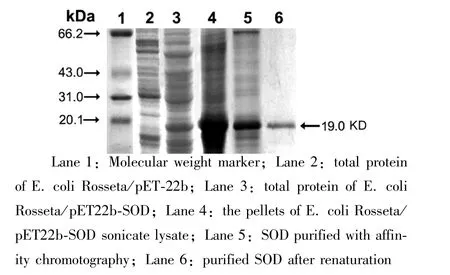
图7 SDS-PAGE分析亲和层析纯化SOD表达产物的结果
2.5 表达蛋白SOD含量及生物活性测定 将经亲和层析纯化后的重组蛋白液收集到透析袋中,浸入6 mol/L尿素复性液中,同时加入还原/氧化型谷胱甘肽(reduced/oxidized glutathione,GSH/ GSSG),经过逐步降低尿素浓度,最后用PBS透析得到含有生物活性的目的蛋白。BCA蛋白测试试剂盒测定纯化蛋白含量为0.73 mg/ml,经SOD检测试剂盒利用黄嘌呤氧化酶法(羟胺法)测定可溶性蛋白酶的活性,得出可溶蛋白酶活力达460 U/ml(SOD的酶比活为630 U/mg)。
3 讨论
近几十年,SOD一直是国内外学者研究的热点,其研究大多集中于从动物血液或脏器中提取SOD,由于含有各种难以消除的病毒及外源污染,欧盟已于1999年颁布法令,禁止从动物血液中提取的SOD用于人类。而从植物中提取SOD的方法往往受到原材料的制约,且成本较高。微生物具有原料便宜易得,可大规模生产的优势,因而,近些年很多学者都致力于用微生物发酵生产SOD的研究[3]。目前,国内外在微生物SOD的菌种选育、发酵工艺、分离提纯、生理学研究、基因克隆表达及SOD应用方面都取得一定的研究进展[4-5]。
大肠杆菌基因克隆表达系统成熟完善,繁殖迅速、培养简单、操作方便、遗传稳定,本研究将人铜锌SOD基因克隆并表达于大肠杆菌中,虽然获得高效表达,但主要以包涵体形式表达,可溶性蛋白表达量很少。原因可能是大肠杆菌表达外源基因存在以下问题:(1)缺乏对真核生物蛋白的修饰加工系统;(2)内源性蛋白酶降解空间构象不正确的异源蛋白;(3)细胞周质内含有较多的内毒素。在商业应用中很多的蛋白产物是真核基因编码,并且具有高级的三、四级结构,要求翻译后加工为正确的折叠形式或者糖基化蛋白等。由于大肠杆菌细胞的分子环境和折叠机制等与真核细胞具有很大的差异,所以在应用大肠杆菌系统表达真核基因时有必要利用代谢工程或进化的方法改造细胞,解决大肠杆菌表达系统的局限性,提高产物的活性[6]。
由于受到(1)半衰期短;(2)相对分子质量大,不易透过细胞膜;(3)口服时易受胃蛋白酶分解;(4)体内特异性等因素的限制,SOD很难作为药用酶广泛应用于临床中[7]。因此,希望在不久的将来能合成出具有精确活性中心结构、热力学稳定的和动力学惰性的模拟物,从而使SOD作为一种高效、安全的功能因子在产业中拥有广泛的实用前景。
[1]MannT,Keilin D.Haemocuprein and hepatocuprein,copper-protein compounds of blood and liver in mammals[J].Proc R Soc B,1938,126(844):303-315.
[2]MeCord JM,Irwin F.Superoxide dismutase:an enzymatic function for erythrocuprein(hemocuprein)[J].J Biol Chem,1969,244:6049-6055.
[3]张欣.超氧化物歧化酶(SOD)及其研究进展[J].内蒙古石油化工,2010,(16):14-15.
[4]王素芳,蒋琳兰,赵树进.微生物超氧化物歧化酶的研究进展[J].药物生物技术,2002,9(6):378-380.
[5]杨明琰,张晓琦.微生物产超氧化物歧化酶的研究进展[J].微生物学杂志,2004,24(1):49-51.
[6]戎晶晶,刁振宇,周国华.大肠杆菌表达系统的研究进展[J].药物生物技术,2005,12(6):416-420.
[7]马晓丽.超氧化物歧化酶的研究进展[J].山西职工医学院学报,2010,20(1):83-86.
Expression of Recombinant Human Superoxide Dismutase in Escherichia coli
WANG Lan1,2,LIU Xin1,2,ZHANG Fan3,XIAO Chunling1*
(1.Key laboratory of Environmental Pollution and Microecology,Shenyang 110034,China;2.Department of Pathogenic Biology,Shenyang Medical College;3.Grade 2011 Class 2,Shenyang Medical College)
Objective:To construct human copper zinc superoxide dismutase(hCu,Zn-SOD)prokaryotic expression vector and to purify and identify in order to lay the foundation of clinical application.Methods:RT-PCR technology was used to amplify SOD cDNA according to the reported sequence of hCu,Zn-SOD gene derived from peripheral blood mononuclear cells(PBMC).The resulting PCR product was inserted into the prokaryotic expression vector pET22b(+).The recombinant plasmid was transformed into Escherichia coli Rosseta(DE3)after verifing by enzyme digestion,PCR and sequencing identification.The target protein was expressed by IPTG induction and purified by nickel affinity immobilized metal chromatography.The biological activity of SOD was determined by xanthine oxidase method.Results:Sequence analysis showed that 465 bp nucleotide in mature peptide encoding region was consistent with SOD sequence reported in GenBank(X02317).After induced by IPTG and SDS-PAGE electrophoresis analysis,the recombinant protein was expressed and molecular weight was about 19 kD.But soluble protein expression was rarely and mainly in the form of inclusion body expression.The recombinant protein was purified by Ni2+-NTA agarose.Biological activity of soluble protease was 460 U/ml(SOD specific activity was 630 U/mg).Conclusion:High expression of human SOD is obtained from Escherichia coli,which laid the foundation for the study on its biological functions and wide application.
superoxide dismutase(SOD);Escherichia coli;expression
Q786
A
1008-2344(2015)02-0070-04 doi:10.3969/j.issn.1008-2344.2015.02.002
2015-02-07
沈阳医学院科技开发转化基金项目(No.20146069)
王岚(1976—),女(汉),副教授,医学博士.研究方向:院内感染细菌耐药机制研究.E-mail:wanglan1123@ aliyun.com
肖纯凌(1964—),女(汉),教授,博士.研究方向:大气污染与微生态.E-mail:xiaochunling@symc.edu.cn
