响应面优化纤维素酶法提取桂花多糖工艺及其抗氧活性研究
2015-10-21蒋德旗黄利敏李明星邓恒泉玉林师范学院广西玉林537000南方医科大学珠江医院广东广州508
蒋德旗,黄利敏,王 艳,李明星,邓恒泉,苏 龙,*(.玉林师范学院,广西玉林537000;.南方医科大学珠江医院,广东广州508)
响应面优化纤维素酶法提取桂花多糖工艺及其抗氧活性研究
蒋德旗1,2,黄利敏1,王艳2,李明星2,邓恒泉1,苏龙1,*
(1.玉林师范学院,广西玉林537000;2.南方医科大学珠江医院,广东广州510282)
目的:优化桂花多糖的提取工艺,并评价桂花多糖的抗氧化活性。方法:以桂花多糖得率为响应值,在单因素实验基础上,以液料比、酶解温度、酶解时间、酶添加量为实验因素,采用响应面法建立数学模型,筛选最佳提取工艺条件;采用自由基清除能力体系评价桂花多糖的抗氧化活性。结果:通过二次回归模型响应面分析,影响桂花多糖得率的因素按主次顺序排列为:纤维素酶添加量>酶解时间>液料比>酶解温度;确定纤维素酶解桂花多糖最佳工艺条件为纤维素酶添加量6.0mg/mL、液料比8∶1mL/g、酶解温度55℃、酶解时间80min,在此条件下桂花多糖得率为18.43%,模型方程理论预测值为19.05%,两者相对误差小于5%。桂花多糖具有较强的抗氧化活性,对DPPH和O2-·自由基的半数抑制浓度分别为0.846mg/mL、1.256mg/mL,但与维生素C比较,抗氧化活性较弱。结论:采用响应面法优化得到了桂花多糖的最佳提取工艺,该工艺方便可行,得到的多糖具有较强的抗氧化活性。
桂花,多糖,响应面,酶法提取,抗氧化活性
天然产物中多糖具有抗肿瘤、抗炎、免疫、降血糖等多种生物活性、毒副作用小等优点,越来越受到研究者的重视[1-2],如从土茯苓[3]、金针菇[4]、金莲花[5]、松萝[6]等植物中提取多糖。桂花(Osmanthus fragrans)既是珍贵的观赏植物,又具有一定的药用价值,富含碳水化合物、脂肪、多种氨基酸维生素等[7]。中医认为,桂花可化痰散瘀,对痰饮咳喘、肠风血痢等有一定疗效[8]。林志銮等以水为溶剂90℃提取桂花叶多糖,得到多糖的提取率为11.35%[9]。本实验采用响应面法探讨纤维素酶提取桂花多糖的最佳工艺条件,同时采用自由基清除能力体系评价其体外抗氧化活性,为桂花多糖的进一步开发提供参考依据。
1 材料与方法
1.1材料与仪器
桂花购自中草药市场,烘干至恒重备用;纤维素酶(15U/mg)上海博奥生物科技;中性蛋白酶(50U/mg)、果胶酶(30U/mg)四川山野生物科技;DPPH(1,1-二苯基-2-三硝基苯肼)、D-无水葡萄糖、维生素C(VC) 美国Sigma;浓硫酸、苯酚、三氯乙酸(TCA)等均为分析纯。
UV755B紫外分光光度计深圳瑞鑫达;PHS-3E酸度计上海精科;高速万能粉碎机北京长峰金鼎;电热鼓风干燥箱上海煜南仪器;离心机德国eppendorf;HL-2恒流泵上海沪西;HSY-B双功能水浴恒温摇床金坛市精达仪器。
1.2实验方法
1.2.1桂花多糖的提取精确称取5.0g粉碎并过100目筛后的桂花粉,按设定酶解条件(液料比、酶解温度、酶解时间、酶添加量),在180r/min摇床上进行酶解提取实验,得到多糖浸提液。多糖浸提液经90℃高温灭活、离心分离、抽滤浓缩、三氯乙酸法除蛋白、透析除杂、乙醇沉淀、冷冻干燥一系列步骤,最终得到桂花多糖。
1.2.2多糖含量的测定多糖测定采用苯酚-硫酸法[10]。以葡萄糖(mg/mL)作为标准品测定提取液中多糖液中桂花多糖的含量,葡萄糖标准曲线为y= 0.0164x-0.0475,R2=0.9923,式中y为吸光度、x为葡萄糖质量浓度(mg/mL)。桂花多糖得率计算如下:

式中:Y为多糖得率(%);A为由回归方程求得的多糖浓度(mg/mL);B为多糖液体积(mL);C为桂花质量(g)。
1.2.3多糖提取单因素实验分别选取纤维素酶、中性蛋白酶和果胶酶在酶添加量8mg/mL、酶解温度50℃、酶解时间60min、液料比10∶1条件下,考察酶种类对多糖得率的影响,以多糖得率为指标并与90℃热水浸提法(时间60min、液料比10∶1)进行比较。
酶解pH5.0和摇床转速180r/min条件不变,分别考察酶添加量(2、5、8、11、14mg/mL)、液料比(5、10、15、20、25、30mL/g)、酶解温度(30、40、50、60℃)和酶解时间(30、60、90、120、150min)对桂花多糖得率的影响。
1.2.4响应面优化设计依据单因素实验结果,选择液料比、酶解时间、酶解温度、酶添加量为自变量,根据Box-Behnken设计,进行四因素三水平的响应面分析实验,以多糖得率为响应值,利用Design Expert 8.06软件对数据进行分析,因素水平设计见表1。

表1 响应面因素设计及水平Table 1 Factors and levels in response surface design
1.2.5桂花多糖体外抗氧化活性测定
1.2.5.1DPPH自由基清除能力测定取不同质量浓度的样品溶液2mL和2mL DPPH溶液(0.2mmol/L)混匀,反应30min后在517nm处测定其吸光度A1,同法测定2.0mL乙醇加样液的吸光度A2,以及2.0mL DPPH溶液与2.0mL蒸馏水的吸光度A0,以VC作为对照[11]。样品对DPPH自由基的清除率计算公式为:

1.2.5.2O2-·的清除能力测定取不同质量浓度的样品溶液1.0mL,加入pH8.2、浓度为50mmol/L的Tris-HCl缓冲液4.0mL,25℃水浴10min,再加入0.1mL浓度为25mmol/L的邻苯三酚,混匀保温5min后,即刻加入2滴10mol/L的HCl终止反应,读取溶液在波长325nm处的吸光度B1,同法测定用蒸馏水代替邻苯三酚后的吸光度B2,及以1.0mL蒸馏水替代样品溶液后的吸光度B0,以VC作为对照[12]。样品对O2-·的清除率计算公式为:

2 结果与分析
2.1酶法提取桂花多糖的单因素实验
2.1.1酶种类对多糖提取的影响结果如图1所示,纤维素酶解提取桂花多糖得率为15.12%,是热水浸提法的3.02倍,且大于中性蛋白酶和果胶酶的多糖得率。纤维素酶能够破坏胞壁结构,使胞内和胞壁中的多糖物质溶出,故后续实验选择纤维素酶。
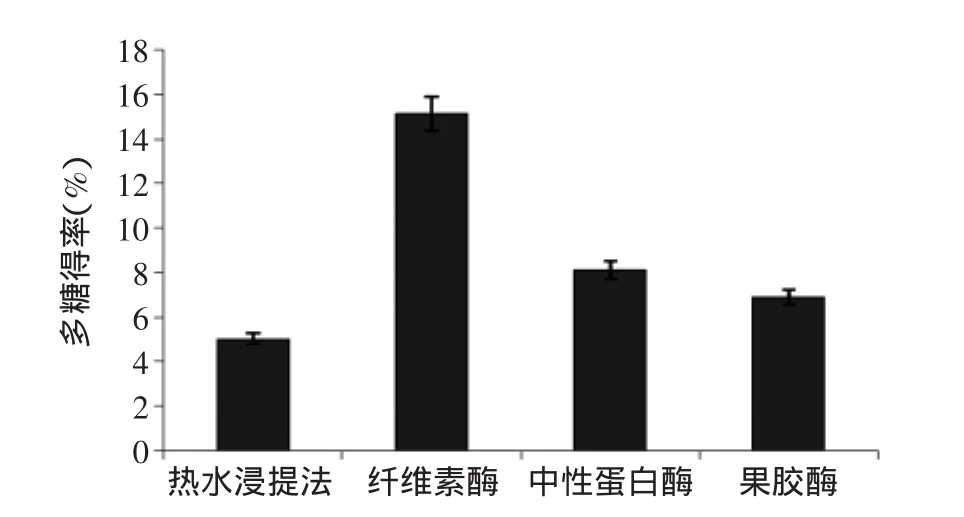
图1 酶种类对多糖得率的影响Fig.1 Effect of enzymes on the extraction rate of polysaccharide
2.1.2纤维素酶添加量对多糖得率的影响结果如图2所示,在液料比10∶1、pH5.0、酶解时间60min、酶解温度50℃的条件下,当酶添加量增加到8mg/mL时,多糖得率达到14.78%,随着酶添加量的进一步增加,多糖得率没有增加,说明在该底物浓度下,酶浓度已经趋于饱和,细胞内多糖已溶出,继续添加纤维素酶,对多糖得率没有影响,故酶添加量优化为8mg/mL。
2.1.3液料比对桂花多糖得率的影响结果如图3所示,在pH5.0、酶解时间60min、酶添加量8mg/mL、酶解温度50℃的条件下,多糖得率随着液料比的增加而增大,当液料比增加到10∶1时,多糖得率达到13.26%,之后,多糖得率趋于稳定,增加趋势变缓,考虑后续工艺处理及生产成本,控制液料比10∶1为宜。

图2 酶添加量对多糖得率的影响Fig.2 Effect of cellulase concentration on the extraction rate of polysaccharide

图3 液料比对多糖得率的影响Fig.3 Effect of the ratio of water to material on the extraction rate of polysaccharide
2.1.4酶解温度对多糖得率的影响结果如图4所示,在液料比10∶1、pH 5.0、酶解时间60min、酶添加量8mg/mL的条件下,当酶解温度为50℃时,多糖得率达到15.07%,当酶解温度为60℃时,多糖得率反而减小,这是因为温度过高导致酶活力下降,故最佳酶解温度选择50℃。

图4 酶解温度对多糖得率的影响Fig.4 Effect of enzymlysis temperature on the extraction rate of polysaccharide
2.1.5酶解时间对多糖得率的影响结果如图5所示,在液料比10∶1、pH5.0、酶解温度50℃、酶添加量8mg/mL的条件下,当提取时间大于60min后,多糖得率增加趋于平缓,因为酶解时间过长,酶的催化活性下降,进而对多糖得率影响不大,故最佳酶解时间选择60min。
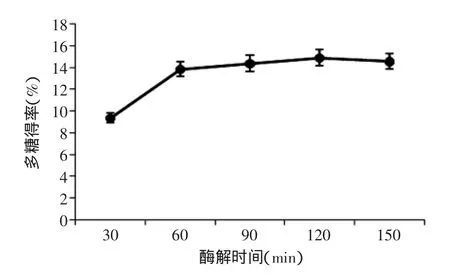
图5 酶解时间对多糖得率的影响Fig.5 Effect of enzymlysis time on the extraction rate of polysaccharide
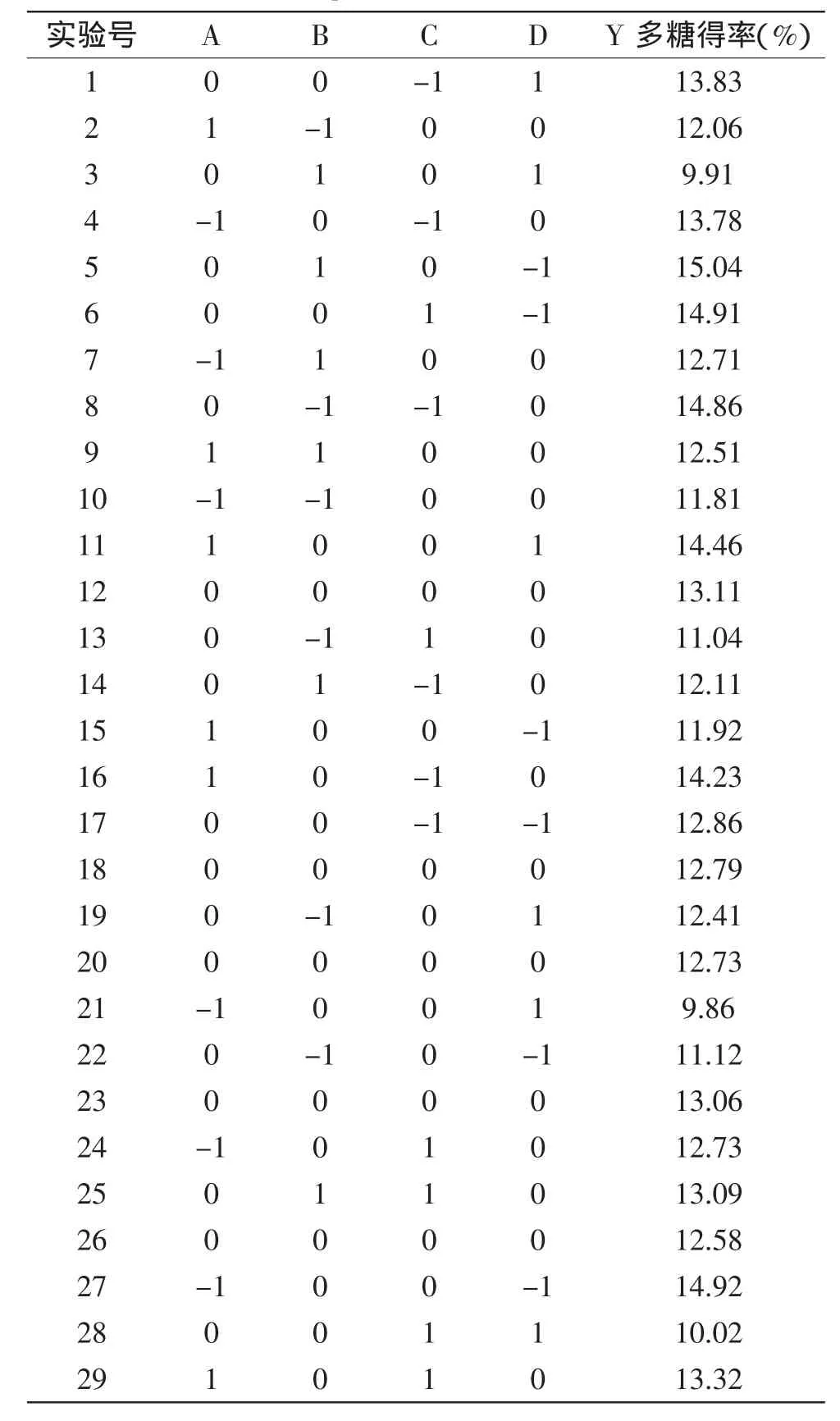
表2 多糖得率的响应面实验方案及结果Table 2 Response surface design arrangement and experimental results
2.2响应面优化实验
2.2.1响应面实验结果实验方案及实验结果见表2,回归模型方差分析见表3。
2.2.2结果分析及模型方程的建立对表3中数据进行回归拟合,得到自变量与多糖得率(Y)的二次多项回归方程为:

对该模型进行方差分析,结果如表3所示,该回归模型p<0.0001,方程模型达到极显著,失拟项p= 0.1216>0.05,不显著;该回归模型的总决定系数R2= 0.9670,调整决定系数,变异系数CV=2.93,以上参数均说明该模型拟合程度好,实验误差小,故该回归方程模型成立,可以用此模型对酶解提取桂花多糖进行分析及预测。
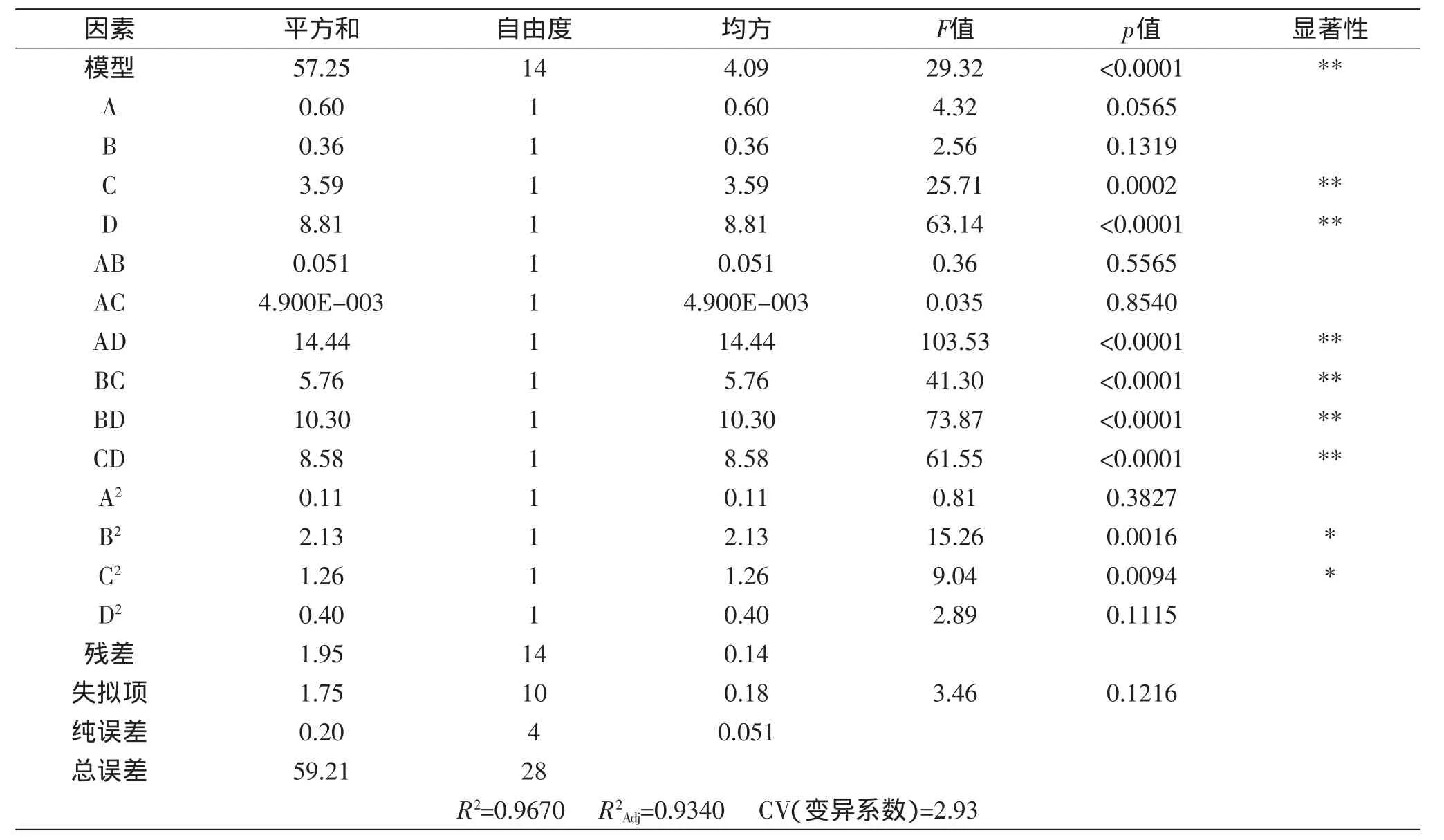
表3 拟合二次多项式模型的方差分析Table 3 The fitted quadratic polynomial model of ANOVA
由表3可知,纤维素酶提取桂花多糖的工艺参数中,影响多糖得率的因素按主次顺序排列:酶添加量(D)>酶解时间(C)>液料比(A)>酶解温度(B),其中C、D达到极显著水平,考察因素间交互作用,AD、BC、BD、CD存在交互作用且达到极显著水平。
2.2.3响应面分析利用 Design-Expert 8.06软件对表2中的数据进行二次多元回归拟合,酶添加量、液料比、酶解温度和酶解时间4个因素之间交互作用对多糖得率的影响如图6所示。由图6(c、d、e、f)和方差分析结果可知,AD、BC、BD、CD的交互作用对桂花多糖得率的影响极显著,AB、AC间交互作用对多糖得率的影响不显著。通过对回归模型求解方程并考虑实际操作的可行性,修正得出桂花多糖提取的最佳工艺为液料比8∶1(mL/g),酶解温度55℃,酶解时间80min,酶添加量6mg/mL,在此条件下多糖的最大得率为19.05%。
2.2.4优化工艺的验证实验为检验响应面法优化后的工艺可靠性,在上述最佳提取条件下,进行3组平行实验,所得多糖得率的平均值为18.43%,而回归方程所得的多糖得率理论预测值为19.05%,两者相对误差为3.25%,说明运用响应面法优化得到的模型参数准确可靠,能真实地反应各因素对桂花多糖得率的影响。
2.3桂花多糖体外抗氧化活性
2.3.1多糖对DPPH自由基清除作用由图7可知,随着质量浓度的增加,样品溶液多糖和VC对DPPH自由基清除率不断增大,多糖质量浓度10mg/mL时,样品溶液多糖对DPPH自由基清除率达到88.76%,具有较强清除DPPH自由基的能力,但比VC清除DPPH自由基的能力差。桂花多糖清除50%DPPH自由基的半数抑制浓度(IC50)为0.846mg/mL,VC的IC50为0.604mg/mL。
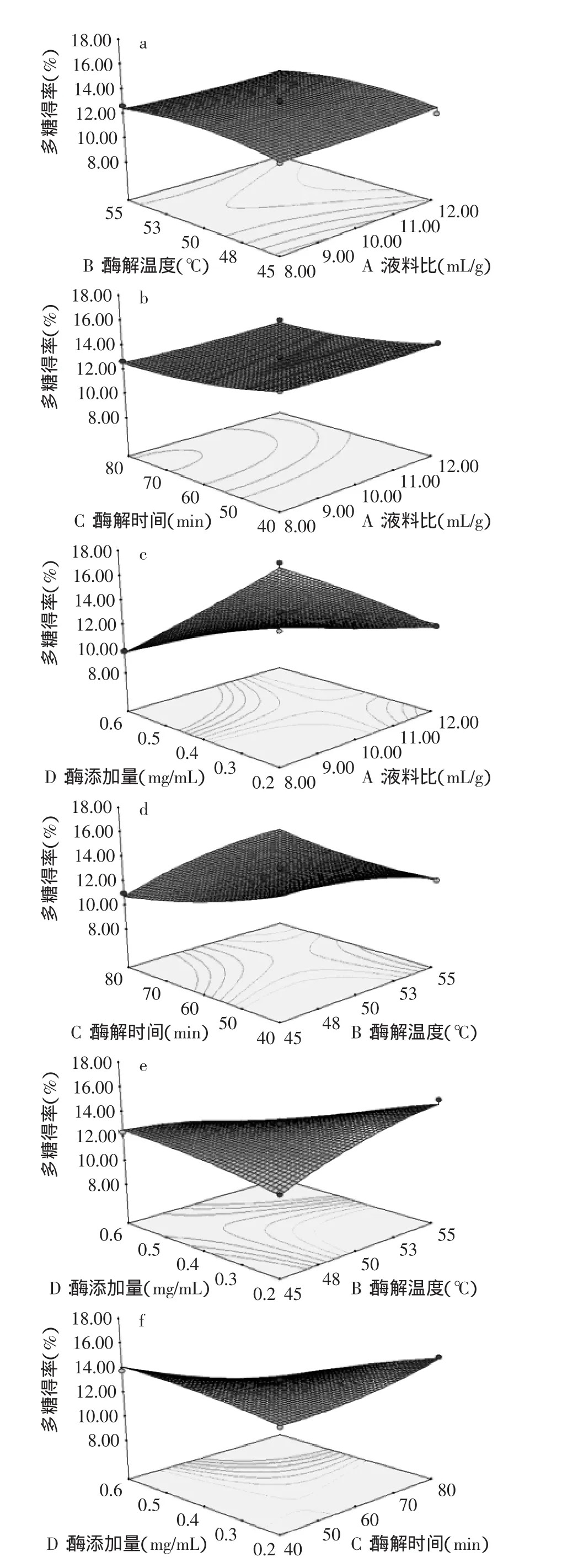
图6 各两因素交互影响多糖得率的响应面图Fig.6 Response surface plot for the mutual effects of four variables on extraction rate of polysaccharide

图7 样品多糖和VC对DPPH自由基的清除作用Fig.7 Scavenging capacity of sample polysaccharide and vitamin C on DPPH free radicals
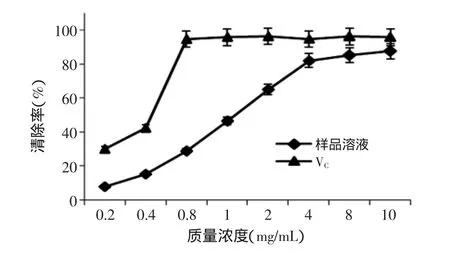
图8 样品多糖和VC对的清除作用Fig.8 Scavenging capacity of sample polysaccharide and vitamin C on superoxide anion free radicals
3 结论
通过单因素实验和响应面实验确定了纤维素酶提取桂花多糖的最佳工艺条件为:液料比8∶1mL/g、酶解温度55℃、酶解时间80min、酶添加量6.0mg/mL,此条件下多糖得率为18.43%,回归方程所得的理论预测值为19.05%,二者相对误差小于5%。此外,影响桂花多糖得率的因素按主次顺序依次为:酶添加量>酶解时间>液料比>酶解温度。
[1]陶遵威,郑夺,邸明磊,等.植物多糖的研究进展[J].药物评价研究,2010,33(2):148-152.
[2]安晓娟,冯琳,宋红平,等.植物多糖的结构分析及药理活性研究进展[J].中国药学杂志,2012,47(16):1271-1275.
[3]郑林龙,蒋剑平,许海顺,等.响应面法优化土茯苓多糖的提取工艺及抗氧化活性研究[J].中华中医药杂志,2014,29(3):918-922.
[4]陈贵堂,赵立艳,刘玮,等.响应面优化酶法辅助提取金针菇根部多糖的工艺研究[J].食品工业科技,2013,34(24):209-213.
[5]王书华,饶娜,安芳.金莲花多糖的分离纯化及其抗氧化作用研究[J].中成药,2013,35(11):2384-2389.
[6]孙长霞,苏印泉,张柏林.响应面分析法优化松萝多糖提取工艺的研究[J].食品工业科技,2014,35(5):196-201.
[7]蔡健,王薇,陈国威,等.桂花黄酮类化合物最佳提取工艺研究[J].粮油食品科技,2005,13(1):16-18.
[8]陶阿丽,戴一,华芳.桂花中总黄酮提取工艺及采收期研究[J].食品与发酵工业,2013,39(2):247-249.
[9]林志銮,陈培珍,王燕萍,等.桂花叶多糖提取工艺的优化[J].湖北农业科学,2012,51(5):986-988.
[10]李粉玲,蔡汉权,严赞开,等.酶法提取芦根多糖的研究[J].食品工业科技,2009,30(4):156-159.
[11]盛情情,王文侠,宋春丽,等.米糠阿魏酰低聚糖的纤维素酶法提取工艺及其抗氧化活性[J].食品与发酵工业,2013,39(12):197-203.
[12]刘玉芬,夏海涛,徐芹喜.海英菜多糖提取工艺的响应面法优化及其体外抗氧化作用[J].食品科学,2012,33(20):138-143.
Optimization of enzymatic extraction technology of polysaccharide from Osmanthus fragrans using response surface methodology and investigation on its antioxidant activity
JIANG De-qi1,2,HUANG Li-min1,WANG Yan2,LI Ming-xing2,DENG Heng-quan1,SU Long1,*
(1.Yulin Normal University,Yulin 537000,China;2.Department of Pharmacy,Zhujiang Hospital,Southern Medical University,Guangzhou 510282,China)
Objective:This study aimed to optimize the enzymatic extraction technology of polysaccharide from Osmanthus fragrans and investigate its antioxidant activity.Method:The response surface method(RSM)was adopted to establish the mathematical model,which used polysaccharides extraction rate as response value,and used the ratio of water to material,cellulase concentration,extraction temperature and extraction time as experimental factors to optimize the polysaccharide extraction conditions from Osmanthus fragrans.Antioxidant activity of polysaccharides was measured by DPPH and O2-·free radical elimination method.Result:The optimum conditions obtained by RSM were as follows,polysaccharide yield was most significantly affected by cellulase concentration,followed by extraction time,water to material ratio and extraction temperature.The concentration of cellulase was 6.0mg/mL,extraction time was 80min,the ratio of water to feedstock was 8∶1mL/g,extraction temperature was 55℃.Under the optimal conditions,the predicted extraction rate by mathematical model was 19.05%,while the experimental extraction rate was 18.43%,with a difference of less than 5%.IC50of DPPH andwere 0.846mg/mL and 1.256mg/mL,respectively.Antioxidant activity of sample polysaccharides was weaker than those of vitamin C.Conclusion:The optimum enzymatic extraction technology of the polysaccharides from Osmanthus fragrans by RSM was convenient and feasible,and the extracted polysaccharides had good antioxidant activity.
Osmanthusfragrans;polysaccharide;responsesurfacemethodology;enzymatic extraction;antioxidant activities
TS201.1
B
1002-0306(2015)02-0271-06
10.13386/j.issn1002-0306.2015.02.050
2014-05-07
蒋德旗(1986-),男,博士研究生,讲师,研究方向:药物生物技术。
苏龙(1978-),男,硕士研究生,副教授,研究方向:中草药生物转化。
玉林师范学院教改项目(12YJJG16);广西自然科学基金(2013GXNSFBA019178)。
