类泛素蛋白酶1及低氧诱导因子-1α在人卵巢癌组织中的表达及意义的探索
2015-10-21王伟
王 伟
(黄冈职业技术学院 医药卫生学院,湖北 黄冈 438000)
类泛素蛋白酶1及低氧诱导因子-1α在人卵巢癌组织中的表达及意义的探索
王伟
(黄冈职业技术学院 医药卫生学院,湖北 黄冈 438000)
目的:观察类泛素蛋白酶1和低氧诱导因子-1α在卵巢癌中的表达情况,并探讨类泛素蛋白酶1和低氧诱导因子-1α在卵巢癌中的表达相关性及其与卵巢癌临床病理特征之间的联系。方法:利用免疫组织化学的方法分别对卵巢的非肿瘤性病和肿瘤组织类泛素蛋白酶1及HIF-1α的表达进行了检测。结果:HIF-1α在非肿瘤性病卵巢组织中未见表达,在良性和交界性卵巢肿瘤组织中见少量表达。恶性卵巢肿瘤表达明显较高,在高级别恶性肿瘤中的表达明显高于低级别恶性肿瘤。肿瘤分化程度越低,HIF-1α的表达越显著。结论:人卵巢癌中存在SENP1和HIF-1α蛋白的高表达可能参与了卵巢癌的发生和进展及其恶性演进过程。联合检测SENP-1和HIF-1α的表达可能对人卵巢癌的分级、分期和预后判断有重要参考意义。
卵巢癌;类泛素蛋白酶1;低氧诱导因子1-α
在卵巢癌、子宫内膜癌和宫颈癌这三大妇科肿瘤中,卵巢癌的治愈率差、死亡率高。其肿瘤病理学分类多样,发病原因不清。随着我国工业化程度的增加,卵巢癌发病率有上升趋势[1]。卵巢癌作为实体肿瘤,低氧是其重要的生存微环境因素,为了适应低氧,增加氧的利用和减少氧的消耗,低氧诱导产生的低氧诱导因子(HIF-1)作为一个最重要的核转录因子,会激活卵巢癌肿瘤细胞的很多基因的转录活性异常,直接导致其一系列生物学行为改变,如红细胞的异常生长、刺激新生血管的形成、增加无氧糖酵解、减少有氧代谢及放、化疗耐受等,与卵巢癌的发生、进展、临床病理分期、分级及预后均相关[2]。目前对HIF-1的调控机制主要关注在其翻译后水平的调控,包括羟基化、乙酰化、磷酸化、泛素化和小泛素类蛋白化等机制,其中,类泛素蛋白酶1(SENP-1)对HIF-1α 的调控是通过去SUMO化过程来增加HIF-1α的稳定性越来越受到人们关注。其本身对肿瘤的血管生成有一定的促进作用[3]。因此,本研究通过免疫组织化学方法检测SENP-1和HIF-1α在卵巢恶性、交界性、良性肿瘤及非肿瘤性病组织中的表达情况,判断其临床诊疗价值。
1 材料与方法
1.1 材料
收集黄冈市各医院病理科2010~2014卵巢上皮性肿瘤标本共130例(标本全部为初治病例,术前均未进行放疗、化疗和免疫治疗等其他治疗)并查询其临床资料,另选10例非肿瘤病变的卵巢组织设为对照组。其中浆液性肿瘤50例,包括良性10例、交界性10例和恶性30例;粘液性肿瘤50例,包括良性10例、交界性10例和恶性30例;卵巢子宫内膜样腺癌20例和透明细胞癌10例。卵巢癌的病例中发病年龄:17~73岁,中位年龄50岁;临床分期:Ⅰ~Ⅱ期:28例,Ⅲ~Ⅳ期:62例;淋巴结转移:有:62例,无:28例。
1.2 方法
采用免疫组织化学染色法(EnVisionTM二步法)对上述实验病例(共140例)进行SENP-1和HIF-1α蛋白表达检测,并分析它们的表达情况与临床病理特征的相关性。
2 结果
(1)在上述140例实验病例中,免疫组化结果显示:SENP-1和HIF-1α在正常卵巢组织中无表达,而在130例肿瘤性病变中有不同程度的表达。其表达差异有统计学意义(P<0.05)。在肿瘤性病变中,SENP-1和HIF-1α在良性病变和交界性病变中均有少量表达,而在恶性病变中表达相对较高。其表达差异有统计学意义(P<0.05),并且SENP-1和HIF-1α在卵巢低级别癌的表达程度明显低于高级别癌的表达程度(P<0.05)。SENP-1和HIF-1α在10例透明细胞癌均有表达,与正常卵巢、良性病变及交界性病变的表达均有明显差异(P<0.05)(见表1、表2)。
(2)SENP-1和HIF-1α在卵巢上皮源性肿瘤中的表达存在明显的相关性(P<0.05)(见表3)。
(3)SENP-1和HIF-1α在卵巢癌中的表达与患者的临床分期(FIGO分期)和淋巴结转移有关(P<0.05),与年龄无明显关系(P>0.05)(见表4)。

表1 SENP-1在10例正常卵巢组织和130例卵巢上皮性肿瘤中的表达情况
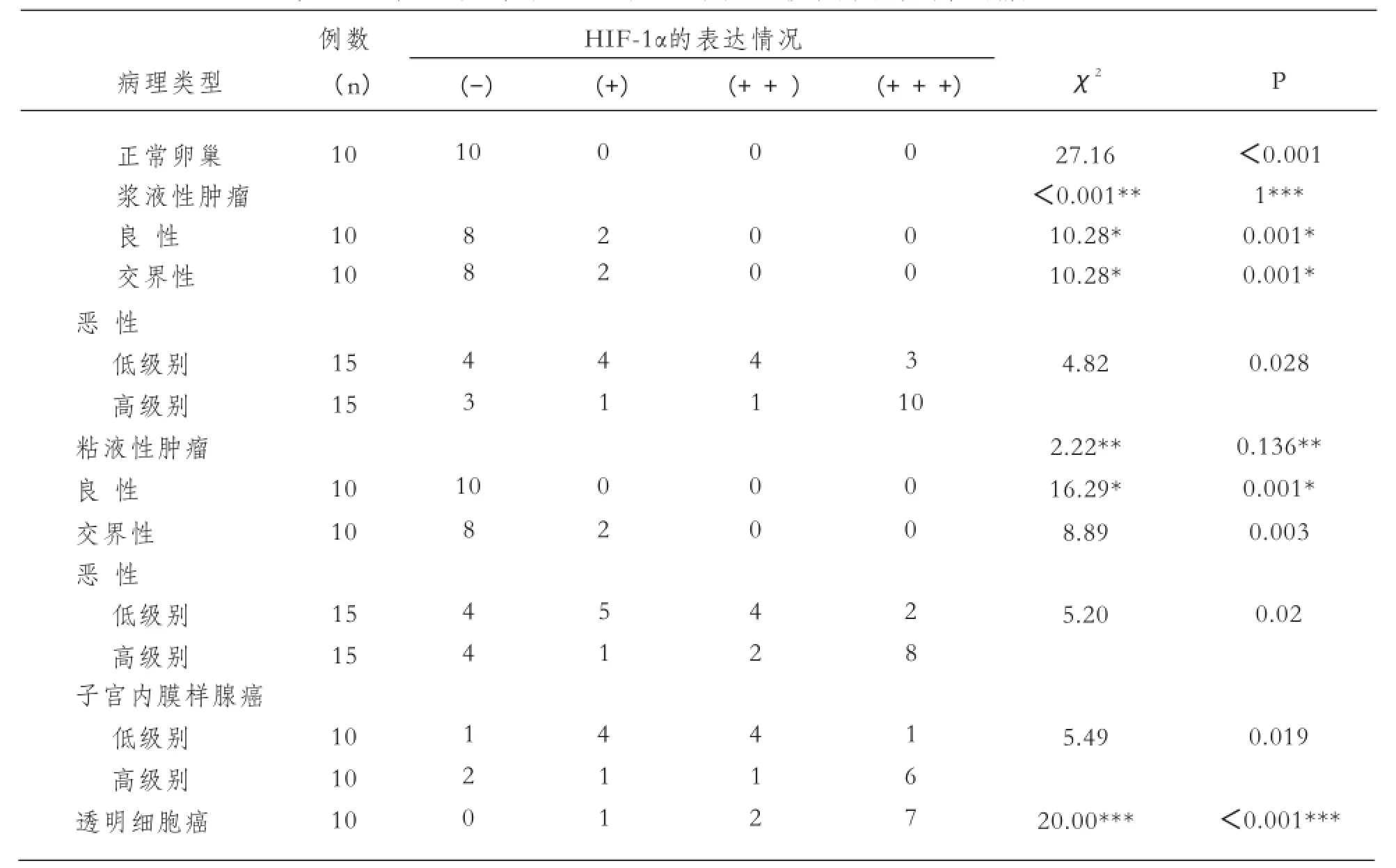
表2 HIF 在10例正常卵巢组织和130例卵巢上皮性肿瘤中的表达情况

表3 SENP-1和HIF-1α在卵巢癌中表达的相关性
3 讨论
本研究利用免疫组织化学的方法分别对正常卵巢组织、交界性卵巢肿瘤、恶性卵巢肿瘤分为浆液性卵巢癌、粘液性卵巢癌、子宫内膜样腺癌和卵巢透明细胞癌组织HIF-1α的表达进行了检测,发现HIF-1α 在正常卵巢组织中未见表达。但在良性卵巢肿瘤和交界性肿瘤组织中见少量表达。恶性卵巢肿瘤中的表达明显高于卵巢良性肿瘤、交界性肿瘤和正常卵巢组织,P<0.05, 差异有显著性意义。而且在高级别恶性肿瘤中的表达明显高于低级别恶性肿瘤,P<0.05, 差异有显著性意义。另外,我们还检测到在10例分化程度较低的卵巢透明细胞癌组织中也检测到HIF-1α明显表达,提示HIF-1α在恶性肿瘤中高表达,而且越是分化程度越低的肿瘤,HIF-1α的表达越显著。这一结果与Akiko H等[5]文献的报道相似。该文献报道用免疫组织化学方法检测HIF-1α蛋白表达水平,结果显示在正常卵巢、卵巢浆液性囊腺瘤、卵巢交界性浆液性囊腺瘤及卵巢浆液性囊腺癌组织中表达率呈上升趋势。在正常卵巢组织、卵巢交界性肿瘤和卵巢恶性肿瘤组织中HIF-1α mRNA表达阳性率呈上升趋势。另外,HIF-1α mRNA表达与卵巢癌的分化程度呈负相关。HIF-1α在卵巢癌早期阶段升高,并随着肿瘤进一步发展和组织病理分级等级增加而有明显增高趋势。可见HIF-1α在卵巢肿瘤从良性向恶性转化的过程中可能起到重要作用。Miyazawa等[6]研究发现卵巢癌中HIF-1α在蛋白水平上呈现出不同程度的强阳性表达,HIF-1α蛋白表达水平与肿瘤的FIGO临床分期、分级呈正相关,低分化卵巢癌表达HIF-1α更强,由此推测HIF-1α可能在卵巢癌的血管生成中起到重要作用。 Zhong H[7]等的报道显示HIF-1的增强表达发生于肿瘤早期,先于肿瘤的侵袭和血管的形成。HIF-1α蛋白在临床分期较晚、分化较低的卵巢癌组织中呈现高表达,可能是由于肿瘤生长过于迅速而导致组织血供不足而发生缺血坏死,诱导了HIF-1α蛋白的表达,而过表达的HIF-1α 也可以进一步促进新生血管的形成和激活广泛的下游靶基因,介导肿瘤适应低氧而发生进一步地侵袭和转移,加重预后不良。
这些研究均提示HIF-1α 在卵巢癌形成的早期就有表达,检测HIF-1α 的表达对于肿瘤的分期、分级和预后监测都是非常有意义的。可以明确HIF-1α是卵巢肿瘤发生恶性转化和转移的启动因子,如果能够阻抑启动,就能有效控制肿瘤及其恶性表象。目前已发现羟基化、磷酸化、乙酰化、S-亚基硝基化、泛素化及非泛素依赖性降解六种调节HIF-1的基本方式。其中,在常氧条件下,HIF-1在胞浆内主要经泛素-蛋白酶体途径降解[8]。在低氧情况下,类泛素蛋白酶-1(SENP-1)通过去SUMO化过程增加HIF-1α的稳定性的作用越来越受到人们的关注,而且,SENP-1其本身对肿瘤的血管生成有一定的促进作用,从而引起人们对其更多的关注。
小 泛 素 类 蛋 白 ( small ubiquitin-related modifier,SUMO)是一类小分子蛋白。其结构与泛素类似,目前已发现四种亚型, 即SUMO-1、SUMO-2、SUMO-3、SUMO-4。SUMO家族属于泛素样蛋白家族,是分子量约为12KD的小分子蛋白,从拟南芥到人类普遍存在表达。SUMO与泛素竞争同一赖氨酸修饰位点。SUMO与很多靶底物分子与共价结合,并对其进行翻译后修饰的过程叫做SUMO化(SUMOylation),通过对底物蛋白SUMO化修饰而改变其功能,胞内定位、和/或半衰期[9]。SUMO化与泛素化作用途径基本相似,但Sumo化并不介导底物蛋白降解,而且SUMOylation本身是个动态可逆的过程,可被特异性蛋白酶从SUMO化底物上去除,即去SUMO化[10]。去SUMO 化酶称为类泛素蛋白酶1(SENP1)。共有6种SENP,分别是SENP1~SENP6在哺乳动物中已被确定。SENP-1不需要分子氧作为底物,就能使HIF-1α 发生去SUMO化修饰。这一过程对于对维持低氧条件下HIF-1α的稳定性方面具有非常重要的作用。当SENP1缺失时,HIF-1α稳定性下降,提示我们去SUMO化修饰与HIF-1α蛋白降解有关。
体内肿瘤的低氧状态是无法改变的,SENP1对HIF-1α蛋白这种不依赖氧分子的调控机制非常重要,联合检测SENP1和HIF-1α 对于评价肿瘤的分级、分期和预后均很有价值,目前尚未见到卵巢癌组织中对SENP1的检测的报道。我们的研究发现,发现SENP1在10例正常卵巢组织中可见一例弱阳性表达。但在良性卵巢肿瘤中未见表达,在交界性肿瘤组织中见少量表达。SENP1在恶性卵巢肿瘤中的表达明显高于卵巢良性肿瘤、交界性肿瘤和正常卵巢组织,P<0.05, 差异有显著性意义。而且在高级别恶性肿瘤中的表达明显高于低级别恶性肿瘤,P<0.05, 差异有显著性意义。在10例分化程度较低的卵巢透明细胞癌中也能检测到SENP1的高表达,提示我们SENP1的表达在恶性肿瘤中高表达,而且越是分化程度越低的肿瘤,SENP1的表达越显著。
在对SENP1和HIF-1α 表达的相关性检测中发现,二者的表达呈正相关,二者的表达情况均与疾病的发生年龄无关,但是与淋巴结转移相关,有淋巴结转移的患者相对预后欠佳,但是却能发现SENP1和HIF-1α 的高表达。FIGO分期较晚的Ⅲ期和Ⅳ期患者组织切片中SENP1和HIF-1α 的表达明显增强。提示在从正常卵巢组织到良性肿瘤到交界性肿瘤直至卵巢恶性肿瘤的疾病演进过程中,可能是SENP1通过去SUMO化的过程实现了对HIF-1α的正向调控,参与了卵巢肿瘤的发生、进展、血管生成、种植、侵袭、转移和放、化疗耐受的恶性演进过程。
本研究说明人卵巢癌中存在SENP1和HIF-1α蛋白的高表达可能参与了卵巢癌的发生和进展及其恶性演进过程。联合检测SENP-1和HIF-1α的表达可能对人卵巢癌的分级、分期和预后判断有重要参考意义。
[ 1] Rofstad EK.Microenvironment-induced cancer metastasis. Int J Radiat Biol. 2000,76(5):589-605.
[2]Denko NC, Fontana LA, Hudson KM,et al. Investigating hypoxic tumor physiology through gene expression patterns.Oncogene.2003,1;22(37):5907-5914.
[3]Semenza GL, Nejfelt MK, Chi SM, et al. Hypoxia-inducible nuclear factors bind to an enhancer element located 3' to the human erythropoietin gene. Proc Natl Acad Sci U S A. 1991,1:88(13): 5680-5684.
[4]Semenza GL, Nejfelt MK, Chi SM, and Antonarakis SE. Hypoxia-inducible nuclear factors bind to and enhancer element located 3' to the human erythropoietin gene. Proc Natl Acad Sci USA 1991,88:5680-5684.
[5]Horiuchi A, Imai T, Shimizu M, et al. Hypoxia-induced changes in the expression of VEGF,HIF-1 alpha and cell cycle-related molecules in ovarian cancer cells[J]. Anticancer Res,2002,22(5):2697-2702.
[6]Miyazawa M, Yasuda M, Fujita M, et al. Association of hypoxia-inducible factor-1 expression with histology in epithelial ovarian tumors: a quantitative analysis of HIF-1[ J] . Arch Gynecol Obstet,2009,279(6):789-796.
[7]Zagzag D, Zhong H, Scalzitti J M, et al. Expression of hypoxia-inducible factor 1alpha in brain tumors: association with angiogenesis, invasion, and progression[J]. Cancer,2000,88(11):2606-2618.
[8]Wei W, Yu X D. Hypoxia-inducible factors:crosstalk between their protein stability and protein degradation[J].Cancer Lett,2007,257(2):145-156.
[9]Agbor T A, Taylor C T. SUMO, hypoxia and the regulation of metabolism[J]. Biochem Soc Trans,2008,36(Pt 3):445-448.
[10]Geiss-Friedlander R, Melchior F. Concepts in sumoylation: a decade on[J]. Nat Rev Mol Cell Biol,2007,8(12):947-956.
[11]刘丽愉,杨力芳,曹亚. 低氧诱导因子信号通路的研究新进展[J].国际病理科学与临床杂志, 2011(03).
[责任编辑:曾 华]
R737.31
A
1672-1047(2015)06-0129-05
10.3969/j.issn.1672-1047.2015.06.37
2015-10-13
王 伟,女,湖北黄冈人,讲师。研究方向:卵巢肿瘤。
