响应面设计优化复合酶法提取菊苣菊粉工艺研究
2015-10-21翟丹云陈兴都陈庆安赵莉莉杨晓丽
翟丹云,陈兴都,陈庆安,牛 婕,冯 平,赵莉莉,杨晓丽
(甘肃省商业科技研究所,甘肃兰州730010)
响应面设计优化复合酶法提取菊苣菊粉工艺研究
翟丹云,陈兴都,陈庆安,牛婕,冯平,赵莉莉,杨晓丽
(甘肃省商业科技研究所,甘肃兰州730010)
以菊苣根为原料,采用果胶酶和纤维素酶复合法提取菊粉。在单因素的基础上,选取料液比、温度、时间、pH为自变量,以菊粉提取率为响应值,通过Box-Behnken响应面实验设计对其提取工艺参数进行优化。结果显示复合酶法提取菊苣菊粉最优工艺为:料液比1∶8g/mL,提取温度60℃,提取时间2.5h,提取pH6.0,复合酶配比为1∶2的条件下,菊粉提取率可达到54.63%。与热水浸提法相比,提取率高出64.10%。
菊苣,菊粉,果胶酶,纤维素酶,响应面设计
菊苣(Cichorium intybus L.),又名苦苣、苦菊,为菊科菊苣属草本植物,广泛分布于亚欧大陆和北美等地,在我国陕西、甘肃、新疆、山西、河北、辽宁等地区种植[1],菊苣具有耐热耐寒、抗逆性强、适应性强等特点[2],是常见的药食两用型经济作物,具有丰富的营养价值和良好的生理功能[3]。除传统的作为蔬菜、牧草利用外,还可作为功能性食品等进行开发[4]。
菊粉(inulin)又称菊糖,是一类天然果聚糖的碳水化合物,具有低聚果糖和膳食纤维的特性[5],其结构是由果糖残基以β-(2-1)-糖苷键连接而成的直链多糖,末端或连有葡萄糖残基[6]。菊粉的主要功能有:降低血脂、血糖,调节能量代谢;促进矿物质的吸收和利用[7];维持肠内微生物菌群的平衡;增强人体的抗癌免疫机能[8]。因其菊粉特殊的生理功能,被大量用于食品、医药和化工行业[9]。
目前,酶法提取菊糖具有高效性、专一性,不引入其他杂质,同时不影响菊糖的组织结构和生物活性等特点[10],是当前研究的热点。对菊糖酶法提取的研究主要集中在果胶酶、蛋白酶等单酶上[10-11],但复合酶提取菊粉的研究报道很少。本实验以菊苣根为原料,通过复合酶法对菊粉的提取进行研究,获得菊粉提取的最优工艺参数,为菊苣资源的综合利用和深加工提供技术参考。
1 材料与方法
1.1材料与仪器
菊苣购于白银熙瑞生物工程有限公司,鲜菊苣采收,去叶,清洗,低温冰箱-18℃保藏,处理时常温解冻,清洗去皮,切成丝状(直径2~3mm),冰箱低温保存[12];果胶酶(酶活力20000U/g) 上海中秦化学试剂有限公司;纤维素酶(酶活力20000U/g) 白银赛诺生物科技有限公司;蒽酮、硫脲、D-果糖、盐酸、氢氧化钠、3,5-二硝基水杨酸等均为分析纯。
UV-3802型紫外分光光度计上海江仪仪器有限公司;GF-2型鼓风电热恒温干燥箱广州东方红医疗仪器厂;DK-S12型电热恒温水浴锅上海森信实验仪器有限公司;AL204型电子天平梅特勒-托利多仪器有限公司;GL-21M型湘仪离心机长沙湘仪离心机仪器有限公司;BCD-238S型低温冷冻冰箱青岛海尔股份有限公司;PHS-3C型pH计上海虹益仪器有限公司。
1.2实验方法
1.2.1菊粉提取率的测定参照杨振的方法[13],计算式为:菊粉提取率(%)=(提取液总糖质量×0.9-提取液还原糖质量)/原料中菊粉质量×100
还原糖浓度的测定:采用3,5-二硝基水杨酸(DNS)比色法[13]。取7支10m L的比色管,依次加入0.2、0.4、0.6、0.8、1.0、1.2、1.4m L的D-果糖标准液,蒸馏水定容至2m L,配成不同浓度的D-果糖反应液。分别加入2.0m L的3,5-二硝基水杨酸摇匀,沸水浴煮2m in显色,流水冷却,定容至25m L,540nm下测吸光值,以D-果糖浓度为横坐标,吸光度为纵坐标制作标准曲线和样品测定。依还原糖测定标准曲线的回归方程:y=0.0263x-0.0124(R2=0.9963)。
总糖浓度的测定:采用蒽酮比色法[14]。取7支比色管,依次加入0.5、1.0、1.5、2.0、2.5、3.0、3.5m L的D-果糖标准液,蒸馏水定容至2m L,配成不同浓度的D-果糖反应液,分别加入5.0m L冷的蒽酮溶液,混匀后沸水浴保持10m in,流水冷却20m in,定容至25m L,于620nm下测吸光值,以D-果糖浓度为横坐标,吸光度为纵坐标制作标准曲线和样品测定。依总糖测定标准曲线的回归方程:y=0.0804x+0.0113(R2= 0.9965)。
1.2.2提取单因素实验在预实验的基础上,选择纤维素酶与果胶酶复合法提取菊苣中菊粉,以料液比、提取温度、提取时间、提取pH、酶液浓度以及复合酶配比6个因素进行单因素实验,分别考察其对菊粉提取率的影响,确定各个因素的优化区间。
称取5.0g菊苣块茎丝,置于250m L的烧瓶中,在提取菊苣中菊粉的过程中控制体系料液比1∶8g/m L,温度60℃,时间2.5h,pH 6.0,果胶酶和纤维素酶的配比为1∶2,分别选择料液比为1∶8、1∶11、1∶14、1∶17、1∶20g/m L;温度为30、40、50、60、70℃;时间为1.0、1.5、2.0、2.5、3.0h;pH为4.0、5.0、6.0、7.0、8.0;酶液浓度为0.1、0.2、0.3、0.4、0.5%;果胶酶与纤维素酶配比为2∶1、2∶2、2∶3、2∶4、2∶5,加入柠檬酸-磷酸氢二钠缓冲液调节pH,热回流提取,过滤取上清液[11,15-17],备用。
1.2.3响应面实验设计在单因素实验的基础上,固定复合酶配比为1∶2,以料液比、温度、时间以及pH为自变量,菊粉提取率为因变量,通过中心旋转组合设计来筛选最优提取工艺参数[18-19],因素水平如表1所示。
1.2.4数据分析方法采用MicrosoftOffice Excle 2007和Design Expert 8.03软件数据分析。

表1 响应面设计因素水平表Table 1 Factors and levels of response surface design
2 结果与讨论
2.1提取工艺参数的确定
2.1.1料液比对菊粉提取率的影响由图1可知,随料液比增大,在两种酶制剂的作用下,提取液中菊粉提取率均呈逐渐下降的趋势。当料液比为1∶8g/m L时,果胶酶酶促反应下,菊粉提取率39.32%,比1∶11高出61.35%,而纤维素酶促反应下,菊粉提取率为51.20%,比1∶11高11.94%。这与钟丹等超声波提取牛蒡菊糖的工艺研究的结果有差异[20],这可能与原料的提取溶剂、其活性成分的结构不同有关。考虑到生产成本,因此本实验选取料液比为1∶8g/m L。
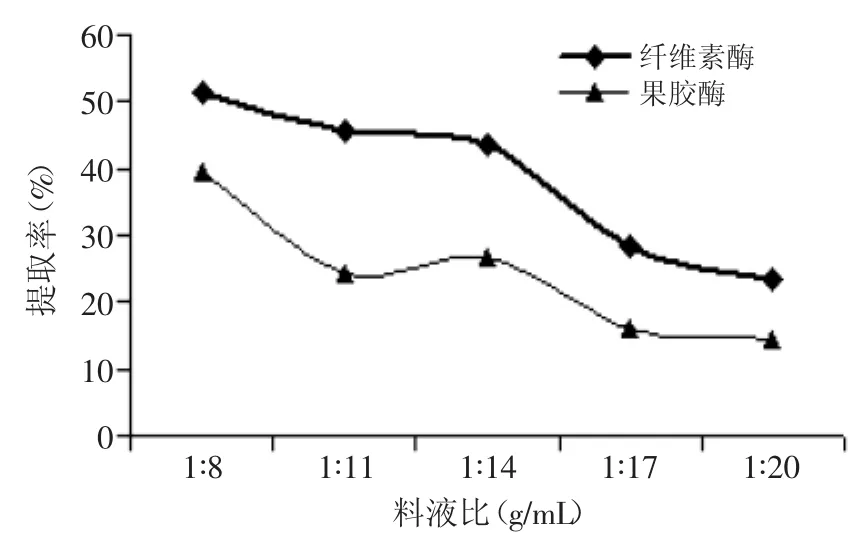
图1 料液比对菊粉提取率的影响Fig.1 Effectof ratio of solid to liquid on inulin yield

图2 提取温度对菊粉提取率的影响Fig.2 Effectof extraction temperature on inulin yield
2.1.2温度对菊粉提取率的影响由图2可知,随温度升高,在纤维素酶的作用下,菊粉提取率呈不断上升的趋势,60℃时菊粉提取率达到45.25%,比70℃低13.51%。而在果胶酶的作用下,菊粉提取率随温度的增加呈现先上升后下降的趋势,当温度为60℃时,菊粉提取率最高,达到37.40%。温度升高,会促使酶液分子受热扩散,增大与菊苣的接触程度,加速菊苣中菊粉的降解溶出。但温度过高,会抑制酶活性,甚至会引起酶失活变性,不利于菊粉溶出。因此暂时选取温度为60℃。
2.1.3时间对菊粉提取率的影响由图3可知,随提取时间的延长,在两种酶制剂的作用下,提取液中菊粉提取率均呈先上升后趋于稳定的趋势。纤维素酶促反应下,菊粉提取率在2.5h时菊粉提取率为45.95%,比时间2h高97.38%,比时间3h低8.47%。而果胶酶促反应下,提取时间在2.5h时菊粉提取率达到37.70%,比时间2h高144.81%,比时间3h低3.08%。在适宜的温度下,延长提取时间酶促反应使菊苣根中的菊糖迅速溶出,当达到扩散的动态平衡后,提取液中菊糖提取率趋于不变,这与胡建锋等菊芋中菊粉提取工艺比较研究结果类似[21]。因此本实验选取时间为2.5h。

图3 提取时间对菊粉提取率的影响Fig.3 Effectof extraction time on inulin yield
2.1.4pH对菊粉提取率的影响由图4可知,随提取pH的增加,在纤维素酶的作用下,提取液中菊粉提取率呈逐渐上升的趋势,当提取pH为7时,菊粉提取率达到42.59%,比pH 8低15.48%。而在果胶酶的作用下,提取液中菊粉提取率呈先上升后下降的总趋势,当提取pH为5时,菊粉提取率最高,为35.71%。可能原因是在最适提取pH下,菊苣细胞分解,菊粉迅速溶出,高于或低于最适pH,均会使酶活性受到抑制,菊粉的溶出率会下降。这与曹泽虹酶法提取牛蒡菊糖的结果一致[22]。因此,本实验暂定响应面设计时提取pH的0水平为6.0,通过响应面实验设计进一步优化其参数。

图4 提取pH对菊粉提取率的影响Fig.4 Effect of extraction pH on inulin yield
2.2复合酶比例的确定
2.2.1酶液浓度对菊粉提取率的影响由图5可知,在果胶酶的作用下,随酶液浓度的增大,提取液中菊粉提取率呈不断上升的趋势,在酶液浓度为0.5%时,提取率最高,为35.89%,比浓度0.4%高77.23%。而在纤维素酶的作用下,提取液中菊粉提取率呈先上升后下降的趋势,当酶液浓度为0.4%时,菊粉提取率最高,为43.34%。在适宜的条件下,增加酶液浓度,会增大与菊苣接触的表面积,加速菊粉的溶出。考虑到生产成本,本实验暂定果胶酶和纤维素酶浓度分别为0.2%和0.4%。
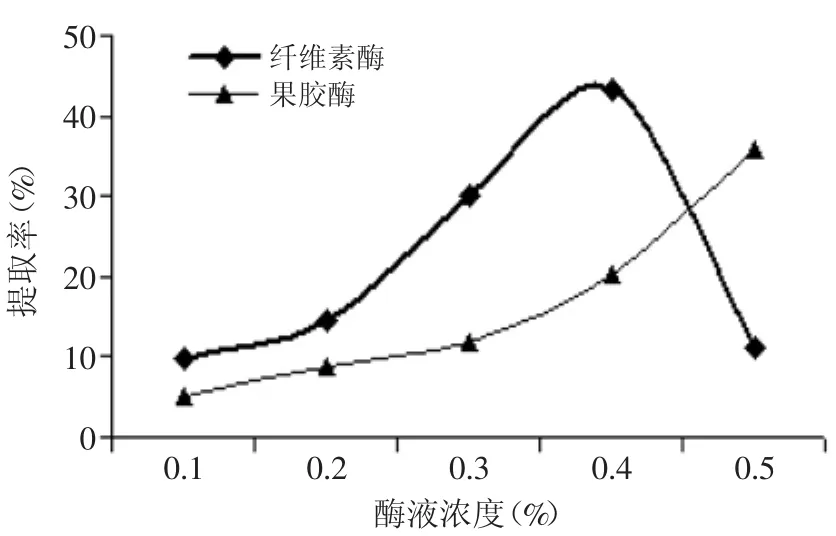
图5 酶液浓度对菊粉提取率的影响Fig.5 Effectof enzyme liquid concentratione on inulin yield
2.2.2复合酶配比对菊粉提取率的影响由图6可知,复合酶中随纤维素酶比例的增加,菊粉提取率呈先上升后下降的趋势,当果胶酶与纤维素酶比例为2∶4时,菊粉提取率最高为54.95%。因此,考虑到生产成本和产品质量。本实验选取果胶酶和纤维素酶比例为2∶4,即1∶2。

图6 复合酶配比对菊粉提取率的影响Fig.6 Effectof the ratio of compound enzymes on inulin yield
2.3响应面实验设计结果分析
菊粉提取响应面设计实验结果如表2所示,利用Design-expert 8.06进行回归拟合,得到自变量与菊粉提取率(Y)的二次多项回归方程为:Y=33.86-0.58A+ 0.34B+0.12C-3.70D+6.53AB-2.54AC-1.37AD+2.12BC+ 2.66BD-2.32CD-0.58A2+0.83B2-3.32C2-2.58D2。
为确定响应面实验设计中4个实验因素对菊粉提取效果的影响,以及各个因素的交互作用和显著性,进行回归方差分析(表3)。结果显示:模型p<0.01,相关系数R2为0.9162,校正系数R2Adj为0.8380,响应变量高于0.80,模型回归极显著,各因素之间的交互作用见图7~图12。失拟项不显著(p>0.05),表明该回归方程对菊苣复合酶法提取实验拟合情况良好。通过模型系数显著性检验,得到提取因素的主效应关系:D>A>B>C,即pH>料液比>温度>时间,其中A2对提取效果影响显著,而因素D、C2、D2对菊粉提取效果有极显著的影响。

表2 Box-Behnken实验设计结果Table 2 Design and results of Box-Behnken test
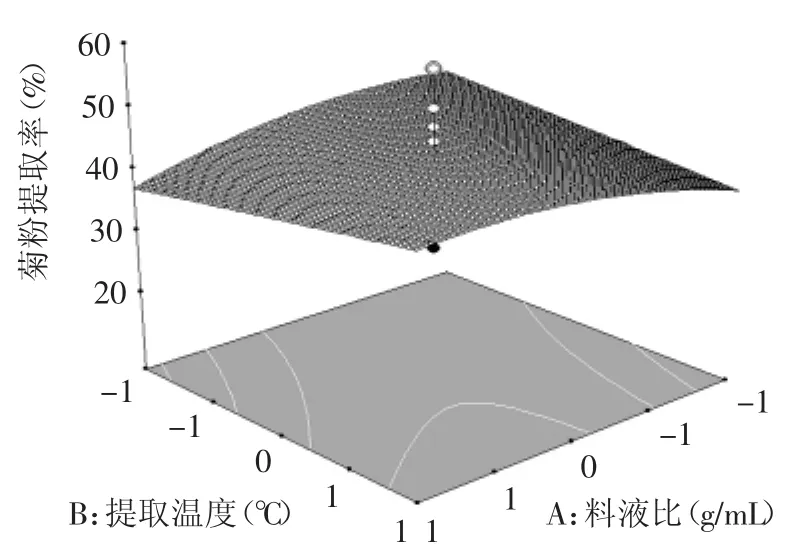
图7 料液比和提取温度对菊粉提取率的影响Fig.7 Effectof ratio of solid to liquid and extraction temperature on inulin yield

表3 方差分析结果Table 3 Results of variance analysis

图8 料液比和提取时间对菊粉提取率的影响Fig.8 Effectof ratio of solid to liquid and extraction time on inulin yield

图9 料液比和提取pH对菊粉提取率的影响Fig.9 Effectof ratio of solid to liquid and extraction pH on inulin yield
通过复合酶破碎降解菊苣果肉细胞,便于菊粉充分溶出,响应面设计优化菊粉的最优提取工艺为:料液比1∶8g/m L、温度60℃、时间2.5h、pH6.0。在此条件下,菊苣中菊粉提取率预测值为55.17%,验证实验值为54.63%,实际值与预测值之间的相对误差为0.98%。而通过实验验证,最优热浸提条件(料液比1∶8g/m L,提取温度75℃,提取时间2h),菊粉的提取率可达33.29%。因而,复合酶法的提取效率比热水浸提高出64.10%。

图10 提取温度和提取时间对菊粉提取率的影响Fig.10 Effectof extraction temperature and time on inulin yield

图11 提取温度和提取pH对菊粉提取率的影响Fig.11 Effectof extraction temperature and pH on inulin yield

图12 提取时间和提取pH对菊粉提取率的影响Fig.12 Effectof extraction time and pH on inulin yield
3 结论
3.1在单因素实验的基础上,通过响应面实验优化酶法提取菊苣菊粉工艺,确定出果胶酶和纤维素酶最优比例为1∶2。通过响应面设计优化菊苣中菊粉提取工艺,确定最佳复合酶提取条件:料液比1∶8g/m L,温度60℃,时间2.5h,pH 6.0。
3.2在最优提取条件下,测得其菊粉提取率为54.63%,比热浸提下高出64.10%。经过复合酶法提取的粗提液中含有蛋白质、色素、果胶、有机酸等杂质,需要进一步纯化、精制,以提高菊粉的利用率。
[1]柳溪,王晓蕾.新鲜菊苣提取和纯化菊粉的工艺[J].食品研究与开发,2013,34(13):37-40.
[2]张玉,白史且,李达旭,等.菊苣开发与利用[J].中国野生植物资源,2009,28(4):10-14.
[3]徐雅梅,高国荣.菊苣的开发与利用研究综述[J].安徽农业科学,2009,37(28):13569-13571.
[4]徐伟君,张九东,陶贵荣,等.野生菊苣营养成分分析[J].北方园艺,2012(3):30-31.
[5]张晓玲.菊苣综合利用与菊粉的纯化及活性研究[D].杨凌:西北农林科技大学,2008.
[6]彭英云,郑清,张涛.菊粉的功能与利用[J].食品研究与开发,2012,33(10):236-240.
[7]李雨露,刘丽萍,佟丽媛.菊粉的特性及在食品中的应用[J].食品工业科技,2013,34(13):392-394.
[8]Monasteroloa R C,Llauradoa M G,Rubio-Torrentsa C,etal. Safety and efficacy of inulin and oligofructose supplementation in infant formula:Results from a randomized clinical trial[J]. Clinical Nutrition,2013,32(6):918-927.
[9]王金刚,杜宁娟.菊粉的工业化生产技术与发展前景[J].食品工业科技,2008,29(11):309-312.
[10]陆慧玲,胡飞.酶法提取菊糖工艺的研究[J].食品工业科技,2006,27(10):158-160.
[11]李雪雁,陈晓前,王玉丽.果胶酶浸提菊芋菊糖的研究[J].食品工业科技,2009,30(11):223-225.
[12]肖仔君,朱定和,王小红,等.菊芋中菊粉提取工艺的研究[J].现代食品科技,2013,29(2):315-318.
[13]杨振,杨富民,王雪燕.菊苣中菊粉提取工艺优化研究[J].甘肃农业大学学报,2009,44(5):147-151.
[14]何新华,刘玲,张静,等.菊苣总糖和菊粉提取工艺条件优化[J].食品研究与开发,2009,30(8):76-79.
[15]高向阳.食品分析与检测[M].北京:中国计量出版社,2006:130-135.
[16]孔涛,吴祥云.菊芋中菊糖提取及果糖制备研究进展[J].食品工业科技,2013,34(18):375-378.
[17]Gaafar A M,Boudy E A,El-Gazar HH,et al.Extraction Conditions of Inulin from Jerusalem Artichoke Tubers and its Effects on Blood Glucose and Lipid Profile in Diabetic Rats[J]. Journal of American Science,2010,6(5):36-43.
[18]贺寅,王强,钟葵.响应面优化酶法提取龙眼多糖工艺[J].食品科学,2009,32(2):79-83.
[19]易建华,朱振宝.响应面优化酶法提取芹菜黄酮工艺研究[J].食品科学,2009,30(10):92-96.
[20]钟丹,张建新,张世恒.超声波提取牛蒡菊糖的工艺研究[J].西北农业学报,2008,17(2):297-300.
[21]胡建锋,邱树毅.菊芋中菊粉不同提取工艺比较研究[J].贵州农业科学,2009,37(10):181-183.
[22]曹泽虹,董玉玮,苗敬芝,等.酶法提取牛蒡菊糖的研究[J].食品工程,2009(11):143-146.
Study on optim ization on com posite enzyme extraction process of inulin from Cichorium intybus L.by response surface design
ZHAIDan-yun,CHEN Xing-du,CHEN Qing-an,NIU Jie,FENG Ping,ZHAO Li-li,YANG Xiao-li
(Gansu Institute of Business and Technology,Lanzhou 730010,China)
In this experiment,w ith chicory rootas a raw material,pectinase and cellulase com pound p reparations was used to extract inulin.Four extraction parameters inc luding the ratio of material and solvent,extraction tem perature,extraction time and extraction pH were op tim ized as the result of the conditions for maximum extraction of inulin from Cichorium intybus L.by Box-Behnken response surface design methodology based on the inulin extraction rate as a response value.Results showed that the op timum cond ition of inulin extraction was as follows the ratio of material and solvent 1∶8g/m L,extraction tem perature 60℃,extraction time 2.5h,extraction pH6.0,and the ratio of compound enzymes 1∶2.Under this cond ition inulin extraction rate was up to 54.63%.The extraction rate inc reased by 64.10%,com pared w ith the method of hotwater extrac tion.
chicory;inulin;pec tinase;cellulase;response surface design
TS201.1
A
1002-0306(2015)06-0190-05
10.13386/j.issn1002-0306.2015.06.034
2014-07-03
翟丹云(1964-),女,本科,高级工程师,注册咨询工程师,主要从事食品工程等相关方面的研究。
甘肃省技术研究与开发专项计划(1207TCYA039);甘肃省科技厅科技支撑计划(2011GS0408)。
