核桃仁去衣液中核桃黄酮的回收及抗氧化活性研究
2015-10-21赵声兰陈朝银李汝荣张天财武万兴史丹丹
宋 浩,赵声兰,陈朝银,*,李汝荣,张天财,武万兴,史丹丹
(1.昆明理工大学生命科学与技术学院,云南昆明650500;2.云南中医学院中药学院,云南昆明650500;3.大理漾濞核桃有限责任公司,云南大理672500)
核桃仁去衣液中核桃黄酮的回收及抗氧化活性研究
宋浩1,赵声兰2,陈朝银1,*,李汝荣3,张天财1,武万兴1,史丹丹1
(1.昆明理工大学生命科学与技术学院,云南昆明650500;2.云南中医学院中药学院,云南昆明650500;3.大理漾濞核桃有限责任公司,云南大理672500)
以核桃乳生产过程中核桃仁去衣时的浸泡液和碱液为原料,研究了用AB-8型大孔树脂分离和纯化核桃黄酮的工艺条件,分别进行了静态和动态吸附与解吸实验。结果表明:AB-8树脂能够很好的分离纯化核桃仁去衣液中的核桃黄酮,在确定的工艺条件下,核桃黄酮的纯度为61.35%~74.16%,回收率为81.73%~86.51%。所得核桃黄酮对DPPH自由基、超氧阴离子自由基、羟基自由基清除率的IC50分别为1.460~1.911μg/mL、4.391~6.294mg/mL、0.415~0.472mg/mL。表明核桃仁去衣液是一种良好的核桃黄酮生产原料,是一种理想的天然抗氧化产品。
浸泡液,碱液,黄酮,抗氧化活性
核桃仁富含核桃多酚类物质,且主要集中在核桃种皮或核桃衣中[1],但在核桃乳加工过程中,通常需将核桃仁种皮除去[2-3]。目前,核桃仁去皮方法应用最广泛的为碱液去皮法[4]。核桃仁经浸泡及去衣,其多酚与黄酮含量分别下降81.7%和72.2%。此外,碱液去皮产生的废水COD为20000mg/L左右,大大超过国家二级污水排放标准[5]。企业每生产一吨核桃乳,将会产生数吨废水,废水大量的排放,又会造成附近的田地、水质等环境污染,给企业的生存和发展带来巨大压力[6-7]。
核桃仁已知含有芦丁、鞣花酸、红景天苷、长寿花苷、槲皮素、儿茶素等黄酮类化合物[8-10],是一类具有很强抗氧化活性的天然抗氧化剂,具有清除自由基、预防心血管疾病、防癌、抗辐射、延缓机体衰老等功能[11-13]。核桃仁去衣液中核桃黄酮类化合物的开发利用研究目前尚未见报道。因此,本文研究AB-8树脂对核桃仁去衣液中核桃黄酮类化合物的回收利用技术,并对核桃仁去衣液中核桃黄酮的体外抗氧化活性进行系统研究,以期为核桃乳企业废水的利用提供参考依据。
1 材料与方法
1.1材料与仪器
核桃乳生产中的废水来自云南省大理漾濞有限责任公司,备用;芦丁标准品上海同田生物技术股份有限公司;AB-8大孔吸附树脂天津南大树脂科技有限公司;1,2-二苯基代苦味肼基自由基(DPPH) Sigma公司;亚硝酸钠、硝酸铝、无水乙醇等试剂均为分析纯。
FA2104型电子分析天平上海天平仪器厂;VAL-1N酒精计上海振捷实验设备有限公司;SP-2000UV型紫外可见分光光度计Amersham Biosciences;RE-52A型旋转蒸发仪、SHD-Ⅲ型循环水式多用真空泵、101-2型冷冻干燥机、HH-S型恒温水浴锅郑州长城科工贸有限公司。
1.2实验方法
1.2.1芦丁标准曲线的绘制黄酮采用芦丁作对照品,并参照Sheng的方法制作标准曲线[14]。
1.2.2碱处理液与浸泡液的获取将核桃仁放入不锈钢网框中,加入80℃热水浸泡5m in,取出核桃仁,剩下的水样即为浸泡液;上述取出的核桃仁放入含有1%~5%NaOH的碱水槽中,5m in后取出核桃仁,剩下的碱水即为碱处理液。
1.2.3碱处理液与浸泡液上柱样品液的制备取废液各500m L,静置沉淀,然后真空抽滤各两次,除去其中的滤渣和仁皮。测定各废液中黄酮的含量,并根据需求用盐酸和NaOH溶液调节废液的pH,备用。
1.2.4核桃乳加工过程中废液中黄酮含量的测定
精确称量1L水样,真空抽滤,收集滤液置旋转蒸发仪中浓缩后冷冻干燥,称重。取1g干燥物用60%乙醇定容至100m L,吸取样品液2m L,按照标准曲线的方法测定吸光值后,然后根据标准曲线计算黄酮的含量。
1.2.5树脂的预处理将AB-8树脂用95%乙醇浸泡24h,用蒸馏水洗去乙醇;然后用5%HCl溶液浸泡4h,用蒸馏水洗至中性;再用5%NaOH溶液浸泡4h,用蒸馏水洗至中性。
1.2.6AB-8树脂对碱处理液与浸泡液黄酮的静态吸附-解吸实验准确称取处理好的AB-8树脂5g,置于250m L锥形瓶中,加入处理过的碱处理液与浸泡液各100m L,25℃恒温振荡,在12h内,每小时取1m L,测黄酮含量,绘制静态吸附动力学曲线。然后将吸附有黄酮的树脂,用80%的乙醇洗脱,25℃恒温振荡12h,测定其黄酮含量,AB-8树脂对碱处理液与浸泡液的吸附量,解吸量与解吸率按下式计算:

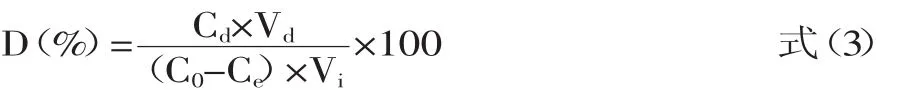
式中,Qe为树脂吸附量(mg/g);Qd为解吸量(mg/g);D为解吸率(%);C0为黄酮初始浓度(mg/g);Ce为吸附平衡时的黄酮浓度(mg/g);Cd为解吸后溶液中黄酮浓度(mg/g);Vi为加入的样品溶液体积(m L);Vd解吸液体积(m L);W为干树脂重量(g)。
1.2.7AB-8树脂对碱处理液与浸泡液黄酮的动态吸附-解吸实验将预处理好的AB-8树脂装入玻璃层析柱(1.6cm×40cm),采用湿法装柱,使柱床体积为30nm。将调成最适pH的200m L的碱处理液和浸泡液分别以不同的流速上柱,分段收集流出液,并测定其黄酮含量。吸附液全部流过后,用蒸馏水过柱至流出液无色,然后用80%的乙醇对其进行洗脱,分段收集洗脱液,测定其黄酮含量,绘制洗脱曲线。
1.2.8核桃仁去衣液中核桃黄酮回收率与纯度的测定将碱处理液与浸泡液按最佳工艺上柱洗脱,收集洗脱液,测定黄酮浓度,蒸发浓缩后冷冻干燥,计算黄酮的回收率和纯度。
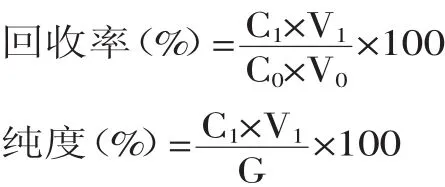
其中,C0为上样黄酮浓度(mg/m L);C1为洗脱液中黄酮浓度(mg/m L);V0为上样溶液体积(m L);V1为洗脱液体积(m L);G为黄酮提取物干重(mg)。
1.2.9碱处理液与浸泡液黄酮体外抗氧化活性测定
1.2.9.1DPPH自由基清除能力[15]将2m L不同浓度的碱处理液与浸泡液样品加入到2m L 0.1mol/L DPPH溶液中(95%乙醇配制),混合均匀,然后在暗室中振荡60min,在517nm处测得吸光值A1,样品液与95%乙醇溶液为空白记A0,DPPH与95%乙醇的混合液为A2。清除率计算公式为:
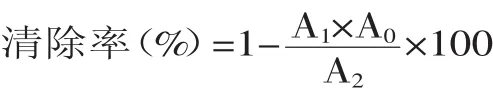
1.2.9.2超氧阴离子(O2-·)自由基清除活性采用邻苯三酚自氧化法[16]。吸取不同浓度的样品溶液1m L,加入4m L pH8.2 Tris-HCl缓冲液中,25℃水浴20m in,然后加入1m L邻苯三酚溶液,反应5m in,加入1m L 8.0mol/L的HCl溶液终止反应,在325nm处测吸光值Ai,以去离子水代替样品液为空白,测定吸光值Ap。按下式计算清除率:
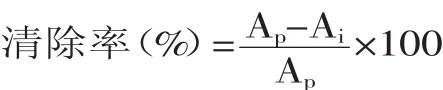
1.2.9.3羟自由基(·OH)清除能力的测定采用邻二氮菲-Fe2+氧化法[17],取0.75mmol/L的邻二氮菲溶液1m L于试管中,依次加入0.2mol/L pH7.4磷酸盐缓冲液2m L、蒸馏水1m L、0.75mmol/L硫酸亚铁液1m L,充分混匀,然后加入不同浓度样品溶液1m L与0.01%的H2O21m L,于37℃下恒温反应60min,于536nm测其吸光度记为A1。用等体积蒸馏水代替样品溶液,测得吸光值A2。用等体积蒸馏水代替样品溶液,等体积蒸馏水代替0.01%双氧水,测得吸光值A3。羟自由基清除能力的计算公式如下:
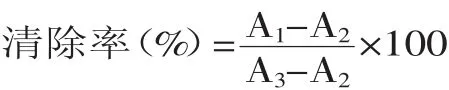
1.2.10数据统计所有实验均重复3次,结果所列数据是3次重复的平均值。采用SPSS软件对数据进行处理,实验数据采用ANOVA进行多重差异分析(p<0.05)。
2 结果与分析
2.1芦丁标准曲线
芦丁标准曲线的回归方程为Y=0.0096X+0.0191,R2=0.9906。表明芦丁标准曲线在0~90μg/m L范围内具有良好的线性关系。
2.2样品中黄酮的含量及AB-8树脂的静态吸附解吸结果
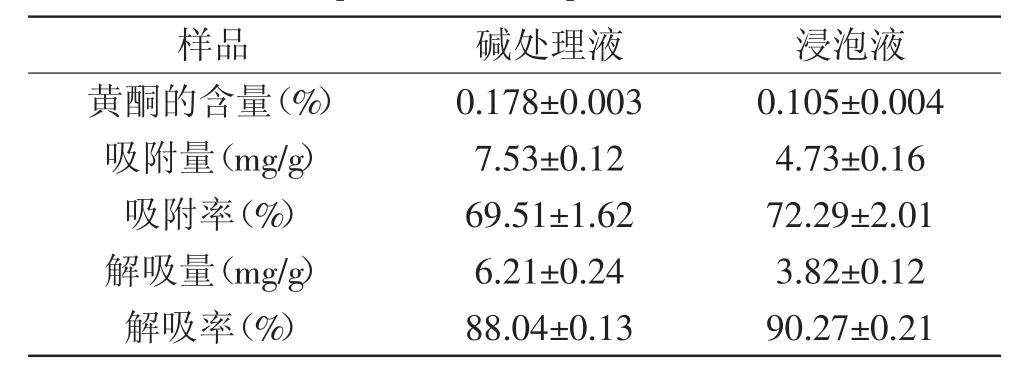
表1 废液中黄酮含量与静态吸附及解吸结果Table 1 Flavonoid contentofwastewater and resultof static adsorption and desorption of AB-8 resin
由表1可知,碱处理液与浸泡液中黄酮的含量分别可达0.178%与0.105%。由于碱处理液与浸泡液来源广泛,因此,具有较好的回收潜力。并且,一种好的树脂,不但要有良好的吸附能力,还要有好的解吸能力[18]。从表1中可以看出,AB-8树脂对其吸附效果和解吸效果良好。
2.2.1AB-8树脂的静态吸附动力学特征通常在达到吸附饱和之前,黄酮的吸附能力随着吸附时间的延迟而持续增长[19]。由图1可以看出,碱处理液在吸附4h后,AB-8树脂的吸附量随着时间的增加变化很小,即说明树脂基本达到吸附平衡。浸泡液在吸附3h后,树脂的吸附量基本达到吸附平衡。因此,碱处理液与浸泡液采用的静态吸附时间分别为4h与3h。
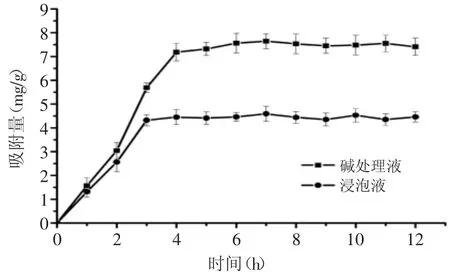
图1 AB-8树脂吸附黄酮的动力学曲线Fig.1 Adsorption kinetics curves for flavonoid on AB-8 resin
2.2.2pH对静态吸附作用的影响溶液的pH作为一个重要参数影响着树脂对其的吸附效果,pH影响溶质的离子化程度,从而影响溶质和溶剂之间的亲和力[20]。从表2可以看出,随着pH的降低,AB-8树脂对碱处理液与浸泡液黄酮的吸附量逐渐升高。其原因可能是黄酮类化合物为多羟基酚类,呈弱酸性,故要达到良好的吸附效果,必须在酸性或偏酸性条件下进行,在此条件下,黄酮类物质呈分子状态被吸附,吸附量大[21]。同时从企业角度考虑,碱处理液与浸泡液pH的改变,意味着投入成本的增加。因此,综合考虑选择pH分别为7(碱处理液)和6(浸泡液)作为最适pH。
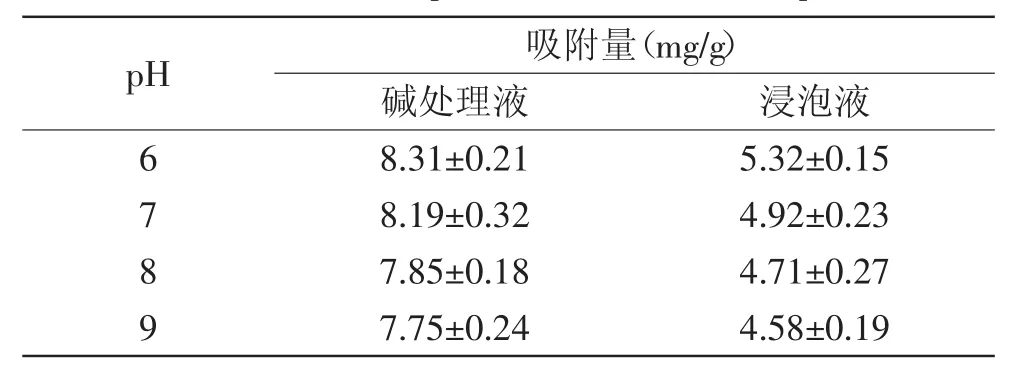
表2 pH对静态吸附作用的影响Table 2 Effectof pH values to static adsorption
2.2.3动态泄露曲线通常当流出液中黄酮浓度达到上样液中黄酮浓度的1/10时,认为已经发生泄漏[22]。将碱处理液与浸泡液分别通过AB-8树脂层析柱,上样速度为1m L/m in,分段收集并测定黄酮浓度。由图2可知,随着上样液体积的增加,流出液中黄酮含量也逐渐提高,即树脂对黄酮的吸附效果随上样体积的增加而下降。因此,选择50m L和90m L分别作为碱处理液与浸泡液的上样量。
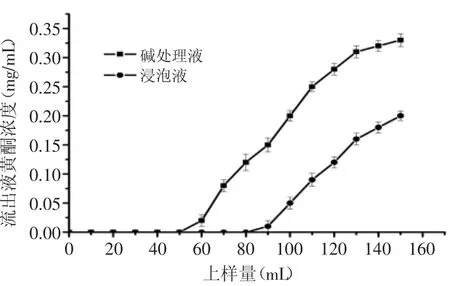
图2 吸附泄露曲线Fig.2 Adsorption leakage curve of flavonoid
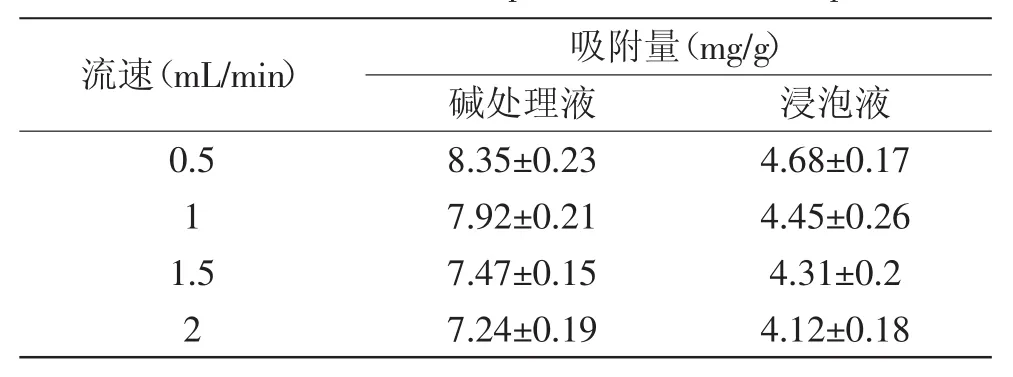
表3 上样流速吸附效果的影响Table 3 Effect of the sample flow rate on adsorption
2.2.4上样流速的选择由表3可知,随着上样液流速的增加,AB-8树脂对黄酮的吸附量逐渐下降。原因是黄酮溶液越慢通过树脂柱,越能和树脂充分接触,从而提高吸附效果,随着流速的增大,吸附量就会降低[23]。从工业化生产成本上考虑,为了缩短工艺时间,有保证工艺效果,因此选择上样流速为1m L/m in。
2.2.5洗脱液体积对黄酮吸附效果的影响按上述实验得到的最佳条件,将碱处理液和浸泡液分别上柱,吸附饱和后,用80%的乙醇洗脱,分段收集洗脱液。从图3可以看出,用5BV的80%乙醇洗脱可以将绝大部分黄酮从树脂上洗脱下来。
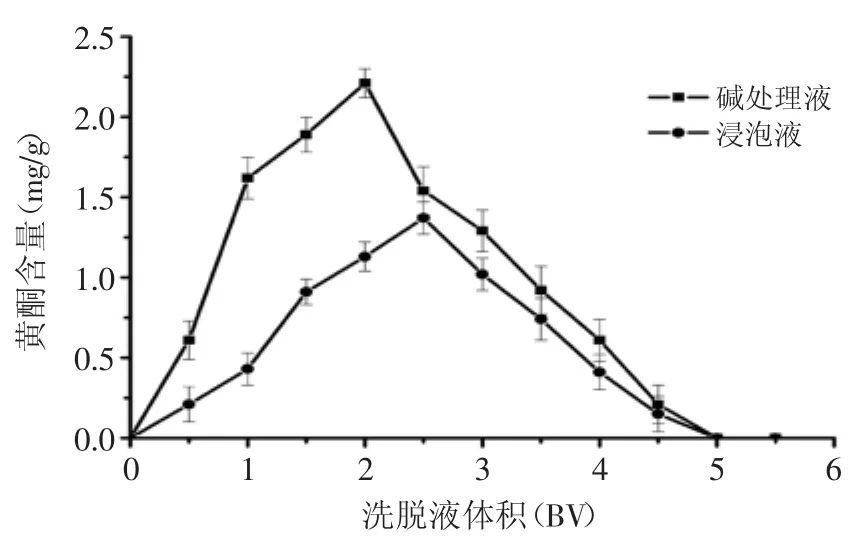
图3 洗脱曲线Fig.3 The desorption curve of flavonoid
2.3核桃去衣液中核桃黄酮回收率和纯度测定

表4 核桃黄酮的回收率及纯度Table 4 Recovery and purity ofwalnut flavonoid
陈全斌等采用磨浆法研究了从生产葛根淀粉废水中回收黄酮的最佳工艺,且在该条件下,黄酮纯度为18.94%[24]。而本实验从两种废液中得到黄酮纯度为61.35%~74.16%(如表4所示),结果明显高于前者。
2.4抗氧化活性测定结果
将回收得到的干燥物配制成不同浓度的溶液用于体外抗氧化活性测定,并与天然抗氧化剂VC比较,确定其抗氧化活性的强弱。
2.4.1DPPH自由基清除能力对DPPH自由基的清除能力是评价物质是否具有抗氧化活性的指标之一。核桃黄酮清除DPPH自由基的结果见图4。由图4可知,浸泡液与碱处理液核桃黄酮和VC对DPPH自由基的清除能力随浓度的增大而增大,分析得到VC与两种样品对DPPH自由基IC50值分别为:2.209、1.460(浸泡液)、1.911μg/m L(碱处理液),而李凤霞等研究薇菜黄酮类化合物对DPPH自由基的IC50为4.95μg/m L[25]。而在本实验碱处理液和浸泡液黄酮化合物对DPPH自由基的IC50明显低于前者。DPPH法体外抗氧化能力依次为:浸泡液核桃黄酮>碱处理液核桃黄酮>VC,但最高清除率VC则略高于两种处理液。
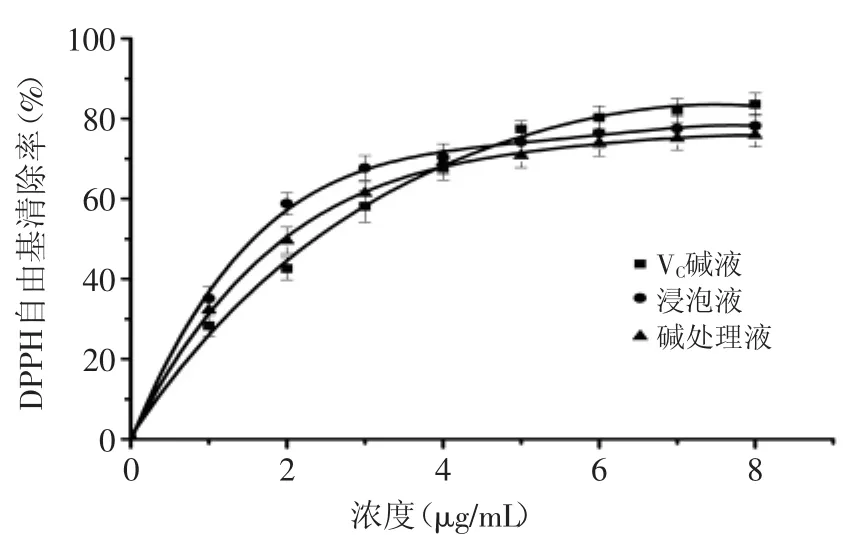
图4 核桃黄酮和VC对DPPH自由基清除率Fig.4 Scavenging rate ofwalnut flavonoid and Vitamin c on DPPH radical
2.4.2超氧阴离子自由基清除能力在邻苯三酚体系中,邻苯三酚的自身氧化速度较快,加入纯化液后,由于黄酮类化合物含有活泼的3’和4’位酚羟基,能提供活泼的氢,从而阻断自由基反应。因此,抗氧化时通过供氢来完成清除超氧阴离子的目的[26]。由图5可知,随着碱处理液与浸泡液核桃黄酮和VC浓度的增加,其对超氧阴离子自由基清除率也均呈上升趋势。但VC清除超氧阴离子的能力明显优于核桃黄酮,当浓度为0.8μg/m L时,VC对超氧阴离子的清除率达到90%左右。通过SPSS数据分析,得到VC与两种样品对DPPH自由基IC50值分别为3.376、4.391(浸泡液)、6.294mg/m L(碱处理液)。在此浓度下,邻苯三酚法体外抗氧化能力依次为:VC>浸泡液核桃黄酮>碱处理液核桃黄酮。
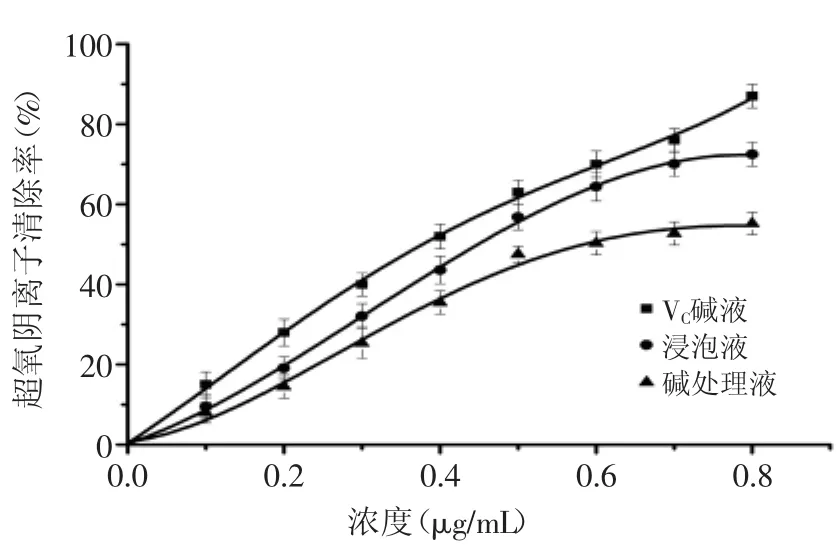
图5 核桃黄酮和VC对超氧阴离子自由基清除率Fig.5 Scavenging rate ofwalnut flavonoid and Vitamin c on superoxide anion radical
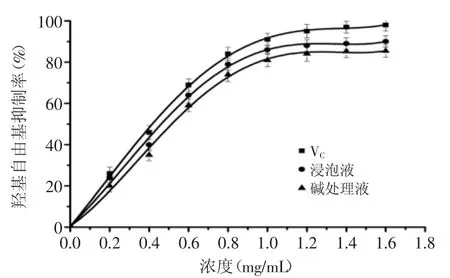
图6 核桃黄酮和VC对羟基自由基清除率Fig.6 Scavenging rate ofwalnut flavonoid and Vitamin c on Hydroxyl radical
2.4.3羟基自由基清除能力羟基自由基是比较难清除的自由基,许多抗氧化剂对其的清除能力都较差。已有研究指出山核桃仁对羟基自由基清除率较强[27]。由图6可知,碱处理液与浸泡液核桃黄酮和VC浓度的增大均对羟基自由基的清除率起促进作用,当浓度为1.6mg/m L时,碱处理液与浸泡液核桃黄酮对羟基自由基的清除率分别为85.41%、90.07%,略低于VC(98.12%)。经过SPSS数据分析,得到VC与两种样品对DPPH自由基IC50值分别为0.372、0.415(浸泡液)、0.472mg/m L(碱处理液)。表明核桃碱处理液与浸泡液核桃黄酮与VC之间的差距较小,具有作为清除羟基自由基抗氧化剂的潜力。
由以上抗氧化分析可以看出,在一定的浓度范围内,核桃浸泡液的抗氧化能力优于核桃碱处理液,其原因可能是碱液的浓度偏高,加热时破坏了黄酮类化合物的母核[28]。多数研究表明,碱性条件下,芦丁与儿茶素易被氧化分解,同时槲皮素的3′、3′、4三个位置上的羟基对碱敏感,易发生自氧化作用,从而影响其清除自由基能力[29-31]。此外,碱液浸出的杂质较多不利于纯化[32],从而导致碱处理液中核桃黄酮纯度降低,而且在相同体积条件下,碱处理液与浸泡液相比,其抗氧化能力降低。
3 结论
核桃仁去衣废液中黄酮类化合物含量丰富,本实验采用大孔树脂对其进行回收。结果表明,最佳工艺条件为:吸附时间为3~4h,上样pH为6~7,上样流速为1m L/min,洗脱液体积为5BV 80%的乙醇,最后得到黄酮的纯度为61.35%~74.16%。此外,核桃仁去衣液中的黄酮具有较强的体外抗氧化活性,有较好的开发利用前景。利用核桃仁去衣液中的黄酮类物质,采用大孔树脂法对废液中有价值的物质回收利用,不但能得到较高价值的副产品,还可以减轻对环境的污染。
[1]史丹丹,陈朝银,赵声兰,等.核桃相关多酚及其与血清白蛋白的互作研究[J].食品工业科技,2014,35(2):375-379.
[2]徐宝梁,李兵,罗中,等.核桃乳饮料生产工艺研究[J].食品工业科技,1996(2):43-45.
[3]于明,何伟忠,吴新凤.鲜核桃乳生产工艺研究[J].新疆农业科学,2010,47(10):1117-1120.
[4]荣瑞芬,吴雪疆,李鸿玉,等.核桃仁去皮工艺的研究[J].食品工业科技,2004,25(2):100-101.
[5]吴世兰,秦礼康,蒋成刚,等.核桃仁碱液去皮过程中营养功能成分动态变化[J].中国油脂,2013,38(2):84-87.
[6]Marsal A,Bautista E,Ribosa I,etal.Adsorption of polyphenols in wastewater by organo-bentonites[J].Applied Clay Science,2009,44(1):151-155.
[7]Sayadi S,Allouche N,Jaoua M,etal.Detrimental effects of high molecular-mass polyphenols on olive mill wastewater biotreatment[J].Process Biochemistry,2000,35(7):725-735.
[8]王克建,杜明,胡小松,等.核桃仁中多酚类物质的液相/电喷雾质谱分析[J].分析化学,2009(6):867-872.
[9]Solar A,ColaricˇM,Usenik V,et al.Seasonal variations of selected flavonoids,phenolic acids andquinones in annual shoots of common walnut(Juglans regia L.)[J].Plant Science,2006,170(3):453-461.
[10]刘传水,太志刚,冯四全,等.核桃种皮的化学成分研究[J].中国中药杂志,2012(10):18.
[11]Zhang Z,Liao L,Moore J,et al.Antioxidant phenolic compounds from walnut kernels(Juglans regia L.)[J].Food Chemistry,2009,113(1):160-165.
[12]Anderson K J,Teuber S S,Gobeille A,et al.Walnut polyphenolics inhibit in vitro human plasma and LDL oxidation[J].The Journal of nutrition,2001,131(11):2837-2842.
[13]Crozier A,Del Rio D,Clifford M N.Bioavailability of dietary flavonoids and phenolic compounds[J].Molecular aspects of medicine,2010,31(6):446-467.
[14]Sheng Z L,Wan P F,Dong C L,et al.Optimization of total flavonoids content extracted from Flos populi using response surfacemethodology[J].Industrial Crops and Products,2013,43:778-786.
[15]Amadou I,Le G W,Shi Y H,et al.Reducing,radical scavenging,and chelation properties of fermented soy protein meal hydrolysate by lactobacillus plantarum lp6[J].International Journal of Food Properties,2011,14(3):654-665.
[16]张晓璐,徐凯宏.山楂叶总黄酮清除DPPH和超氧阴离子自由基的活性研究[J].林业科技,2008,33(5):51-54.
[17]李霄,曹艳萍,马向荣,等.陕北红枣多酚抗氧化性研究与比较[J].应用化工,2012,41(8):1368-1371.
[18]徐清萍,何培新,朱广存.大孔树脂分享怀菊花黄酮的研究[J].食品工业科技,2011(4):103-106.
[19]Bi Y G,Tan Y Q.Study on macroporous resin separation and purification of total flavonoids of plantago process[J]. Advanced Materials Research,2012,550:987-992.
[20]Wan P,Sheng Z,Han Q,et al.Enrichment and purification of total flavonoids from Flos Populi extracts with macroporous resins and evaluation of antioxidant activities in vitro[J].Journal of Chromatography B,2014,945:68-74.
[21]周燕芳,李佩华.AB-8大孔树脂纯化风轮菜黄酮的研究[J].食品与机械,2009(5):82-84.
[22]Zhang Y,Jiao J,Liu C,et al.Isolation and purification of four flavone C-glycosides from antioxidant of bamboo leaves by macroporous resin column chromatography and preparative highperformance liquid chromatography[J].Food chemistry,2008,107(3):1326-1336.
[23]肖新生,张敏,袁先友,等.油茶叶中黄酮类物质的提取及纯化工艺研究[J].中国食品添加剂,2012(4):93-97.
[24]陈全斌,陈定奔,余丽娟,等.磨浆法从葛根中提取黄酮的研究——生产葛根淀粉废水的综合利用[J].食品科学,2004,25(1):91-93.
[25]李凤霞,王丹,胡元庆,等.薇菜黄酮类化合物体外抗氧化活性分[J].扬州大学学报:农业与生命科学版,2011:90-94.
[26]郎娜,罗红霞.黄花菜中黄酮类物质抗氧化性的研究[J].食品研究与开发,2007,28(3):74-77.
[27]房祥军,郜海燕,陈杭君.山核桃加工,贮藏前后总多酚含量及其抗氧化活性的变化[J].食品科学,2011,32(5):104-107.
[28]陈颢,李丽娟,李良,等.中药材中黄酮类化合物的提取及药理作用研究进展[J].云南化工,2011,38(4):50-52.
[29]王丽.芦丁的来源,用途,提取及精制方法[J].学周刊:B,2010(10):194-195.
[30]俞梅兰,余燕影,曹树稳.槲皮素自氧化作用影响其超氧阴离子自由基清除能力的研究[J].食品工业科技,2006,27(3):75-78.
[31]刘坤,孙来娣,高华,等.儿茶素提取新工艺[J].食品研究与开发,2011,32(9):36-39.
[32]蔡健,华景清,王薇,等.黄酮提取工艺研究进展[J].淮阴工学院学报,2004,12(5):82-85.
Recovery ofwalnut flavonoid in peeling wastewater ofwalnut kernel and its antioxidative activity
SONG Hao1,ZHAO Sheng-lan2,CHEN Chao-yin1,*,LIRu-rong3,ZHANG Tian-cai1,WUW an-xing1,SHIDan-dan1
(1.Kunming University of Science and Technology,Kunming 650500,China;2.Yunnan University of Traditional Chinese Medicine,Kunming 650200,China;3.Dali YangbiWalnut Co.,Ltd.,Dali672500,China)
The paper w ith soaking and lye from p roduction p rocess of walnutm ilk as raw material,stud ied the systematically the craft of purification ofwalnut flavonoid by AB-8 macroporous resin.The result ind icated that AB-8 macroporous resin possessesed the strong ability of purification for the peeling wastewater of walnut kernel.Under the op tim ized cond itions,the purity and recovery of walnut flavonoid ranged from 61.35%,81.73%to 74.16%,86.51%,respectively.The results also showed that the walnut flavonoid had strong scavenging capabilities.Walnut flavonoid from soaking and lye on DPPH·,superoxide anion free rad icals and hyd roxyl w ith IC50values ranged from 1.460μg/m L,4.391mg/m L,0.415mg/m L to 1.911μg/m L,6.294mg/m L,0.472mg/m L,respectively.It was conc luded that soaking and lye of walnut kernelwas a good source for p roducing walnut flavonoid and an ideally naturalantioxidant.
soaking;lye;flavonoid;antioxidative activity
TS255.6
A
1002-0306(2015)06-0094-05
10.13386/j.issn1002-0306.2015.06.013
2014-06-04
宋浩(1990-),男,硕士研究生,研究方向:生物资源开发。
陈朝银(1957-),男,博士,教授,研究方向:药食资源开发。
云南省科技计划项目(2009EB081,2011AB006);科技部支撑计划项目(20112011BAD46B00)。
