慢性脑供血不足患者S100β蛋白 同型半胱氨酸水平与脑血流量的相关性分析
2015-10-19刘丹周冬翠梁桂萍邢建丽何跃张法军
刘丹 周冬翠★ 梁桂萍 邢建丽 何跃 张法军
慢性脑供血不足患者S100β蛋白 同型半胱氨酸水平与脑血流量的相关性分析
刘丹 周冬翠★ 梁桂萍 邢建丽 何跃 张法军
目的 探讨S100β蛋白、同型半胱氨酸(Hcy)水平与慢性脑供血不足(CCCI)患者脑血流量的相关性。方法 选择48例CCCI患者为CCCI组,46例健康体检者为对照组,对两组患者行颈动脉超声联合经颅多普勒(TCD)检查,并进行血液指标S100β蛋白及Hcy检测。 结果 CCCI组脑血流量明显低于正常对照组(P<0.05)。CCCI组S100β蛋白、Hcy含量均高于正常对照组(P<0.05)。CCCI组脑血流量与S100β蛋白、Hcy含量呈负相关(P<0.05);S100β蛋白、Hcy未见明显线性相关(P>0.05)。结论 CCCI组患者脑血流量明显减少;高水平的S100β蛋白、Hcy可能参与CCCI的发生和发展;S100β蛋白、Hcy可能是影响CCCI患者脑血流量的独立的因素。
慢性脑供血不足 颈动脉超声 脑血流量 S100β蛋白 同型半胱氨酸
慢性脑供血不足(CCCl)是1990年由“日本厚生省循环系统疾病研究班”提出[1],指各种原因引起的脑血管病变使脑组织整体水平慢性、持续性低灌注而引发的脑功能障碍,而非局灶性的脑缺血。患者常以头晕、头痛、头部胀闷不适为主诉,可伴有视力模糊、四肢无力、麻木等,起病隐匿,临床表现形式多样,但客观体征较少,头颅CT/MRI检查无器质性改变[2]。作者采用颈动脉超声联合TCD测量脑血流量,并进行血液指标S100β蛋白及Hcy检测,以期为CCCI的早发现、早诊断提供依据。
1 临床资料
1.1一般资料 选取2009年1月至2011年1月本院CCCI患者48例为CCCI组,其中男22例,女26例;年龄60~84岁,平均(72.5±6.1)岁。采用2000年日本卒中会议确定的CCCI诊断标准:(1)有头晕、头痛、头沉等自觉症状。(2)支持脑动脉硬化的体征:伴有高血压、眼底动脉硬化改变等,或有时可闻及脑灌注动脉的血管杂音。(3)无大脑的局灶神经体征。(4)头颅CT/MRI检查无血管性器质性脑改变。(5)排除其他疾病导致的上述自觉症状。(6)年龄>60岁。(7)脑循环检查确认脑血流减低。(8)脑血管造影或经颅多普勒超声(TCD)等提示脑灌流动脉有闭塞或狭窄改变。排除标准:(1)其他疾病引起头晕、头痛、头沉等自觉症状,如感染性疾病、前庭迷路疾病、眼科疾病、颈椎病、内科系统疾病、外伤性疾病等。(2)其他中枢神经系统疾病或损伤者。(3)严重心、肝、肺、肾、造血系统、内分泌系统疾病者。选择同期在本院进行健康体检者46例为对照组,其中男24例,女12例;年龄60~78岁,平均(70.4±7.8)岁。神经系统检查无明显异常;头颅CT/MRI检查无器质性脑改变。所有患者均签署知情同意书。两组性别、年龄、伴随疾病等方面差异均无统计学意义(P>0.05),具有可比性。
1.2方法 颈动脉超声检查:采用Philips IE33 颈动脉超声仪,7.5MHz 线阵式探头,检查前嘱患者休息5~10min,取平卧位,头偏向检查对侧,充分暴露颈部,沿胸锁乳突肌外缘纵向检查,探及颈内动脉,纵切检查后将探头旋转90°,沿血管走形横向检查,测量相应血管横截面积。测量指标包括:(1)颈内动脉(ICA):距分叉膨大后1cm处检查,双侧分别记录,并在体表标记。(2)椎动脉(VA):双侧分别记录,并在体表进行标记。TCD检查:采用德国西门子公司ALT-HDI 3500超声仪,2.0MHz经颞窗,枕窗,在体表标记处进行测量,分别测量双侧ICA和VA的平均血流速度(Vm)。根据PeterScheel[3]推荐的脑血流量的计算公式:脑血流量=S×Vm(S=血管横截面积、Vm=平均血流速度),计算脑血流量。
1.3标本采集 对测试者采集空腹静脉血5ml,置于促凝管内,<2~3h离心,3000r/min离心10min,取上清液置于-70℃的冰箱内保存待S100β蛋白、Hcy测定。为避免影响测定结果,要求测试者血液检测前2d勿进食大量高蛋白、高脂肪、高嘌呤食物及饮酒,采集标本血样过程中无溶血。
1.4测定方法 S100β蛋白采用双抗体夹心酶联免疫吸附法(ELIAS)测定,测定试剂采用北京泰福仕科技开发公司试剂盒。血清Hcy采用循环酶法,使用罗氏P800全自动生化仪,试剂由罗氏诊断有限公司提供。严格按照仪器及试剂说明书进行操作,质控品随样本一同测定。
1.5统计学方法 采用SPSS 13.0软件。计量资料以表示,采用t检验,相关性分析采用Pearson相关系数检验。P<0.05为差异有统计学意义。
2 结果
2.1两组脑血流量比较 见表1。
2.2两组S100β蛋白、Hcy含量的比较 见表2。
表1 两组颈动脉超声及TCD检测结果
注:与对照组比较,*P<0.05
血流速度(cm/s)全脑血流量(ml/min)左侧ICA右侧ICA左侧VA右侧VA左侧ICA右侧ICA左侧VA右侧VA CCCI组4812.11±1.6011.34±1.235.91±0.565.68±0.4832.21±6.4332.02±6.2217.54±3.22*17.04±3.10*587.45±32.44*对照组4613.15±1.1512.19±1.146. 02±0.575.97±0.5137.51±10.333.52±6.3131.32±9.5627.21±4.33729.66±33.56横截面积(mm2)n
表2 两组血S100β蛋白、Hcy含量的比较
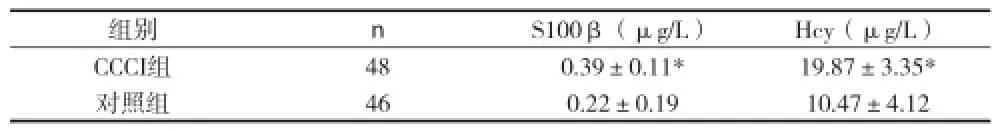
表2 两组血S100β蛋白、Hcy含量的比较
注:与对照组比较,*P<0.05
组别nS100β(μg/L)Hcy(μg/L)CCCI组480.39±0.11*19.87±3.35*对照组460.22±0.1910.47±4.12
2.3CCCI组S100β蛋白、Hcy含量及脑血流量关系S100β蛋白、Hcy含量与脑血流量呈负相关(r=-0.421,r=-0.520),差异有统计学意义(P<0.05);S100β蛋白、Hcy无明显线性相关(r=0.121),差异无统计学意义(P>0.05)。见表3。

表3 CCCI组S100β蛋白、Hcy含量及脑血流量关系
3 讨论
CCCI为临床常见病,系因各种原因引起的脑血管狭窄和(或)低灌注,引起脑血流量低于脑生理需要所致的全脑性代谢障碍,引发波动性、轻度脑功能障碍而无明确定位体征的慢性缺血性脑血管病,是短暂性脑缺血发作、缺血性脑卒中、痴呆的高危因素或病理基础[4]。由于CCCI 起病隐匿,早期症状不典型,临床表现和头颅CT/MRI影像学诊断均无血管性或其他脑器质性病变的明确提示,因此给临床早期诊断造成一定的困难。本资料结果表明,CCCI患者无明显的神经系统体征,但根据颈动脉超声及TCD检查结果计算所得脑血流量显示CCCI组明显低于对照组,差异有统计学意义(P<0.05)。因此对有头晕、头痛、头部胀闷等不适主诉而又无明显的神经系统体征和头颅CT/MRI检查无器质性病变的患者,进行颈动脉超声联合TCD检查,对脑血流量进行初步评估,通过相关检查结合临床作出早期诊断。
CCCI患者脑血流量降低致全脑代谢障碍、严重损伤脑细胞的同时也破坏血脑屏障,使原本仅存在于中枢神经组织内的一些蛋白或酶类,从坏死或凋亡的脑细胞中释放出来,通过被破坏的血脑屏障进入血液,所以监测患者血清中相关蛋白或酶类的浓度变化,能够较可靠地反映脑损伤的严重程度,亦有可能对脑认知损伤的治疗及预后有一定的预测意义[5]。S100蛋白是一种钙离子结合蛋白,由α、β两种亚基组成,而S100β蛋白主要存在于脑中,由星形胶质细胞合成,约占96%,较其他亚型更具有活性,被认为是脑内特异蛋白[6]。S100β蛋白主要分布于中枢神经系统胶质细胞中,且S100β蛋白的半衰期约为25min,由于半衰期短,因此其持续升高提示可能继发有脑细胞损伤,监测S100β蛋白可作为神经系统细胞损伤的直接预测因子,同时也是一种可提供脑损伤程度的定量指标,尤其是在临床和影像学检查还未发现明显异常的阶段。本资料结果显示,CCCI组S100β蛋白含量明显高于对照组,提示S100β蛋白可能参与CCCI的发生与发展,且随着S100β蛋白含量的增高,脑血流量有所下降,提示S100β蛋白水平越高患者脑循环障碍越严重。研究[7]认为,此蛋白的含量变化不仅反映脑胶质细胞损伤的严重程度,还可以调控神经元与胶质细胞的相互作用,S100β蛋白在脑出现缺血、缺氧时因神经胶质细胞受到刺激后被大量激活、释放入脑脊液中,再因血脑屏障受损而进入血液,由此可看出人体内S100β蛋白水平与脑组织灌注量具有密切关系。本资料结果显示CCCI组Hcy含量显著高于对照组,且随Hcy含量升高,脑血流量呈下降趋势,提示Hcy水平越高患者脑循环障碍越严重。Hcy是血和组织中的含硫氨基酸,在人体内不能自行合成,只能从食物中的蛋氨酸在肝脏、肌肉和其他组织中脱甲基转变而来。Hcy参与CCCI发生发展的机制目前尚不明确,需要相关研究的进一步探讨。
本资料结果显示CCCI患者S100β蛋白、Hcy含量无明显线性相关,提示S100β蛋白、Hcy含量可能是影响CCCI发生发展的2个相互独立的因素。行S100β蛋白和Hcy的联合检测,并行颈动脉超声及TCD检查,对脑血流量进行评估,可对CCCI患者有效地诊断、干预,在一定程度上延缓CCCI患者的病情发展。
1 平井俊策.平成元年度厚生省循环器病研究委托班研究报告集.国立循环器病,1990.80.
2 张秀华,李光来.慢性脑供血不足的研究进展.中西医结合心脑血管病杂志,2007,5(3):249~251.
3 Peter Scheel MD, Christian Ruge, Uwe R, et al. Color duplex measurement of cerebral blood volume in healthy adults.Stroke, 2000,31(1):147~150.
4 Tripathi M, Sharma R, et al. Functional neuroimaging using F-18 FDG,PET/CT in amnestic mild cognitive impairment: a preliminary study. Indian J Nucl Med, 2013,28(3):129~133.
5 Kapural M, Krizanac-Bengez L, Barnett G, et al. Serum S-100 beta as a possible marker of blood-brain barrier disruption. Brain Res, 2002,940(1~2):102~104.
6 Persson L, Hardemark H G,Gustafsson J, et al. S-100 protein and NSE in CSF and serum: markers of cell damage in human central nervous system .Stroke, 1987, 18(5):911~918.
7 Abraha H D, Butterworth R J, Bath P M W, et al. Serum S-100 protein,relationship to clinical outcome in acute stroke .Ann Clin Biochem,1997,34(4):366~370.
Objective To study the relationship of cerebral blood flow and S100β protein,Homocysteine(Hcy)in patients of chronic cerebral circulation insuffi ciency. Methods 48 patients diagnosed as CCCl were assigned as CCCl group,while 46 healthy subjects served as control group.Each case was assessed in their cerebral blood fl ow with carotid ultrasound and Transcranial Doppler(TCD)and then test the level of S100β protein,Hcy. Results CCCl group had less cerebral blood fl ow than control group(P<0.05).CCCl group had a higher concentration of S100β protein and Hcy than control group(P<0.05).The cerebral blood fl ow of CCCl group had a negative relationship with S100β protein and Hcy. No relationship was found between S100β protein and Hcy. Conclusions Patients with CCCI have signifi cantly less cerebral blood fl ow.S100β protein and Hcy are very important risk factors of CCCl occurrence. S100β protein and Hcy can be regard as the separate risk factors of CCCl occurrence.
Chronic cerebral circulation insufficiency Carotid ultrasound Transcranial Doppler Cerebral blood flow S100β protein Homocysteine
100700北京军区总医院干部科(刘丹 周冬翠 邢建丽 何跃 张法军)100012北京军区司令部北苑干休所(梁桂萍)
