蛋制品中沙门氏菌的PCR及实时荧光PCR检测方法
2015-10-15陈筱婷
陈筱婷
(1,华南理工大学轻工与食品学院,广东 广州 510640;2,福建省产品质量检验研究院国家加工食品质量监督检验中心(福州), 福建 福州 350000)
蛋制品中沙门氏菌的PCR及实时荧光PCR检测方法
陈筱婷1,2
(1,华南理工大学轻工与食品学院,广东 广州 510640;2,福建省产品质量检验研究院国家加工食品质量监督检验中心(福州), 福建 福州 350000)
研究针对蛋制品中沙门氏菌的检测开发了一种快速灵敏的PCR检测方法。研究方法采用煮沸法提取样品DNA,运用PCR方法筛查样品中的沙门氏菌基因成分。根据沙门氏菌基因组中的保守序列设计特异性引物与探针,PCR扩增结果表明,阳性样品扩增获得的序列与Genebank中沙门氏菌的基因序列完全匹配。采用实时PCR检测方法可检出浓度低至1.57×10-5μg . μL-1的沙门氏菌DNA,检测时间少于24 h,对比常规的微生物培养方法,该方法显著地提高了检测速度。研究方法具有特异性强、灵敏度高等优点,可以广泛应用于蛋制品及相关食品中沙门氏菌的高通量筛查检测。
蛋制品;沙门氏菌;食品;PCR;实时PCR
沙门氏菌(Salmonella)是一群寄生于人和动物肠道内的无芽孢革兰氏阴性直杆菌,其菌型繁多,分布广泛,是一种重要的引起食源感染性腹泻的致病微生物[1~6]。食品中沙门氏菌快速有效的检测体系对于食品安全至关重要。蛋制品是一类重要的食品,在我国具有广泛的消费市场,蛋制品在加工过程中容易遭受沙门氏菌的污染,从而带来了一定的食品安全风险。从食品安全角度考虑,建立一种快速、灵敏、高效的蛋制品中沙门氏菌的检测方法具有重大意义。
在我国,目前对沙门氏菌的检测主要还依赖于传统的微生物学检测方法,该方法步骤繁琐、费时费力,检测过程一般需要3d的时间。为了适应食品安全快速检测趋势与要求,急需开发一种快速筛查食品中沙门氏菌的检测方法。
PCR是聚合酶链式反应的简称,是分子生物学中广泛运用的一种技术,主要原理是通过热循环,达到目的基因片段的大量扩增。目前这项技术越来越广泛地运用于食品中致病菌的筛查检测。目前在国际上已有较多PCR技术应用于沙门氏菌检测的研究报导[7~20],相关研究表明,采用PCR方法进行样品中沙门氏菌的检测分析,具有高特异性、高灵敏度等特点。
为了节约检测时间,提高检测效率,该研究开发了蛋制品中沙门氏菌的PCR以及实时荧光PCR检测方法。通过试验比较,方法选用煮沸法提取样品DNA,采用PCR技术检测沙门氏菌。方法主要步骤包括使用培养基溶液预增菌,采用煮沸法提取DNA,运用PCR技术特异性地检测沙门氏菌。
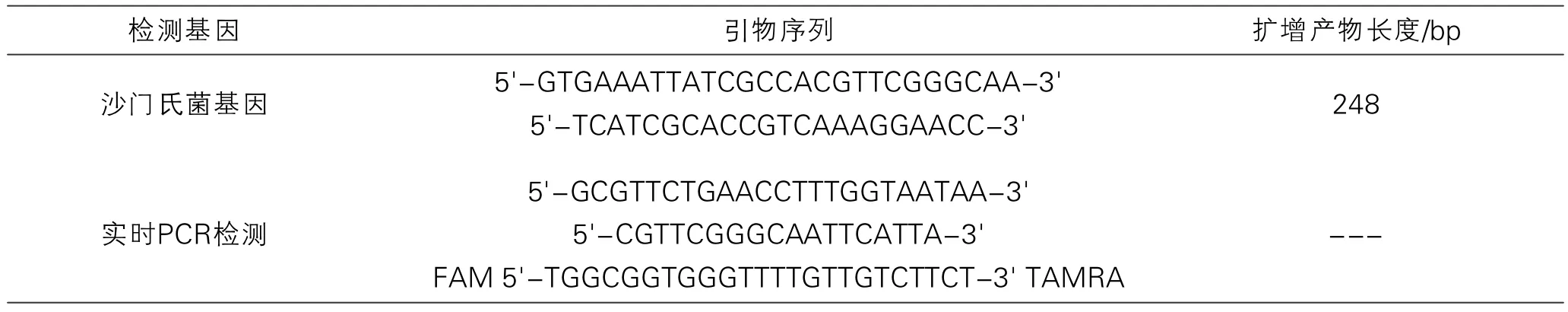
表1 引物信息以及扩增产物长度
实验结果表明,应用该研究方法可快速、准确、灵敏地检测出蛋制品中的沙门氏菌。
1 材料与方法
1.1 材料
1.1.1 菌株沙门氏菌(Salmonella)与阴性对照菌株大肠杆菌(Escherichia coli)等由福建省产品质量检验研究院食品所微生物实验室保藏。
1.1.2 蛋制品,部分购于市场,部分经微生物方法检测结果为阳性,于4 ℃冰箱中保存。
1.1.3 试剂:LB培养基,每升含有胰蛋白胨10g、酵母提取物5g、氯化钠10g,pH 7.0);TaKaRa rTaq(5 U.μL-1)、MgCl2(25 mmol . L-1)、dNTPs(10 mmol . L-1)、DL2000 DNA Marker、加样缓冲液(TaKaRa,大连宝生物工程有限公司)、溴化乙淀、琼脂糖、Qiagen Generation Capture Column Kit。
1.1.4 主要仪器:MJPCR基因扩增仪(PTC-200 DNA扩增仪),Bio-Rad电泳仪,Bio-Rad UV凝胶成像系统,Bio-Rad生物光学紫外分光光度计,Applied Biosystems 7300定量PCR检测系统。
1.2 方法
1.2.1 预增菌:纯菌培养所用试验菌株接种于10 mL液体LB培养基中,37℃震荡培养10 h (220 r.p.m . min-1)。蛋制品取1~3 g,加入液体LB培养基中,涡旋震荡60 s,37℃培养10 h(220 r.p.m. min-1)。
预增菌后,分别取两管3 mL菌液用于DNA提取。为了比较不同DNA提取方法应用于沙门氏菌的提取效果,我们收集的一管菌液采用煮沸法提取DNA,另一管菌液采用Qiagen试剂盒进行提取。
1.2.2 PCR模板的制备方法
煮沸法提取DNA:取细菌培养液3.0 mL,置于小离心管中,8 000 r.p.m. min-1离心5 min。弃上清,沉淀用300 μL TE缓冲液悬浮,于95~98 ℃隔水煮沸15 min,10 000 r.p.m. min-1离心10 min。取上清,即为DNA模板溶液。
试剂盒法提取DNA:按照Qiagen试剂盒操作说明书进行DNA提取。
1.2.3 引物的合成
根据沙门氏菌基因组保守序列设计特异性引物,引物信息见表1,引物合成于Invitrogen公司。
1.2.4 PCR反应体系
常规PCR扩增采用Taq DNA聚合酶,反应体系为25 μL体系,其中10×PCR buffer 2.5 μL、MgCl2 2.5 μL、dNTPs 1.0 μL、上、下游引物各0.5 μL、Taq酶0.3 μL,模板溶液2.0 μL、灭菌双蒸水补足体积至25 μL。
常规PCR仪器反应条件为94℃预变性5 min后,按94℃30 s、55℃1 min、72℃1 min,共进行35个循环,最后72℃ 延伸10 min,PCR产物于4℃保存。
实时PCR反应体系:在25 μL反应体系中,10×PCR buffer 2.5 μL、MgCl2 2.5 μL、dNTPs 1.0 μL、上、下游引物各0.5 μL、Taq酶0.3 μL,探针0.3 μL,模板溶液2.0 μL,灭菌双蒸水补足体积至25 μL。
实时PCR反应条件:94℃预变性3 min;94℃变性45 s,53℃退火60 s。72 ℃延伸60 s。经5个循环;94℃变性45 s,58 ℃退火60 s,72℃延伸60 s,经35个循环;循环结束后,72℃,10min。
1.2.5 灵敏度试验
LB增菌培养液DNA提取用菌落平板记数法定量的菌液,加入5 mL液体LB培养基。于37℃、220 r.p.m. min-1的摇床中增菌培养10 h。吸取增菌液1 mL,用煮沸法制备PCR模板。
实时PCR检测沙门氏菌的敏感性试验用煮沸法提取沙门氏菌的基因组DNA作为模板溶液,测定基因组DNA浓度,将其梯度稀释后进行实时PCR反应,绘制各自的扩增曲线。
2 结果与分析
2.1 蛋制品样品中沙门氏菌的检测结果
用合成的引物及PCR方法对20份蛋制品中的沙门氏菌进行PCR检测分析。电泳结果如图1所示,20份蛋制品中有12份蛋制品检测出248 bp的沙门氏菌特异性基因片段,与预期基因片段长度相符。对于PCR检测结果为阳性的样品,采用国家标准方法验证试验结果,具体比对试验结果见2.2。作为阴性对照的大肠杆菌样品DNA未扩增出目标基因片段。试验结果说明,引物的灵敏度及特异性较好,适合进行蛋制品中沙门氏菌的检测。
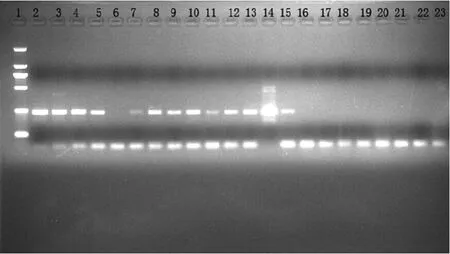
图1 蛋制品中沙门氏菌的检测结果
2.2 PCR检测方法与国家标准方法比对结果
对20份蛋制品中的沙门氏菌进行PCR检测分析。电泳结果如图1所示,20份蛋制品中有12份蛋制品检测出248 bp的沙门氏菌特异性基因片段,与预期基因片段长度相符。对于PCR检测结果为阳性的样品,采用国家标准方法验证试验结果。作为阴性对照的大肠杆菌样品DNA未扩增出目标基因片段。试验结果说明,引物的灵敏度及特异性较好,适合进行蛋制品中沙门氏菌的检测。

表2
2.3 方法灵敏度试验
将纯菌培养的沙门氏菌菌液按照煮沸法提取DNA,使用核酸蛋白测定仪测定核酸浓度,梯度倍比稀释,使用实时荧光PCR仪进行检测,确定沙门氏菌的检测灵敏度,检测结果如图2所示,结果显示当基因组DNA含量为1.57×10-5μg/μL时,仍可被检测出,说明实时PCR技术检测沙门氏菌的灵敏度极高,且扩增曲线与模板DNA含量呈明显相关性。

图2 倍比稀释的沙门氏菌菌液DNA的扩增曲线
3 讨论
蛋制品是人民普遍喜爱的食品,它具有丰富的营养。蛋制品如果加工处理措施不当,容易带入细菌,这对蛋制品的质量安全检测提出了更高的要求。蛋制品及相关食品中微生物的检测一直是食品安全检测重点,其中沙门氏菌由于具有较强的危害性,引起人们较多的关注。研究旨在建立一种能快速筛查检测蛋制品中沙门氏菌的方法。
为了建立一种快速、灵敏、高效的蛋制品等食品中沙门氏菌的PCR检测方法,模板DNA的制备是关键的一步。为此,我们对蛋制品中沙门氏菌模板DNA的制备方法进行了比较研究。分别采用煮沸法与试剂盒法制备沙门氏菌的DNA模板,上述两种方法提取的沙门氏菌DNA经PCR扩增后均能扩增出248 bp大小的特异性基因片段,说明煮沸法与试剂盒法均适用于蛋制品中沙门氏菌的检测分析。试剂盒法由于使用成本较高,不适合于大量样品中沙门氏菌的筛查与检测分析。比较而言,煮沸法最为快捷、简便易行,节省试剂消耗,且在试验中可减少菌液和蛋制品中颗粒物质对PCR的干扰。核酸扩增检测以及DNA电泳结果均表明煮沸法提取得到的DNA浓度以及纯度可以满足检测需求。考虑到提取效率与提取时间,研究采用煮沸法提取蛋制品预增菌液中的DNA模板。
文章选择沙门氏菌组氨酸转运操作子基因上的一段特异性序列合成引物与探针,扩增片段大小为248 bp,检测结果显示,引物与探针具有良好的灵敏性与特异性。通过优化了的引物浓度、PCR反应体系、退火温度等条件,保证沙门氏菌PCR检测结果的稳定性和可重复性。
文章将PCR与实时PCR技术相结合,应用于蛋制品中沙门氏菌的检测中。实时PCR技术检测沙门氏菌的全过程在PCR管中得以完成,实现了检测的定量和实时,省略了常规PCR的电泳步骤,同时避免了因电泳带来的误差。试验中,定量PCR扩增曲线对于不同剂量的DNA模板,在1.57×10-1~1.57×10-5μg . μL-1范围内具有良好的线性关系,即使样品中模板浓度仅为1.57×10-5μg. μL-1依然可以被检出。结果表明,实时PCR法对致病菌的实时定量检测具有较好的应用前景。当然,由于实时PCR需要特殊荧光染料试剂和昂贵的定量PCR仪器,给一些基层单位的检测工作带来困难。
研究建立的PCR方法只需经过简单的增菌即可以用煮沸法提取DNA进行检测,简便快捷,能在24小时之内获得扩增结果,大大缩短了沙门氏菌的检测时间,特别适用于大量样品中沙门氏菌的快速筛查检测。文章将常规PCR与实时PCR技术相结合,应用于蛋制品中沙门氏菌的检测中,建立了一整套从样品预增菌到DNA提取到PCR检测的方法,方法可推广应用于蛋制品及相关食品中沙门氏菌的快速高通量检测中,具有较高的实用和推广价值。
[1]CDC (2009) Multistate outbreak of Salmonella infections associated with peanut butter and peanut butter-containing products United States, 2008-2009. MMWR Morb Mortal Wkly Rep 58, 85-90.
[2]Brenner, F.W., Villar, R.G., Angulo, F.J., Tauxe, R. and Swaminathan,B. (2000) Salmonella nomenclature. J Clin Microbiol38, 2465-2467.
[3]Mahajan, R.K., Khan, S.A., Chandel, D.S., Kumar, N., Hans,C. and Chaudhry, R. (2003) Fatal case of Salmonella enterica subsp. arizonae gastroenteritis in an infant with microcephaly. J Clin Microbiol 41, 5830-5832.
[4]Tatavarthy, A., Peak, K., Veguilla, W., Cutting, T., Harwood,V.J., Roberts, J., Amuso, P., Cattani, J. et al. (2009) An accelerated method for isolation of Salmonella enterica serotype Typhimurium from artificially contaminated foods, using a short preenrichment, immunomagnetic separation, and xylose-lysine-desoxycholate agar (6IX method). J Food Prot 72, 583-590.
[5]Nastasi, A., Mammina, C. and Salsa, L. (1999) Outbreak of Salmonella enteritis bongori 48:z35:- in Sicily. Euro Surveill 4, 97-98.
[6]Khoo, C.H., Cheah, Y.K., Lee, L.H., Sim, J.H., Salleh, N.A.,Sidik, S.M., Radu, S. and Sukardi, S. (2009) Virulotyping of Salmonella enterica subsp. enterica isolated from indigenous vegetables and poultry meat in Malaysia using multiplex-PCR. Antonie Van Leeuwenhoek 96, 441-457.
[7]Warren B R, Yuk H G, Schneider K R. Detection of Salmonella by flow through immunocapture real-time PCR in selected foods within 8 hours[J].J Food Prot.,2007,70(4):1 002-1 006.
[8]石晓路,扈庆华,张佳峰,等. 多重实时PCR快速同时检测沙门菌和志贺菌[J]. 中华流行病学杂志,2006,27(12):1 053-1 056.
[9]Samantha Hu Liming,Arvind A Bhagwat.Application of a molecular beacon real-time PCR technology to detect Salmonella species contaminating fruits and vegetables[J].International Journal of Food Microbiology,2004,(95):177-187.
[10]黄金林,焦新安,等. 应用聚合酶链式反应快速检测沙门氏菌[J]. 扬州大学学报,2002,23(3):5-7.
[11]Hatta M, Smits H L Detection of Salmonella typhi by nested polymerase chain reaction in Mood, urine and stool samples[J].Am J Trop Med Hyg,2007,76(1):139-143.
[12]Trkov M.Avgustin G.An improved 16S rRNA based PCR method for the specific detection of Salmonella enteric[J].International Journal of Food Microbiology,2003,80(1):67-75.
[13]Baumler, A.J., Heffron, F. and Reissbrodt, R. (1997) Rapid detection of Salmonella enterica with primers specific for iroB. J Clin Microbiol 35, 1224-1230.
[14]Cheng, C.M., Lin, W., Van, K.T., Phan, L., Tran, N.N. and Farmer, D. (2008) Rapid detection of Salmonella in foods using real-time PCR. J Food Prot 71, 2436-2441.
[15]Csordas, A.T., Barak, J.D. and Delwiche, M.J. (2004) Comparison of primers for the detection of Salmonella enterica serovars using real-time PCR. Lett Appl Microbiol 39,187-193.
[16]Gallegos-Robles, M.A., Morales-Loredo, A., Alvarez-Ojeda, G.,Osuna-Garcia, J.A., Martinez, I.O., Morales-Ramos,L.H.and Fratamico, P. (2009) PCR detection and microbiological isolation of Salmonella spp. from fresh beef and cantaloupes.J Food Sci 74, M37-M40.
[17]Kwang, J., Littledike, E.T. and Keen, J.E. (1996) Use of the polymerase chain reaction for Salmonella detection. Lett Appl Microbiol 22, 46-51.
[18]Moore, M.M. and Feist, M.D. (2007) Real-time PCR method for Salmonella spp. targeting the stn gene. J Appl Microbiol 102, 516-530.
[19]Rodriguez-Lazaro, D., Hernandez, M., Esteve, T., Hoorfar, J.and Pla, M. (2003) A rapid and direct real time PCR-based method for identification of Salmonella spp. J Microbiol Methods 54, 381-390.
[20]Ziemer, C.J. and Steadham, S.R. (2003) Evaluation of the specificity of Salmonella PCR primers using various intestinal bacterial species. Lett Appl Microbiol 37, 463-469.
10.3969/j.issn.1007-550X.2015-07-001
TS253.7
A
1007-550X(2015)07-0025-05
2015-06-15
陈筱婷,女,工程师,主要从事食品安全方面的研究。
