碱式碳酸镁催化酚醛聚合制备多孔炭及其CO2吸附性能
2015-10-15王恩民李文翠雷成陆安慧
王恩民,李文翠,雷成,陆安慧
碱式碳酸镁催化酚醛聚合制备多孔炭及其CO2吸附性能
王恩民,李文翠,雷成,陆安慧
(大连理工大学化工学院,精细化工国家重点实验室,辽宁大连 116024)
利用碱式碳酸镁的催化功能及易分解特性,实现间苯二酚、甲醛的快速凝胶,炭化得到孔隙发达的整体式多孔炭(MCM-Mg),其轴向抗压强度达9.4 MPa。与普通碳酸盐催化的样品相比,MCM-Mg孔隙更为发达。273 K下该系列样品的静态CO2吸附量可达3.49~4.50 mmol·g-1(0.1 MPa),0.015 MPa最高可达1.87 mmol·g-1。研究发现,微孔对材料吸附性能起主导作用;MCM-Mg的单位微孔比表面积可吸附7.15 μmol CO2,超过了大部分活化法制备的炭材料。多组分动态穿透实验表明,该系列材料可实现CO2/N2的完全分离;材料具有良好的耐水汽性能和循环吸附-脱附性能,室温下经惰性气体吹扫即可实现再生。
多孔炭;二氧化碳捕集;碱式碳酸镁;吸附;多孔介质;动态穿透
引 言
作为最主要的温室气体之一,大气中CO2含量的日益增长已成为人类广泛关注的重大环境问题[1]。同时,CO2也是重要的工业原料,在无机化工、有机化工等领域有着诸多应用[2]。因此,利用适宜的方法实现CO2捕集并将其合理利用十分必要[3]。吸附法是一种重要的CO2捕集方法。该方法耗能低、吸附量大,广泛应用于烟道气及天然气的分离提纯。常见的吸附剂有分子筛、多孔硅、金属有机骨架、多孔炭等[4-6]。其中,多孔炭具有孔结构发达、吸附量高、化学稳定性和热稳定性好等优点,已成为当前吸附领域的研究热点[7-8]。
目前,提高多孔炭CO2吸附分离性能的工作主要集中在表面化学和孔结构调控。在表面化学调控方面,研究者常通过在炭材料表面引入杂原子官能团,从而增强材料表面和CO2的相互作用[9]。如Mahurin等[10]提出在炭表面接枝胺肟官能团从而提高CO2/N2吸附选择性。此外,研究者一般通过活化法、模板法等策略提高材料的孔隙(特别是微孔)发达程度,进一步提高材料的吸附能力[11-12]。如Sevilla等[13]用聚吡咯(PPy)作前驱体,通过KOH活化制备了一系列高含氮多孔炭。气体吸附测试结果发现材料微孔尺寸适宜,吸附量高,并且再生容易。另外,大量研究通过活化法制备孔隙发达的多孔炭材料(比表面积>1000 m2·g-1),然而该方法过程较烦琐,成本较高,同时活化剂的使用还可能造成污染。除上述研究工作外,考虑到实际应用的客观条件,材料的宏观形态及机械强度的研究也很有必要。常规多孔炭呈现粉末状态,经过黏结剂成型后容易造成孔道堵塞,同时高流量气流冲击下的粉化往往导致这类多孔炭吸附分离性能降低。因此,高机械强度整体式炭材料的制备研究十分重要,被认为是解决上述问题的可能路径之一[14]。
酚醛树脂基炭材料是常见的多孔炭之一,在超级电容器、锂离子电池、储氢等方面有很好的应用前景[15]。Hao等[16]利用苯并嗪体系与酚醛体系设计序列反应,制得高强度大孔-介孔-微孔双连续整体式炭,该多孔炭的轴向抗压强度是文献报道的类似结构材料的80倍,高达15.6 MPa。传统酚醛树脂基炭材料制备过程中,一般用碳酸盐(Na2CO3、K2CO3)催化酚醛树脂缓慢脱水缩聚,经过干燥炭化等步骤得到富含中孔的多孔炭[17]。相比于非常稳定的Na2CO3、K2CO3等(分解温度>1500℃)[18],碱式碳酸镁(4MgCO3·Mg(OH)2·5H2O)具有弱碱性,且分解温度低,一般加热至300℃以上即可分解产生CO2和水[19],热解产物在逐渐逃逸过程中会形成内外贯通的孔道,使炭材料的孔隙更加发达[20]。基于此,本文提出碱式碳酸镁催化制备多孔炭的策略,把碱式碳酸镁的优点“嫁接”到酚醛聚合体系,经过快速凝胶化-常压干燥-炭化步骤制备整体式多孔炭材料,该产物具有发达的孔隙和整体式宏观形貌。并通过改变炭化温度寻求最优孔隙结构,考察材料孔结构和CO2吸附分离性能的关系;进一步通过静态平衡吸附和动态吸附分离两方面评价材料的CO2捕集分离性能。
1 实验材料和方法
1.1 材料
碱式碳酸镁(分析纯),天津市博迪化工有限公司提供。间苯二酚(分析纯),科密欧化学试剂有限公司提供。甲醛(分析纯,质量分数为37%),国药集团化学试剂有限公司提供。高纯氮气(纯度≥99.99%)、二氧化碳(纯度≥99.99%)、氩气(纯度≥99.5%),大连光明特种气体有限公司提供。所用水为实验室自制去离子水。
1.2 整体式多孔炭的制备
首先向10 ml去离子水中加入1 g碱式碳酸镁,室温充分搅拌后静置24 h,制得饱和碱式碳酸镁溶液。取4.2 g上清液,向其中依次加入3.0 g间苯二酚及4.42 g甲醛,待搅拌至完全溶解后密封,90℃反应并老化4 h。将所得湿凝胶经常压干燥后,置于管式炭化炉中,在氮气保护下,以3 °C·min-1的速率升温至目标温度(600~1000℃),停留2 h后,自然冷却至室温得到样品。根据目标温度的不同,样品分别命名为MCM-Mg-(MCM,mechanically- stable carbon material;600~1000)。
1.3 材料表征及机械强度测试
多孔炭样品的形貌结构用扫描电子显微镜(SEM)及透射电子显微镜(TEM)测定,用SEM配套的能量弥散X射线探测器进行能量弥散射线谱(EDS)表征并对所选微区进行元素组成分析。材料的比表面积和孔结构采用氮气物理吸附法测定。测试前将样品在200℃下抽真空处理4 h,然后在液氮温度(77 K)下测定得到氮气吸附-脱附等温线,样品的比表面积由BET(Brunauer-Emmett-Teller)方程计算得到,微孔比表面积由-plot法确定。微孔孔径分布通过物理吸附仪Micromeritics ASAP 2020测试,以CO2为探针分子,在液氮温度77 K下进行。采用等温线吸附分支数据根据DFT理论计算得到。材料的机械强度测试通过智能强度仪(DL Ⅲ型,大连化工研究院)进行,测试要求样品上下接触面平整,长径比1:1。
1.4 CO2静态吸附测试
首先将多孔炭在压力为5 Pa、200℃下处理2 h,自然冷却至室温,再用Micromeritics ASAP 2020物理吸附仪,在指定温度下进行CO2的吸附测试。吸附热通过将273 K与298 K下吸附数据代入Clausius-Clapeyron方程计算得到。
1.5 多组分动态穿透分离性能测试
多组分动态穿透分离性能测试在实验室自行搭建的气体动态分离测试装置上进行。测试装置数据:床层高度为10 cm、床层填充率约为85%,填充吸附剂物料质量为0.25~0.35 g。气体流量分别为:CO2/N2分离,N2(10 ml·min-1)、CO2(2 ml·min-1);CH4/CO2分离,CH4(10.8 ml·min-1)、CO2(1.2 ml·min-1)。气体流速:CO2/N2分离,N2(12.74 cm·min-1)、CO2(2.55 cm·min-1); CH4/CO2分离,CH4(13.76 cm·min-1)、CO2(1.53 cm·min-1)。
测试前,样品在95℃下Ar吹扫脱气2 h,冷却至25℃。吹扫完成后,将吹扫气迅速切换成分析气(CO2/N2或CO2/N2/H2O),计时并记录尾气组成及流速直至吸附达到平衡。2.5%含量水汽的实现:先通过计算得到混合气带入2.5%的水汽需要的水的蒸气压,再找到该饱和蒸气压对应的水的温度,将混合气通过鼓泡装置通入该温度下的水,即可实现2.5%水汽含量的混合气。
循环性能测试步骤如下:在设定吸附温度(25℃)进行动态穿透测试,至吸附饱和后,将分析气迅速切换成常温常压、流量为15 ml·min-1的Ar,并检测尾气组成至其中CO2浓度低于原料气CO2浓度的0.1%时,继续用Ar吹扫一定时间,完成再生。然后开始下一轮吸附测试,重复上述步骤。
2 实验结果与讨论
2.1 整体式多孔炭的制备与表征
所制备的整体式多孔炭材料(MCM-Mg)选用间苯二酚和甲醛为炭源,以碱式碳酸镁为催化剂,经90℃凝胶、老化及炭化步骤得到目标材料。实验发现,此聚合体系在90℃下仅需30 min即形成凝胶,相比于传统的碳酸盐催化(需要几个小时甚至更长的凝胶时间)[21-22],碱式碳酸镁的使用极大提高了反应速率。这主要归因于该体系中高价阳离子Mg2+的存在。酚醛低聚体与金属离子中间螯合物骨架中正电荷的存在,有利于螯合物的稳定,从而有利于甲醛加到酚环上,促进醚键的生成,使反应向进一步缩聚形成体相结构的方向进行[21-22]。实验中采取EDS测试分析了样品中元素组成,可能由于Mg含量太低,EDS没有给出Mg信号。但是,体系中含镁物种的存在可由饱和碱式碳酸镁水溶液的pH明显高于去离子水证明。多孔炭制备过程没有去除含Mg物种的步骤,在最高炭化温度(1000℃)下,参与反应的含Mg物种(如MgO、Mg)也不会挥发,因此,聚合物及多孔炭理论上含有痕量Mg元素。
典型聚合物及800℃炭化所得的多孔炭样品(MCM-Mg-800)的光学照片如图1插图所示:聚合物及多孔炭均呈现完整的整体式宏观形貌。聚合物的直径和高分别为2.80 cm和3.48 cm;多孔炭的直径和高分别为2.15 cm和2.60 cm,炭化过程径向与轴向线性收缩分别为23.2%与25.3%。径向与轴向基本一致的线性收缩表明样品骨架组成均匀。材料的整体式特性使得MCM-Mg可直接粉碎成适宜的颗粒并制成固定床吸附柱。相比于粉末炭,这种固定床压降小,无须额外加入黏结剂,有效避免了黏结剂堵孔。

图1 聚合物、MCM-Mg-800的SEM图与光学照片及MCM-Mg-800的TEM图
为了观察材料的形貌及结构,对所制备聚合物前驱体及最终炭样品进行了扫描电镜和透射电镜表征。从图1 (a)可以看出,聚合物具有类似海绵的骨架结构,类球形颗粒相互连接形成了丰富的大孔,孔径约300~600 nm。经800℃炭化后多孔炭材料MCM-Mg-800[图1 (b)插图]保持整体式宏观形貌,且从图1 (b)、(c)可以看出MCM-Mg-800具有丰富的大孔和微孔结构。进一步,材料机械强度测试表明样品MCM-Mg-800的轴向抗压强度高达9.4 MPa,是文献报道值(0.2 MPa)的47倍[23],原因可能是酚醛树脂首先在碱催化下发生体型缩聚,热解后所得炭样品骨架单元排列紧凑,相互交联构 成了三维网络结构。高机械强度特性可确保材料在高流量气源冲击下不粉化,大大延长了吸附剂使用寿命。
2.2 炭化温度对孔结构的影响
吸附剂的结构直接影响吸附剂性能。为研究样品孔结构参数等对吸附性能的影响,本文考察了炭化温度对样品孔隙结构的影响,并通过氮气物理吸附对系列样品进行结构表征。分别选择600、700、800、900和1000℃为热解温度,制备了5种整体式炭材料(样品命名为MCM-Mg-,600~1000)。N2吸附-脱附等温线如图2所示。等温线近似为I型等温线。低压段吸附量增加趋势,说明具有丰富微孔,TEM[图1 (c)]也充分证明了这一点;而高压段吸附量继续增加,并形成H3型滞后环,这是炭材料骨架颗粒堆积形成的狭缝孔。样品富含微孔的特性明显区别于传统碳酸盐催化获得富含中孔的材料,这与碱式碳酸镁的作用密切相关。从氮气吸/脱附曲线计算得出的吸附剂结构性质列于表1,比表面积、孔径、孔体积结果符合实际制备的吸附剂性质。可以看出,炭化温度越高(600~900℃),孔隙越发达,比表面积、微孔比表面积越大,这是高温下聚合物骨架充分分解所致,炭化收率的逐渐降低可以充分说明这一点。当炭化温度达到1000℃时,骨架出现收缩,导致孔结构坍塌,使其比表面积和孔容积均明显降低。
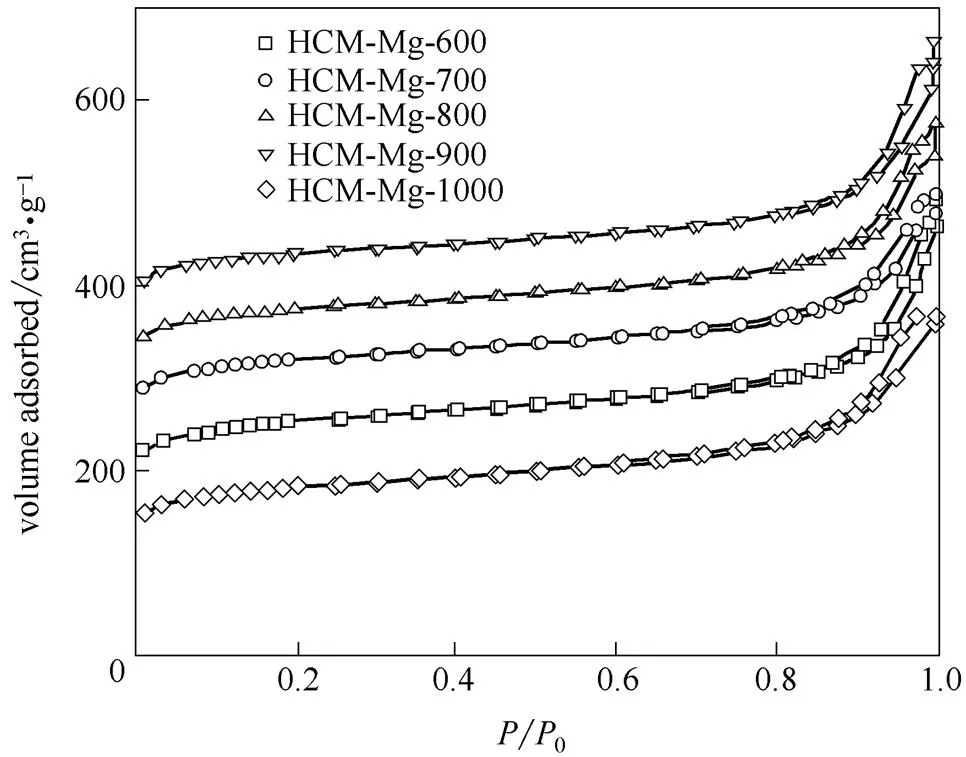
图2 多孔炭的N2吸附-脱附等温线
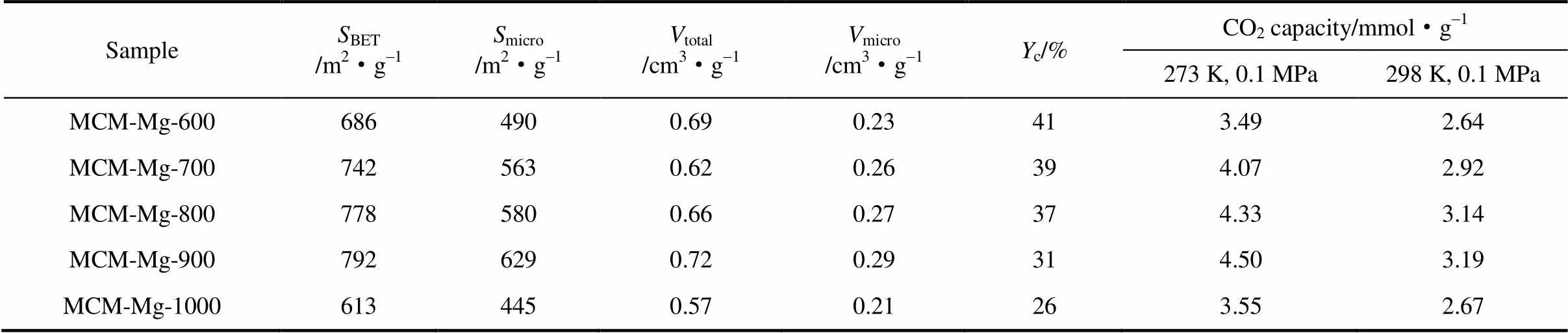
表1 多孔炭的结构参数及二氧化碳吸附性能
Note:BET—BET surface area,micro—micropore surface area,total—total pore volume,micro—micropore volume,c—carbonization yield.
在前期工作中,曾采用Na2CO3为催化剂,经过相同过程(90℃反应4 h,800℃炭化)可以制备出比表面积为618 m2·g-1的炭材料(RF-Na2CO3)[24]。与之相比,MCM-Mg-800的比表面积高出160 m2·g-1,micro相比RF-Na2CO3增加了23%。显然,和部分传统碳酸盐催化合成的炭材料相比[25],该合成路线不仅大大缩短了制备周期,且碱式碳酸镁制备的多孔炭MCM-Mg孔隙更加发达。MCM-Mg具有大孔-微孔串联的孔道系统以及丰富的微孔,兼顾高机械强度及整体式特点,推测该系列材料具有良好的CO2吸附分离性能。
2.3 CO2静态平衡吸附分离性能
根据图3 (a)插图中样品的微孔孔径分布可以看出,样品的微孔孔道集中分布在0.5~0.9 nm区间,这种适宜尺寸的微孔孔道有利于CO2分子的高效吸附,而贯通的大孔-微孔串联的孔道有利于提高材料的传质与吸附过程。基于样品的丰富微孔及高比表面积特性,测试了样品的二氧化碳静态平衡吸附性能。MCM-Mg在273 K的CO2吸附等温线如图3 (a)所示。随着炭化温度升高(600~900℃),样品在0.1 MPa的吸附量逐渐增加。其中,MCM-Mg-900吸附量达4.50 mmol·g-1,明显高于Na2CO3催化的CX-500(约3 mmol·g-1)。该吸附能力也优于氮掺杂多孔炭NPC-40-800等未活化的材料(表2)。0.015 MPa(典型烟道气的CO2分压)下MCM-Mg-900的CO2吸附量为1.87 mmol·g-1,说明MCM-Mg可用于含CO2混合气源的吸附分离。当样品炭化温度达到1000℃,其CO2吸附量明显降低。298 K下吸附量和上述规律完全一致[图3 (b)]。其中MCM-Mg-900在该条件下的CO2吸附量达3.19 mmol·g-1,超出了相同测试条件下文献报道的多种炭材料的吸附能力[26-27]。

图3 多孔炭CO2吸附等温线
为考察孔结构等参数对样品吸附性能的影响,测试了不同覆盖度下样品的CO2吸附热。如图4所示,MCM-Mg-1000的吸附热与其他样品有明显差别,原因推测为1000℃高温处理更利于消除材料的表面缺陷、降低比表面积,从而导致CO2吸附势下降。在吸附量较低时,MCM-Mg吸附热分布在17.5~27.5 kJ·mol-1之间,属于典型的物理吸附。对MCM-Mg-900进行能量弥散X射线谱测试发现无明显的Mg元素信号,C和O的元素组成质量分数为91.25%和8.75%,进一步证明了材料的物理吸附作用,这和碱式碳酸镁的低溶解度有关。在该吸附机理下,材料与CO2分子间化学相互作用微弱,因此,CO2吸附性能主要由材料孔结构决定。本文以MCM-Mg在0.1 MPa下CO2的吸附量为纵坐标,以微孔比表面积micro为横坐标作图(图5)。为了确保拟合的物理意义,人为使拟合直线通过(0,0)。可以看出,273 K和298 K吸附量和micro的线性拟合因子2分别达0.9921和0.9839。因此可认为材料CO2吸附量和micro线性相关,即MCM-Mg的微孔比表面积越大,其吸附量越高,充分证明了微孔在CO2吸附中的主导作用。

图4 不同CO2吸附量下的吸附热
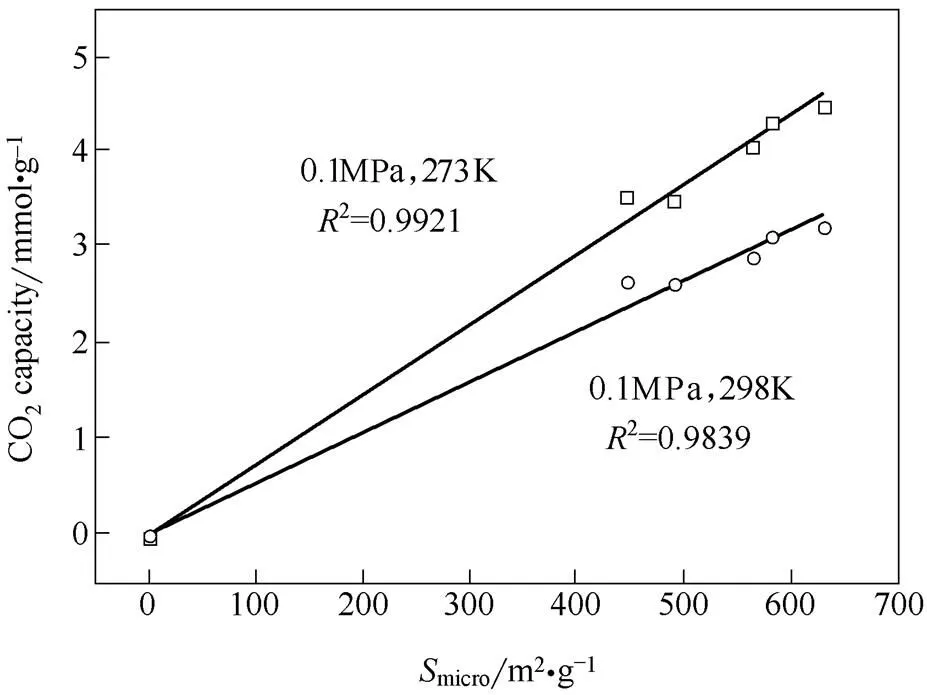
图5 CO2吸附量和微孔比表面积的关系
考虑到微孔对CO2吸附的重要性,评价材料的微孔比表面积利用率(microCO2capacity/micro)很有必要。目前,大量研究工作集中在通过物理或化学活化方法,利用KOH、H2O、CO2等对材料表面进行刻蚀而产生微孔,提高其吸附量。部分活化后炭的微孔比表面积利用率见表2。如KOH活化得到的CSA-800具有高达1704.8 m2·g-1的微孔比表面积,273 K下的吸附量也高达6.6 mmol·g-1,其单位微孔比表面积可吸附3.87 μmol CO2。本文以MCM-Mg-900为例,计算其单位微孔比表面积可吸附7.15 μmol CO2,尽管其微孔比表面积只有CSA-800的约35%,但每平方米微孔面积的吸附量却达到CSA-800的1.85倍,也超过了其他大部分活化多孔炭。这证明MCM-Mg具有很高的微孔比表面积利用率。原因推测是活化通常由表面向内部进行,随着活化的进行,包括材料固有的和活化初步产生的微孔不断扩孔,往往从小尺寸发展为大尺寸微孔。尽管微孔增多,微孔比表面积增大,但过大的微孔孔径反而削弱了CO2在表面的吸附势;而MCM-Mg在炭化过程中,聚合物骨架和催化剂分解产生的小分子都是由内而外释放,形成适宜CO2吸附的孔道后,不会进一步发生扩孔效应,从而表现出高的微孔比表面积利用率。此外,样品中丰富的大孔使CO2更容易扩散至微孔内部,也对micro有一定贡献。

表2 多孔炭结构参数、CO2吸附性能及微孔比表面积利用率比较
①N—prepare without activation, Y—prepare with activation; ②Determined by-plot method if not specified; ③Determined by NLDFT method; ④Determined by QSDFT method; ⑤Estimation from CO2adsorption-desorption isotherms.
2.4 多组分动态穿透分离性能
为模拟材料真实情况下的吸附分离能力,本文以CO2/N2(15:85)混合气作为气源,测试材料在298 K下的多组分动态穿透分离性能,结果如图6 (a)所示。混合气体通入吸附柱后5 min可在尾气中率先检测到N2,直到29 min才能检测到CO2,表明吸附剂可以实现CO2和N2的完全分离。该条件下CO2的饱和吸附量为0.95 mmol·g-1,与1.53×104Pa下的静态平衡吸附量(1.15 mmol·g-1)相近,表明动态条件下材料的CO2吸附性能并无明显降低。此外,由于炭材料的疏水特性,吸附饱和的吸附剂不需要预除水或变温除水,而经过常温惰性气体吹扫即可实现再生。该炭质吸附剂的温和再生条件明显优于分子筛[37]、MOFs[38]的真空高温再生。在该条件下,经过10轮循环[图6 (b)],材料的CO2吸附量均保持稳定,没有发生明显衰减。MCM-Mg-900也表现出相似的吸附分离行为[图6 (c)],CO2饱和吸附量为0.78 mmol·g-1,略低于样品MCM-Mg-800的动态饱和吸附量,这是由于动态条件下计算饱和吸附量压力低于静态吸附的压力,造成MCM-Mg-900的丰富微孔不能被充分利用。经过10轮循环后,吸附分离性能基本维持不变[图6 (d)]。向混合气中引入微量水汽,以CO2/N2/H2O (15/82.5/2.5)的混合气为气源,测得MCM-Mg-800在该条件下CO2的吸附量为0.94 mmol·g-1,和无水汽的0.95 mmol·g-1基本一致,证明MCM-Mg具有良好的耐水汽性能。

图6 材料的多组分动态穿透分离性能测试
3 结 论
(1)以间苯二酚和甲醛作为炭源,利用碱式碳酸镁的催化作用及易分解特性,经快速凝胶及控制炭化制得整体式多孔炭,机械强度达9.4 MPa。该方法具有如下特征:凝胶速度快,30 min即可凝胶;所制备材料孔隙发达,微孔比表面积大;CO2平衡吸附量高。
(2)考察了炭化温度对样品孔结构的影响,结果发现在一定范围内热解温度越高,孔隙越发达。但温度过高时,由于过度热解导致结构坍塌,其比表面积反而下降。
(3)材料具有大孔-微孔多级孔道以及丰富的微孔,在CO2吸附分离方面具有良好的性能。 273 K、0.1 MPa下CO2的静态吸附量最高达4.50 mmol·g-1,单位微孔比表面积可吸附7.15 μmol CO2,超过文献报道的大部分通过活化法制备的高吸附量炭材料。
(4)多组分动态穿透实验表明,该系列材料可以实现模拟烟道气浓度的CO2/N2的完全分离,仅需在室温条件下惰性气体吹扫即可实现再生,同时具有良好的耐水汽性能和循环吸附-脱附性能,推测MCM-Mg在实际吸附分离领域具有良好的应用 前景。
References
[1] Azar C, Lindgren K, Larson E, Möllersten K. Carbon capture and storage from fossil fuels and biomass—costs and potential role in stabilizing the atmosphere [J]., 2006, 74: 47-79.
[2] Jin Zhiliang (靳治良), Qian Ling (钱玲), Lü Gongxuan (吕功煊). CO2chemistry—actuality and expectation [J]... (化学进展), 2010, 22 (6): 1102-1115.
[3] Samanta A, Zhao A, Shimizu G K H, Sarkar P, Gupta R. Post-combustion CO2capture using solid sorbents: a review [J].....,2012, 51: 1438-1463.
[4] Zhao Huimin (赵会民), Lin Dan (林丹), Yang Gang (杨刚), Chun Yuan (淳远), Xu Qinhua (须沁华). Adsorption capacity of carbon dioxide on amine modified mesoporous materials with larger pore sizes [J].... (物理化学学报),2012, 28 (4): 985-992.
[5] D’Alessandro D M, Smit B, Long J R. Carbon dioxide capture: prospects for new materials [J]....., 2010, 49: 6058-6082.
[6] Li Liangsha (李亮莎), Wang Keke (王可可), Huang Hongliang (黄宏亮), Yang Qingyuan (阳庆元), Zhang Yi (张轶), Wang Shaohua (王少华), Wu Pingyi (吴平易), Lan Ling (兰玲), Liu Dahuan (刘大欢), Zhong Chongli (仲崇立). Synthesis of exceptional stable Hf-based metal-organic frameworks: characterization, stability and CO2adsorption performance [J].(化工学报), 2014, 65 (5): 1706-1715.
[7] Liang Hui (梁辉), Liu Zhen (刘振), Li Ping (李平), Yu Jianguo (于建国). CO2capture by adsorption with carbonaceous materials and electrothermal desorption [J].(化工学报), 2010, 61 (4): 879-886.
[8] Wang L, Huang Z, Yue M, Li M, Wang M, Kang F. Preparation of flexible phenolic resin-based porous carbon fabrics by electrospinning [J]...., 2013, 218: 232-237.
[9] Ma X, Cao M, Hu C. Bifunctional HNO3catalytic synthesis of N-doped porous carbons for CO2capture [J]...., 2013, 1 (3): 913-918.
[10] Mahurin S M, Górka J, Nelson K M, Mayes R T, Dai S. Enhanced CO2/N2selectivity in amidoxime-modified porous carbon [J]., 2014, 67: 457-464.
[11] Xia Y, Mokaya R, Walker G S, Zhu Y. Superior CO2adsorption capacity on N-doped, high-surface-area, microporous carbons templated from zeolite [J]..., 2011, 1 (4): 678-683.
[12] Wang J, Heerwig A, Lohe M R, Oschatz M, Borcharde L, Kaskel S. Fungi-based porous carbons for CO2adsorption and separation [J]...., 2012, 22: 13911-13913.
[13] Sevilla M, Valle-Vigón P, Fuertes A B.N-doped polypyrrole-based porous carbons for CO2capture [J]...., 2011, 21 (14): 2781-2787.
[14] Hao Guangping (郝广平). Designed synthesis of hierarchical porous carbon monoliths for CO2capture [D]. Dalian: Dalian University of Technology, 2012.
[15] Feng Zongjun (冯宗军). Preparation and characterization of carbon aerogel and composite for thermal insulation [D]. Changsha: National University of Defense Technology, 2012.
[16] Hao G, Li W, Qian D, Wang G, Zhang W, Zhang T, Wang A, Schüth F, Bongard H, Lu A. Structurally designed synthesis of mechanically stable poly(benzoxazine-co-resol)-based porous carbon monoliths and their application as high-performance CO2capture sorbents [J]....., 2011, 133 (29): 11378-11388.
[17] Fairén-Jiménez D, Carrasco-Marín F, Moreno-Castilla C. Porosity and surface area of monolithic carbon aerogels prepared using alkaline carbonates and organic acids as polymerization catalysts [J]., 2006, 44 (11): 2301-2307.
[18] Zhang Hengzhong (张衡中). Estimation of standard enthalpies of formation of complex oxide [J].(有色金属), 1994, 46: 58.
[19] Yuan Chunhua (袁春华), Li Haimin (李海民). Study on synthetic methods and application of basic magnesium carbonate [J].(盐湖研究), 2005, 13 (2): 40-44.
[20] Qian D, Lei C, Wang E, Li W, Lu A. A method for creating microporous carbon materials with excellent CO2-adsorption capacity and selectivity [J]., 2014, 7: 291-298.
[21] Li Wencui (李文翠). Study on the synthesis, characterization and application of novel carbon aerogels [D]. Dalian: Dalian University of Technology, 2002.
[22] Barral K. Low-density organic aerogels by double-catalysed synthesis [J]..., 1998, 225: 46-50.
[23] Huang Y, Cai H, Feng D, Gu D, Deng Y, Tu B, Wang H, Webley P A, Zhao D. One-step hydrothermal synthesis of ordered mesostructured carbonaceous monoliths with hierarchical porosities [J]...,2008, 23: 2641-2643.
[24] Mi Juan (米娟). Preparation and electrochemical performance of heteroatom-doped carbon materials for supercapacitors [D]. Dalian: Dalian University of Technology, 2012.
[25] Rodrigues L A, Campos T M B, Alvarez-Mendes M O, Coutinho A, Sakane K K, Thim G P.Phenol removal from aqueous solution by carbon xerogel [J]..-.., 2012, 63 (2): 202-210.
[26] Saha D, Deng S.Adsorption equilibrium and kinetics of CO2, CH4, N2O, and NH3on ordered mesoporous carbon [J]..., 2010, 345: 402-409.
[27] Chandrasekar G, Son W, Ahn W. Synthesis of mesoporous materials SBA-15 and CMK-3 from fly ash and their application for CO2adsorption [J]..., 2009, 16: 545-551.
[28] Zubizarreta L, Arenillas A, Pirard J, Pis J J, Job N.Tailoring the textural properties of activated carbon xerogels by chemical activation with KOH [J]....,2008, 115 (3): 480-490.
[29] Gu J, Kim W, Hwang Y, Huh S.Template-free synthesis of N-doped porous carbons and their gas sorption properties [J]., 2013, 56: 208-217.
[30] Qian D, Lei C, Hao G, Li W, Lu A.Synthesis of hierarchical porous carbon monoliths with incorporated metal-organic frameworks for enhancing volumetric based CO2capture capability [J]..., 2012, 4 (11): 6125-6132.
[31] Zhu B, Li K, Liu J, Liu H, Sun C, Snape C E, Guo Z.Nitrogen- enriched and hierarchically porous carbon macro-spheres— ideal for large-scale CO2capture [J]...., 2014, 2: 5481-5489.
[32] Sevilla M, Fuertes A B. Sustainable porous carbons with a superior performance for CO2capture [J]..., 2011, 4: 1765-1771.
[33] Liu Z, Du Z, Song H, Wang C, Subhan F, Xing W, Yan Z.The fabrication of porous N-doped carbon from widely available urea formaldehyde resin for carbon dioxide adsorption [J]... 2014, 416: 124-132.
[34] Sevilla M, Fuertes A B. CO2adsorption by activated templated carbons [J]..., 2012, 366: 147-154.
[35] Wang J, Senkovska I, Oschatz M, Lohe M R, Borcharde L, Heerwig A, Liu Q, Kaskel S.Highly porous nitrogen-doped polyimine-based carbons with adjustable microstructures for CO2capture [J]...., 2013, 1: 10951-10961.
[36] Zhao Y, Zhao L, Yao K X, Yang Y, Zhang Q, Han Y.Novel porous carbon materials with ultrahigh nitrogen contents for selective CO2capture [J]...., 2012, 22: 19726-19731.
[37] Harlick P J E, Tezel F H. An experimental adsorbent screening study for CO2removal from N2[J]...., 2004, 76: 71-79.
[38] Liu J, Wang Y, Benin A I, Jakubczak P, Willis R R, LeVan M D.CO2/H2O adsorption equilibrium and rates on metal-organic frameworks:HKUST-1 and Ni/DOBDC [J]., 2010, 26 (17): 14301-14307.
Synthesis of porous carbon through polymerization catalyzed by basic magnesium carbonate and their CO2adsorption performance
WANG Enmin, LI Wencui, LEI Cheng, LU Anhui
(State Key Laboratory of Fine Chemicals, School of Chemical Engineering, Dalian University of Technology,Dalian 116024, Liaoning, China)
By taking the advantages of easy decomposition and catalytic function of basic magnesium carbonate, the mechanically stable porous carbon materials (MCM-Mg) are synthesized through rapid gelation of resorcinol with formaldehyde and subsequently carbonization. Compared with samples catalyzed by traditional carbonates, the synthesis process can obtain a well-developed porous structure. The resulted samples can withstand a pressure of up to 9.4 MPa. At 273 K, the equilibrium CO2adsorption capacities of MCM-Mg are in the range of 3.49—4.50 mmol·g-1at 0.1 MPa and can reach 1.87 mmol·g-1at 0.015 MPa. Experimental test of the MCM-Mg shows that the micropores play a major role in contribution of the amount of adsorbed CO2. Importantly, MCM-Mg can adsorb 7.15 μmol CO2permicro, which surpasses most of the carbons prepared by activation. Dynamic breakthrough tests show that over such series of samples, CO2/N2streams can be fully separated. The CO2release is achieved facilely in Ar purge at 298 K. The samples also exhibit stable performance for CO2separation under humid conditions and exhibit good regeneration capability.
porous carbon; CO2capture; basic magnesium carbonate; adsorption; porous media; dynamic breakthrough
10.11949/j.issn.0438-1157.20141744
TQ 028
国家杰出青年科学基金项目(21225312);国家重点基础研究发展计划项目(2013CB934104)。
2014-11-25.
Prof. LU Anhui, anhuilu@dlut.edu.cn
supported by the National Science Fund for Distinguished Young Scholars (21225312) and the National Basic Research Program of China (2013CB934104).
A
0438—1157(2015)07—2565—08
2014-11-25收到初稿,2015-04-24收到修改稿。
联系人:陆安慧。第一作者:王恩民(1990—),男,硕士研究生。
