牛乳制品中青霉素酶Alphalisa的检测方法
2015-10-14张姜琳聂福平李应国肖进文蔡家利袁增壮叶自霞王国民
张姜琳,聂福平,杨 俊,李应国,肖进文,蔡家利,袁增壮,叶自霞,王国民,王 昱,*
(1.重庆出入境检验检疫局技术中心,重庆 400020;2.重庆理工大学药学与生物工程学院,重庆 400054;3.西南大学动物科技学院,重庆 400716)
牛乳制品中青霉素酶Alphalisa的检测方法
张姜琳1,2,聂福平1,杨俊1,李应国1,肖进文1,蔡家利2,袁增壮3,叶自霞3,王国民1,王昱1,*
(1.重庆出入境检验检疫局技术中心,重庆 400020;2.重庆理工大学药学与生物工程学院,重庆 400054;3.西南大学动物科技学院,重庆 400716)
建立牛乳制品中青霉素酶Alphalisa的检测方法。将青霉素酶进行生物素化,与样品中的青霉素酶竞争结合鼠源性青霉素酶单克隆抗体,利用Alphalisa反向竞争的反应模式,对牛乳中的青霉素酶实施检测。建立的Alphalisa检测方法能特异性识别样品中存在的青霉素酶,方法的线性范围在2.5~500 IU/mL;检出限和定量限分别为1.6 IU/mL和5 IU/mL;批间批内变异度均小于10%。结果表明,该方法能够替代传统酶联免疫吸附实验方法,成为青霉素酶的实验室筛查或检测方法。
青霉素酶;Alphalisa检测;牛乳制品
长期以来,由于价格低廉,疗效确切,青霉素常作为治疗奶牛乳腺炎的首选药物[1]。然而,青霉素的滥用导致牛乳中的青霉素残留已经成为广大消费者关注的重点[2]。随着国家对乳及乳制品抗生素残留监管力度的增加,一些不法商贩在牛乳中非法添加青霉素酶,以降解牛乳中残留的青霉素,进而促生了青霉素酶的添加和残留问题[3]。青霉素酶属于β-内酰胺酶,可水解青霉素类的β-内酰环,使青霉素水解为青霉噻唑酸[4]。青霉噻唑酸可与T细胞表面组织相容性复合物或与镶嵌在细胞膜内的多肽结合,所形成的复合物激发T细胞,从而引起过敏反应[5]。更为严重的是,青霉素酶的使用可导致青霉素的滥用,可能导致大量耐药菌株的产生,严重威胁人类及动物的安全健康[6]。卫生部于2011年4月19日在《食品中可能违法添加的非食用物质和易滥用的食品添加剂名单(第1-5批汇总)》中明确指出β-内酰胺酶列为非食用物质,在食品中添加β-内酰胺酶属于违法行为[7]。由此,对牛乳制品中青霉素酶的检测具有重要的意义。
现有的青霉素酶的检测方法有碘量法[8]、酸度法[9]、高效液相色谱法[10]、酶联免疫法[11]、头孢硝噻吩显色法[12]以及杯碟法[13]等。碘量法是《中国药典》中规定的检测β-内酰胺酶活性的方法,该法方便快捷、检出限高。张鑫潇等[14]采用本法得出的检出限为12.3 U/mL,但已被认为重复性不好[12]。酸度法操作简单,检出限高。刘姗姗等[9]采用酸度法得出的检出限为8.92 U/mL,王国红等[15]得出的检出限为10 IU/mL。酸度法检测时间短,但易受温度等外界环境干扰。高效液相色谱仪器成本高,孙汉文[10]、林楠[16]等得出的检出限均为4 U/mL,但此法的前处理过程复杂。唐群力等[12]采用头孢硝噻吩法得出的检出限为20 U/mL。头孢硝噻吩法操作简单、方便快捷,但价格昂贵,重复性较差,定量不准确,假阳性率高。杯碟法是卫生部规定的检测β-内酰胺酶类物质的方法,其原理是采用对青霉素类药物绝对敏感的标准菌株,利用舒巴坦抑制β-内酰胺酶的活性,并加入青霉素作为对照,通过比对加入β-内酰胺酶抑制剂与未加入的样品所产生的抑菌圈的大小来间接测定样品是否含有β-内酰胺酶类药物。但由于不同厂家对酶活性单位的定义不一,不同的研究者报告的检出限差异极大。薛晓晶等[13]测定方法的检出限为0.5 IU/mL,魏国美[17]测定方法的检出限为0.005 IU/mL,刘姗姗[18]得出的检出限为4 U/mL,李锦荣等[19]得出的检出限为0.004 U/mL,刘芳等[20]得出的检出限为2.0×10-5~1.6×10-4U/mL。杯碟法尽管有着很高的灵敏度和准确性,但是操作繁琐,检测时间长。
Alphalisa是基于近距离能量共振的原理发展起来的,通过抗原抗体的相互作用形成供体微珠-抗原-抗体-受体微珠复合物,在680 nm波长处的激光作用下发生荧光共振能力转移,释放单体氧分子作用于受体微珠,于615 nm波长处出现发射光波[21]。与传统的酶联免疫吸附方法相比,Alphalisa具有更高的敏感性、均一性,所需时间短,无需洗涤等优点。目前,该技术主要应用于疫病检测[22]、药物残留检测[23]和蛋白分子相互作用[24]等研究领域。Mechaly等[25]将Alphalisa技术应用于炭疽芽孢孢子和保护性抗原的检测,其中可检测出孢子106个/mL,对保护性抗原的检出限为10~100 pg/mL。Mcgiven等[22]对牛、山羊、绵羊血清中的布氏杆菌进行检测,其敏感性和特异性很高,敏感性为96%,特异性为98%。He An[26]等使用Alphalisa CYFRA 21-1试剂盒对肿瘤标志物CYFRA21-1抗原进行检测,其检出限为0.08 ng/mL。Chau等[27]运用高通量的Alphalisa法测定γ-分泌酶,发现γ-分泌酶抑制剂可能治疗癌症和其他疾病。Waller等[24]用Alphalisa技术研究并表明了丙型肝炎病毒编码的NS5A和环孢菌素A之间的存在着相互作用。Zhang Yi等[23]使用Alphalisa技术检测牛乳、蜂蜜、鸡蛋中氯霉素的含量,其灵敏度为0.008 6 ng/mL,检测范围为0.009 6~25 ng/mL。但国内外还没有运用Alphalisa技术检测青霉素酶的相关报告。本研究,将青霉素酶进行生物素化,结合采用Alphalisa反向竞争的反应模式,对牛乳等乳制品中的青霉素酶实施检测。
1 材料与方法
1.1材料与试剂
青霉素酶(P0389) 美国Sigma公司;Zeba Spin脱盐柱(89889)、青霉素酶(ab10712) 美国Thermo Scientific公司;青霉素酶抗体(ab12251)、鸡抗鼠IgG(ab6706) 英国Abcam公司;ChromaLink™ Biotin(B-1001-010) 美国Solulink公司; AlphaScreen® Streptavidin Donor beads(6760002)、AlphaScreen® Unconjugated Acceptor Beads(6762001) 美国Perkinelmer公司。
1.2方法
1.2.1抗原的纯化及生物素化
抗原的纯化:将青霉素酶溶解于修饰缓冲液(100 mmol/L磷酸钠、150 mmol/L NaCl、pH 8.0)中,用Zeba Spin脱盐柱进行液体交换和脱盐净化。净化过程:取出低温保存的脱盐柱,回复室温,去掉脱盐柱底端封口帽,开盖,将柱子放入收集管中。4 ℃、1 500 r/min离心2 min,去除保存液。向柱子中加入合适体积的待交换溶液,洗柱,4 ℃、1 000 r/min离心2 min,重复2~3次。将柱子放入新的收集管中,慢慢将适量的样品注入树脂的中心位置。5 mL的柱子上样量为500~2 000 μL。4 ℃、1 000 r/min离心2 min,收集样品。A280nm测定蛋白质量浓度,并进行聚丙烯酰胺凝胶电泳,确定蛋白的相对分子质量。
青霉素酶的生物素化:用修饰缓冲液将蛋白质量浓度调整到1~2 mg/mL。计算抗原和生物素化试剂的比例,取53 μL脱盐后的抗原溶液加入4.6 μL的Chromalink Biotin的二甲基甲酰胺溶液(取1 mg Chromalink Biotin加入100 μL无水二甲基甲酰胺中即成)中,室温条件下结合90 min。同前进行脱盐,也交换缓冲体系为Alphalisa检测缓冲液(含25 mmol/L 4-羟乙基哌嗪乙磺酸,0.5%聚乙二醇辛基苯基醚,0.1%干酪素,1 mg/mL葡聚糖T500,pH 7.4)中,分光光度计测定A280nm和A354nm的值,计算摩尔替换比率(molar substitution ratio,MSR)。
1.2.2受体磁珠偶联抗鼠IgG
取5~50 μL(20 mg/mL)的受体磁珠于1.5 mL的离心管中,加入50 μL的磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4),14 000 r/min离心15 min,去上清液。现配400 mmol/L NaBH3CN溶液,然后按照每5 μL受体磁珠和10 μL抗小鼠IgG抗体(1 mg/mL)、1 μL NaBH3CN、0.125 μL的10%吐温20以及3.875 μL的HEPES Buffer 37 ℃轻柔振荡反应18~24 h。然后加入10 μL 65 mg/mL的CMO溶液(用800 mmol/L的NaOH溶液现配现用),37 ℃,轻柔振荡反应1 h。然后4 ℃、14 000 r/min离心15 min,去上清液,然后加 入200 ☒L的100 mmol/L Tirs-HCl(pH 8.0)重悬磁珠。随即进行10 次超声振荡(每次1 s),4 ℃、14 000 r/min离心15 min,去上清液。然后加入Tirs-HCl(pH 8.0)溶液,同前进行第二次超声,离心,去上清液,加200 μL的PBS(含0.05%的Proclin-300),涡旋振荡,同前简短超声,避光保存。
1.2.3Alphalisa检测和优化
检测反应体系采用反向竞争模式,检测过程均在室温条件下完成,具体操作如下:取青霉素酶溶解于检测缓冲液中,然后取5 μL该溶液和等体积的抗青霉素酶单克隆抗体反应1 h,形成抗原抗体复合物;然后加入5 μL生物素化青霉素酶反应0.5 h,竞争结合游离的抗青霉素酶单抗;接着加入各5 μL的抗鼠IgG包被受体磁珠工作液和链亲和素供体磁珠工作液,避光反应0.5 h,最终形成如图1所示的供体磁珠-生物素化青霉素酶-抗青霉素酶单抗-受体磁珠复合物。最后,在ENspire multimode reader的Alphalisa检测模块中,以680 nm波长处的入射光下发生荧光共振能力转移,单体氧传递到受体磁珠上,同步激发波长615 nm的发射光,记录反应的信号值。

图1 研究采用的反向竞争Alphalisa反应模式Fig.1 Revers competition Alphalisa used in this study
优化试验,首先将抗体1(ab 12251)和抗体2(ab 10712)分别稀释3 个浓度梯度:5、20 nmol/L和60 nmol/L,其他条件固定:供体及受体磁珠质量浓度均为100 μg/mL,然后和浓度为60 nmol/L的生物素化青霉素酶进行反应,根据反应的具体效果选择抗原抗体反应对。抗原抗体对固定后,分别梯度稀释生物素化抗原(400、133、80、57 nmol/L和44 nmol/L)和抗体的浓度(67、22、13 nmol/L和10 nmol/L),同时固定其他反应条件,测试不同浓度条件下的反应效果。最后,分别梯度稀释供体磁珠以及受体磁珠的质量浓度(20、40、80、100、160 μg/mL和200 μg/mL),固定其他反应条件交叉反应,选择最佳的磁珠工作质量浓度。
1.2.4标准曲线、检出限、定量限、线性范围和特异性的确定
选取和待测样品相同基质的无青霉素酶样品为原料,用等量的检测缓冲液溶解后,12 000 r/min离心取上清液,用0.45 μm滤器过滤后作为标准品的稀释溶液。用不同基质稀释液将青霉素酶标准品倍比稀释为5 000、 500、250、50、25、5、2.5、1 IU/mL和0 IU/mL作为标准曲线的备用点,每个梯度分别取5 μL和抗体反应1 h,然后加入5 μL生物素化青霉素酶反应0.5 h,然后加入各5 μL的抗鼠IgG包被受体磁珠工作液和链亲和素供体磁珠工作液,避光反应0.5 h。最后,在ENspire multimode reader的Alphalisa模块中检测,记录反应的信号值。以相对荧光值为纵坐标,以相应的浓度的对数值为横坐标,做散点图,并以线性回归拟合曲线,得到不同样品类型的标准曲线和回归方程。检出限以0添加水平的平均测定值计算;定量限以线性回归曲线中能定量的最低浓度点计算。
为了验证方法的特异性,将青霉素酶、明胶、甘氨酸、酪蛋白、胰酶、葡聚糖、木瓜蛋白酶、胃蛋白酶以及乳清蛋白用检测缓冲液溶解为500 nmol/L的浓度,取5 μL同上检测,同时用空白检测缓冲液为阴性对照。
1.2.5添加回收实验和可重复性实验
为了分析方法在不同基质条件下的检测能力,分别选取杀菌乳、灭菌乳、发酵型酸乳、配方奶粉、复原乳和脱脂奶粉进行添加回收实验。每种基质添加250、100、50 IU/mL和5 IU/mL 4 个水平,每个水平分别进行批内和批间重复,每次重复数为3。标准曲线同前制备。可重复性用批内和批间重复的变异系数表示。
1.2.6样品的检测
从本地不同超市,采购杀/灭菌乳16 份、发酵型酸乳16 份、配方奶粉16 份、复原乳16 份和脱脂奶粉12 份。样品同时用杯碟法[28]和Alphalisa法进行检测。杯碟法检测时,牛乳样本的处理,对于不同的乳制品可能会略微不同,固态乳和半固体乳都要先做溶解和稀释,成液态后高速离心取上清 再经0.45 μm滤膜过滤一下。检测结果均以检出和未检出进行统计和比较。
2 结果与分析
2.1青霉素酶的生物素化和磁珠的抗体偶联
生物素化的青霉素酶在A280nm和A354nm处均有强烈吸收,而未生物素化的青霉素酶只在A280nm处有吸收。计算得知,蛋白质量浓度约为0.2 mg/mL,MSR值约为在3.6,批次间略有差异。生物素化的效率常常受到来自样品组成的影响。通常情况下,样品质量浓度越高,生物素化的效率会更高;样品中不能含有自由氨基的其他杂质或杂蛋白,譬如Tris、甘氨酸等。此外,样品的度也严重影响生物素化的效率,若蛋白发生了降解,生物素化的过程将严重受到阻碍。受体磁珠偶联抗小鼠IgG抗体同样受到蛋白质量浓度的影响。聚丙烯酰胺凝胶电泳结果表明如图2所示,经过柱子纯化的生物素化的青霉素酶纯度高,没有其他杂蛋白存在。在高质量浓度下,抗体容易偶联并饱和受体磁珠,在低浓度下抗体极难和受体磁珠结合。试验中是采取逐步测定偶联上清液中未结合的抗体浓度,加以反向推算偶联的IgG浓度,经计算偶联磁珠和IgG的分子比在1∶1 000~1∶1 500之间。
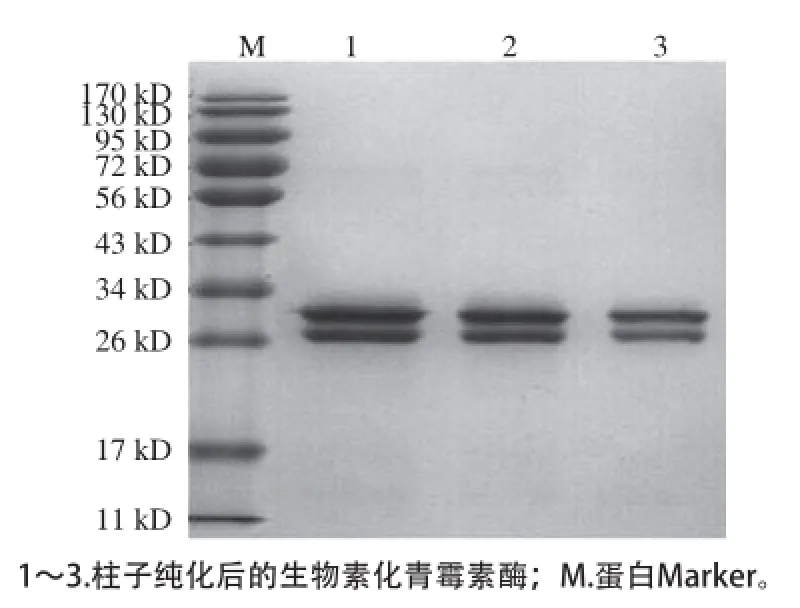
图2 2青霉素酶十二烷基硫酸钠-聚丙烯酰胺凝胶电泳Fig.2 SDS-PAGE of penicillinase
2.2Alphalisa检测和优化
经优化的反应体系为反向竞争模式,样品中的青霉素酶和抗体相互作用形成复合物,再加入已知浓度的生物素化青霉素酶竞争尚未形成复合物的游离抗体。加入抗鼠IgG包被受体磁珠和链亲和素供体磁珠后,若样品中青霉素酶的浓度范围适当,将形成生物素化青霉素酶和游离抗体为核心的复合物,出现反应信号。若样品中没有青霉素酶,信号值出现饱和,若样品中存在青霉素酶,抗体将被完全结合,从而生物素化青霉素酶无法形成复合物,检测信号达到最低值。实验表明,反应中的抗原抗体对的选择和抗原和抗体的反应浓度是最为关键的要素。如表1所示,抗体ab12251在各水平的检测值均高于抗体ab10712,由此选择抗体ab12251作为检测反应的抗体;如表2显示,随着抗原抗体浓度的递增,检测反应值梯度升高,但是在生物素化抗原浓度为133 nmol/L和400 nmol/L时出现了明显的拐点,考虑到生物素化抗原的量不易获得的情况,选择反应值在20460时的抗原抗体浓度作为优化的反应浓度;供体磁珠和受体磁珠的质量浓度均为100 μg/mL时信号值达到峰值,见表3。优化后的检测体系如下:取适量样品溶解于检测缓冲液中,然后取5 μL该样品溶液和等体积的22 nmol/L抗青霉素酶单克隆抗体(ab12251)反应1 h,然后加入5 μL 133 nmol/L生物素化青霉素酶反应0.5 h,然后加入各5 μL的抗鼠IgG包被受体磁珠工作液(100 μg/mL)和链亲和素供体磁珠工作液(100 μg/mL),避光反应0.5 h。最后,在ENspire multimode reader的Alphalisa模块中检测,记录反应的检测信号值。整个过程不需要洗板,时间为2 h。

表1 抗原-抗体反应对的选择Table1 The selection of Antigen-antibody reaction
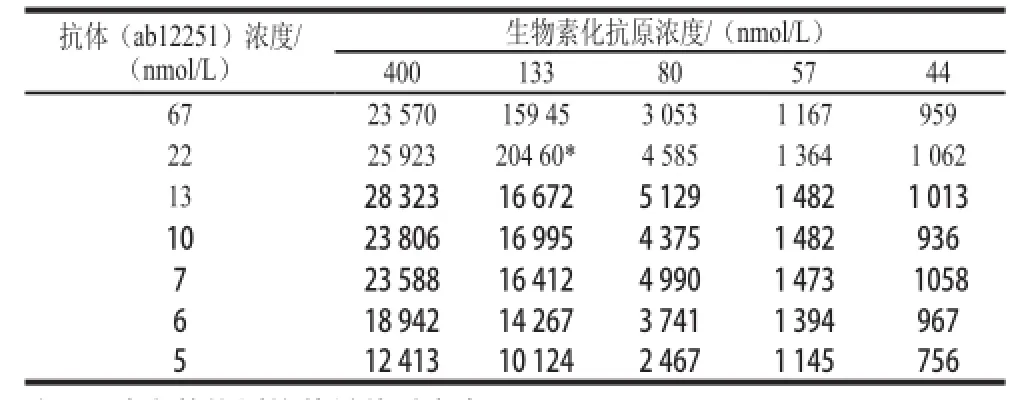
表2 抗原-抗体反应浓度的优化Table2 The optimization of the concentrations of antibody and antigen

表3 供体-受体磁珠工作浓度优化Table3 Optimization of the working concentrations of donatoracceptor beads
2.3方法的检测特征值
由于不同基质对反应的影响能力差异较大,因此标准曲线的制备采用针对不同样品来制备。当样品溶解于检测缓冲液后,经过离心,去掉不溶物和脂肪,再过滤,除去大颗粒的干扰物,更有利于检测反应的进行。通过多次反复实验,取青霉素酶标准品倍比稀释为500、250、50、25、5、2.5 IU/mL 6 个点获得最佳线性范围的标准曲线,以相对荧光值(Bx/B0)为纵坐标,以相应的浓度(C)的对数值(lgC)为横坐标,而得到该类样品中的最佳标准曲线,见图3。
通过以不同性质青霉素酶阴性样品的标准添加实验结果表明,方法对空白检测缓冲液的响应最为灵敏,表现为相同水平的标准曲线斜率更大(k=0.326)。不同性质的乳品均表现为含有反应抑制物,因此针对不同基质样品的检测,需要以相应的阴性样品作基质制备标准曲线。检出限以0添加水平的平均测定值计算,其中脱脂乳粉检出限最高,酸乳最低,结果见表4;定量限以线性回归曲线中能定量的最低浓度点计算,本方法对脱脂奶粉、复原乳、杀菌乳、灭菌乳、酸乳以及配方奶粉的检测定量限为5 IU/mL。在方法的特异性验证中,只有在添加青霉素酶时,有检测信号,说明方法特异性好,见表5。

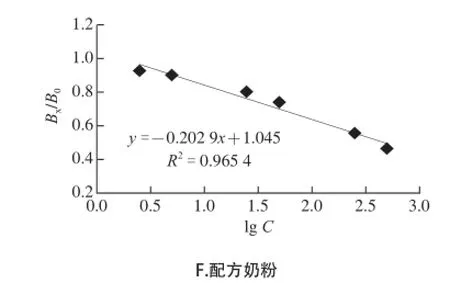
图3 各基质的标准曲线Fig.3 Standard curve different kinds of milk

表4 不同类型乳品中的检出限和定量限Table4 Limits of detection (LOD) and limits of quantitation (LOQ) in different kinds of milk

表5 检测方法的特异性Table5 Specificity of the assay
2.4添加回收实验和可重复性实验
青霉素酶在不同基质中均有良好的回收效果。总体上,中等水平的添加回收率较好,较高或较低水平的添加回收率较差,且在各个添加水平均满足青霉素酶快速检测的要求,见表6。检测方法在批内和批间的变异度均在10%以内。

表6 检测方法的回收率Table6 Recovery rates of the assay
2.5样品的检测
在所有检测的样品中,经杯碟法检出6 份,其余均为阴性。经Alphalisa法检出10 份,其中包括杯碟法[28]检出的6 份,见表7。相对于杯碟法,Alphalisa法检出率高出3.9%。2 种方法检出的阳性样品主要为杀菌乳和灭菌乳,酸乳、复原乳以及乳粉中青霉素酶检出率较低。原因可能是,在所有样品中,以杀菌乳和灭菌乳的黏稠度最低,样品更容易处理。结果表明Alphalisa法在检测灵敏度方面高于传统的杯碟法,检测的准确度和杯碟法相当。

表7 杯碟法与Alphalisa样品检出对比Table7 Contrast in the detection of samples between cylinder plate method and Alphalisa
3 结 论
青霉素酶的残留给乳制品的质量安全带来了极大的危害。将Alphalisa检测方法应用于青霉素酶的检测主要的挑战是基质样品的复杂性。在Mechaly等[25]的实验结果表明Alphalisa法可以克服基质样本的复杂性。该研究将Alphalisa方法应用于环境样品中炭疽孢子的检测,灵敏度达到106孢子/mL。本研究的结果也表明,不同的牛乳制品对反应均有一定程度的抑制,但是通过离心、过滤的处理后,都能在一定的浓度范围内呈现良好的线性反应规律。由于Alphalisa检测反应一直处于均相的液体环境下反应,检测限低于常规的同类方法。由于没有洗板的过程,Alphalisa检测的时间大大缩短,比常规酶联免疫吸附方法缩短1~2 h。由此可见,Alphalisa方法在复杂样品中进行快速、高灵敏度的检测能力极强,有望成为常规酶联免疫吸附方法的替代方法。
[1] 李世俊, 邓斌, 张曦, 等. 普鲁卡因青霉素在牛奶中的残留规律研究[J].黑龙江畜牧兽医, 2012(21): 69-71.
[2] 苏洋, 张婉洁, 徐可欣, 等. SPR生物传感器检测牛奶中氨苄青霉素残留[J]. 传感器与微系统, 2012, 29(11): 40-43.
[3] 张鑫潇, 谢岩黎, 王金水, 等. 牛乳中β-内酰胺酶的检测方法研究进展[J]. 中国乳品工业, 2012, 39(2): 45-47.
[4] 王芳, 仪宏, 王丽丽, 等. 羟胺法测定青霉素酶酶活的研究[J]. 中国抗生素杂志, 2010, 35(4): 316-319.
[5] 罗志敏, 周会艳, 王微微, 等. 青霉噻唑酸的制备及检测[J]. 药物分析杂志, 2013, 33(4): 628-633.
[6] 陈号, 马文静, 田晋红, 等. 牛奶中非法添加β-内酰胺酶的检测方法及研究现状[J]. 畜牧与饲料科学, 2010, 31(1): 67-69.
[7] 国家卫生和计划生育委员会. 食品中可能违法添加的非食用物质和易滥用的食品添加剂名单(第1-5批汇总)[S]. 北京: 国家卫生和计划生育委员会, 2011.
[8] 迟骁玮, 陈志伟. 牛奶中β-内酰胺酶检测方法的研究[J]. 黑龙江畜牧兽医, 2011(19): 27-30.
[9] 刘珊珊, 周正, 周巍, 等. 酸度计法快速检测牛奶中残留的β-内酰胺酶[J]. 食品科学, 2010, 31(10): 216-218.
[10] 孙汉文, 李挥, 张敬轩. 快速高分离液相色谱-串联质谱法检测原乳中活性β-内酰胺酶[J]. 分析化学, 2010, 38(8): 1203-1205.
[11] 罗祎, 宋洋, 薛晓晶, 等. 原料乳中三聚氰胺和β-内酰胺酶检测快速筛选法与确证方法比对研究[J]. 重庆医学, 2010(21): 2967-2970.
[12] 唐群力. 两种β-内酰胺酶检测方法的应用比较[J]. 检验医学与临床,2008, 5(7): 427-428.
[13] 薛晓晶, 李玲, 金涌, 等. 杯碟法检测乳中的β-内酰胺酶[J]. 食品科学, 2011, 32(4): 216-219.
[14] 张鑫潇. β-内酰胺酶快速检测试剂盒的研究[D]. 郑州: 河南工业大学, 2011: 51-56.
[15] 王国红, 王静, 向小黎. 酸度计在检测牛奶中残留青霉素酶含量的应用[J]. 农业与技术, 2012(2): 197-198.
[16] 林楠. 乳及乳制品中残留亲霉素甲酶解产物检测方法的研究[D]. 呼和浩特: 蒙古农业大学, 2008: 37-39..
[17] 魏国美. 杯碟法测定乳与乳制品中β-内酰胺酶[J]. 福建分析测试,2010, 19(3): 57-59.
[18] 刘姗姗. 牛奶中残留的β-内酰胺酶的检测方法研究[D]. 保定: 河北农业大学, 2011: 13-35.
[19] 李锦荣, 胡科锋, 张远平. 抗生素分解剂β-内酰胺酶的检测方法研究[J].现代食品科技, 2011, 27(8): 1020-1024.
[20] 刘芳, 李传礼, 何永盛, 等. 乳制品中β-内酰胺酶快速检测方法的研究[J]. 食品工业科技, 2013, 34(4): 69-72.
[21] 王颖. EV71 IgM AlphaLISA检测方法的初步建立[D]. 淮南: 安徽理工大学, 2010: 2-3.
[22] MCGIVEN J A, SAWYER J, PERRET L L, et al. A new homogeneous assay for high throughput serological diagnosis of brucellosis in ruminants[J]. Journal of Immunological Methods, 2008, 337(1): 7-15.
[23] ZHANG Y, HUANG B, ZHANG J. Development of a homogeneous immunoassay based on the AlphaLISA method for the detection of chloramphenicol in milk, honey and eggs[J]. Journal of the Science of Food and Agriculture, 2012, 92(9): 1944-1947.
[24] WALLER H, CHATTERJI U, GALLAY P, et al. The use of AlphaLISA technology to detect interaction between hepatitis C virus-encoded NS5A and cyclophilin A[J]. Journal of Virological Methods, 2010,165(2): 202-210.
[25] MECHALY A, COHEN N, WEISS S. A novel homogeneous immunoassay for anthrax detection based on the AlphaLISA method:detection of B. anthracis spores and protective antigen (PA) in complex samples[J]. Analytical and Bioanalytical Chemistry, 2013,405(12): 3965-3972.
[26] HE An, LIU Tiancai, DONG Zhining, et al. A novel immunoassay for the quantization of CYFRA 21-1 in human serum[J]. Journal of Clinical Laboratory Analysis, 2013, 27(4): 277-283.
[27] CHAU D M, SHUM D, RADU C, et al. A novel high throughput 1536-well Notch1 γ-secretase AlphaLISA assay[J]. Combinatorial Chemistry and High Throughput Screening, 2013, 16(6): 415-424.
[28] 卫生部. GB/T 22388—2008 关于印发全国打击违法添加非食用物质和滥用食品添加剂专项整治抽检工作指导原则和方案的通知(食品整治办[2009]29号)[S]. 北京: 北京市卫生局, 2008.
Establishment of the Alphalisa Method for the Detection of Penicillinase in Milk Products
ZHANG Jianglin1,2, NIE Fuping1, YANG Jun1, LI Yingguo1, XIAO Jinwen1, CAI Jiali2,YUAN Zengzhuang3, YE Zixia3, WANG Guomin1, WANG Yu1,*
(1. Technical Center, Chongqing Entry-Exit Inspection and Quarantine Bureau, Chongqing 400020, China;2. Institute of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing 400054, China;3. College of Animal Science and Technology, Southwest University, Chongqing 400716, China)
Penicillinase is one of the rick drugs present in milk products. In this article, the standard penicillinase was biotinylated, and competitively bound to mouse anti-penicillinase monoclonal antibodies by reverse competitive Alphalisa. The established Alphalisa detection method was shown to specifically identify penicillinase present in the samples. The variations between batches were less than 10%, with the limit of detection and the limit of quantitation of 1.6 IU/mL and 5 IU/mL, respectively, and the linearity range of 2.5-500 IU/mL. The results show that this method can replace the traditional ELISA method as a laboratory screening or detection method for penicillinase.
penicillinase; alphalisa detection; milk products
R155.5
A
1002-6630(2015)14-0181-06
10.7506/spkx1002-6630-201514035
2014-10-07
重庆市科技攻关项目(2014yykfA80017;2010GGC239);国家质检总局质检项目(2012IK029)
张姜琳(1986—),女,硕士研究生,研究方向为疫苗及抗体药物。E-mail:396436920@qq.com
王昱(1982—),男,高级兽医师,博士,研究方向为动物源食品安全。E-mail:cqciqwangyu@gmail.com
