正交试验优化黑果悬钩子茎、叶总黄酮的提取纯化及其抗氧化活性
2015-10-14古丽米热阿力木何大俊
郭 寒,葛 娟,李 鑫,古丽米热·阿力木,何大俊
(石河子大学生命科学学院,新疆 石河子 832000)
正交试验优化黑果悬钩子茎、叶总黄酮的提取纯化及其抗氧化活性
郭寒,葛娟,李鑫,古丽米热·阿力木,何大俊*
(石河子大学生命科学学院,新疆 石河子 832000)
利用单因素试验和正交试验优化了黑果悬钩子(Rubus caesius L.)茎和叶总黄酮的提取工艺,通过清除DPPH自由基、ABTS+·的方法测定了黑果悬钩子茎和叶的抗氧化活性。优化的总黄酮提取工艺为:提取温度80 ℃、提取时间70 min、乙醇溶液体积分数60%、料液比1∶90(g/mL)。通过比较AB-8等14 种大孔树脂对黑果悬钩子茎、叶总黄酮的吸附分离效果,从中筛选出AB-8大孔树脂是理想的吸附 剂。通过单因素试验,确定AB-8大孔树脂对黑果悬钩子总黄酮分离纯化的最优工艺为:上样流速1 mL/min、上样液总黄酮质量浓度0.32 mg/mL、上样体积80 mL,吸附饱和平衡后,以40 mL 60%乙醇溶液1.5 mL/min的流速动态洗脱。经AB-8大孔吸附树脂纯化后,提取液的总黄酮含量和抗氧化能力显著提高,叶和茎总黄酮含量为纯化 前的1.4 倍和2.4 倍,叶和茎的的ABTS+·清除能力分别为纯化前的1.7 倍和 2.5 倍,DPPH自由基清除能力分别为纯化前的1.7 倍和2.6 倍。这些结果表明:黑果悬钩子叶和茎均具有较高的总黄酮含量和明显的抗氧化活性,是潜在的天然抗氧化剂资源。
黑果悬钩子;总黄酮;提取纯化;抗氧化性
黑果悬钩子(Rubus caesius L.)又称欧洲木莓,果实为黑色小浆果,属于蔓生灌木,生于谷地灌丛或林缘,分布于新疆额敏、塔城、伊宁、尼勒克等地[1],为新疆所特有的悬钩子属植物,长期以来作为哈萨克药的常用药食同源植物[2]。研究表明,多种悬钩子属植物具有抗氧化等生物活性,其活性与其中含有的黄酮类、多酚类、鞣质、鞣花酸类成分密切相关[3-7]。黑果悬钩子果实中含有花青素、糖类、氨基酸、油脂类等[8],黑果悬钩子叶提取物含有多酚、黄酮类等成分,并具有较高的抗氧化活性[9],但是对黑果悬钩子茎的化学成分和生物活性的研究未见报道。明确其中的活性成分对于开发悬钩子属植物的功能食品和植物药具有重要的作用。本研究对黑果悬钩子茎和叶的总黄酮提取纯化工艺和抗氧化活性进行研究,以期从中发现具有高活性、低毒性的抗氧化剂,为开发利用新疆的黑果悬钩子资源提供理论依据。
1 材料与方法
1.1材料与试剂
黑果悬钩子(Rubus caesius L.)茎、叶采集于新疆额敏县兵团第九师165团,由石河子大学生命科学学院植物学教研室徐文斌老师鉴定为黑果悬钩子茎、叶。
芦丁(纯度≥98%) 国药集团化学试剂有限公司;6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS) 美国Sigma公司;AB-8等14 种大孔树脂沧州宝恩吸附材料科技有限公司;甲醇、三氯化铝、过硫酸钾等均为国产分析纯。
1.2仪器与设备
RE-52型旋转蒸发仪 上海亚荣生化仪器厂;S54紫外-可见分光光度计 上海棱光技术有限公司;BSA124S万分之一电子天平 德国Sartorius公司;KQ-100型超声波清洗器 昆山市超声仪器公司;FW型高速万能粉碎机 北京永光明医疗仪器厂;DK-S26水浴锅 上海精宏实验设备有限公司;SHZ-D(Ⅲ)循环水真空泵 郑州长城科工贸有限公司。
1.3方法
1.3.1原料处理
将黑果悬钩子茎、叶于50 ℃烘干后,分别用粉碎机粉碎,过孔径为1.2 mm筛,制备相同粒径的茎、叶粉末,再用石油醚脱叶绿素[10],直至石油醚变为无色为止,于50 ℃干燥至质量恒定,备用。
1.3.2总黄酮含量的测定
根据何书美等[11]的方法测定总黄酮含量。分别量取芦丁标准液(质量浓度0.4 mg/mL)0.100、0.175、0.250、0.325、0.400 mL于试管中,加入50%乙醇溶液至3 mL,再加入1 mL pH 5.5乙酸盐缓冲液,2 mL 1.5%三氯化铝溶液,混匀,静置30 min,同时设置空白对照,于415 nm波长处测吸光度。以质量(mg)和吸光度进行回归分析,得到回归方程:y=6.650x,R2=0.999。结果表明,在0~0.16 mg范围内吸光度与芦丁质量线性关系良好。样品液经适当稀释后,按照制作标准曲线的方法,测定其在415 nm波长处的吸光度。根据上述标准曲线计算相应的总黄酮含量,结果以每克样品中含有相当芦丁的毫克数表示,单位为mg/g。
1.3.3抗氧化活性测定
1.3.3.1DPPH法[12-13]
称取0.007 9 g DPPH用甲醇溶解,用甲醇定容于100 mL容量瓶(浓度2.0×10-4mol/L)。分别取各样液适量,加入甲醇稀释至5 mL再加入2 mL DPPH(浓度为2.0×10-4mol/L)溶液混匀,30 min后在517 nm波长处测量其吸光度,控制样本用甲醇代替提取液,以纯甲醇为参比溶液。对DPPH自由基的清除率按式(1)计算:

式中:A1为控制样本的吸光度;A2为测试样本的吸光度。
另以不同浓度(0、400、800、1 200、1 600、2 000 μmol/L)的Trolox清除DPPH自由基的能力做标准曲线,计算黑果悬钩子叶、茎提取物的Trolox当量抗氧化能力TEAC(Trolox equivalent antioxidant capacity)。得回归方程y=0.047 3x(R2=0.997 6),其中y为清除率,x为Trolox浓度/(μmol/L)。
1.3.3.2ABTS法[14]
称取0.41 g ABTS,用20 mmol/L乙酸盐缓冲液(pH 4.5)溶解并定容至100 mL,配制成7.4 mmol/L ABTS储备液。称取0.070 3 g过硫酸钾,加水溶解定容至100 mL,配制成2.6 mmol/L过硫酸钾储备液。将配制好的ABTS储备液与过硫酸钾储备液等体积混合,在室温黑暗条件下放置12 h,再用20 mmol/L乙酸盐缓冲液(pH 4.5)稀释45~55倍,以20 mmol/L乙酸盐缓冲液(pH 4.5)为空白对照,使ABTS工作液在734 nm波长处的吸光度为0.70±0.02。
取各样液适量于试管中,再加入pH4.5乙酸盐缓冲液至1 mL,然后加入4 mL ABTS工作液振荡10 s以充分混匀,静置10 min,用乙酸盐缓冲液作为参比,测定734 nm波长处的吸光度A4。用乙酸盐缓冲液代替样液加入4 mL ABTS工作液,在734 nm波长处测得吸光度A3。对ABTS+·的清除率按式(2)计算:
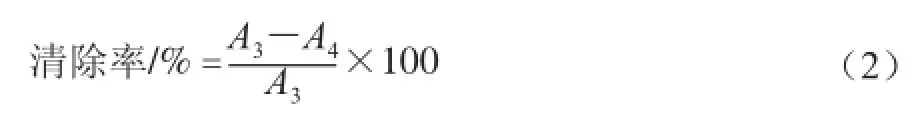
式中:A3为控制样本的吸光度;A4为测试样本的吸光度。
另以不同浓度(0、400、800、1 200、1 600、2 000 μmol/L)的Trolox清除ABTS+·的能力做标准曲线,计算黑果悬钩子叶、茎提取物的Trolox当量抗氧化能力TEAC。得回归方程:y=0.046 3x(R2=0.999 7),其中y为清除率,x为Trolox浓度/(μmol/L)。
1.3.4黑果悬钩子叶和茎总黄酮提取的单因素试验
考察溶剂种类、乙醇体积分数、提取温度、提取时间、料液比对总黄酮提取量和抗氧化活性的影响,每组实验重复3 次,取其平均值[15-16]。
1.3.4.1溶剂种类对总黄酮提取量的影响
固定料液比1∶40(g/mL)、室温超声提取(功率为100 W)、提取时间30 min,探讨水、甲醇、乙醇、丙酮、乙酸乙酯5 种溶剂对总黄酮提取量的影响。
1.3.4.2乙醇体积分数对总黄酮提取量的影响
固定料液比1∶40(g/mL)、室温超声提取(功率为100 W)、提取时间30 min,探讨乙醇体积分数(20%、40%、60%、80%、100%)对总黄酮提取量的影响。
1.3.4.3提取温度对总黄酮提取量的影响
固定料液比1∶40(g/mL)、乙醇体积分数60%、提取时间30 min,探讨提取温度(50、60、70、80、90 ℃)对总黄酮提取量的影响。
1.3.4.4提取时间对总黄酮提取量的影响
固定料液比1∶40(g/mL)、乙醇体积分数60%、提取温度80 ℃,探讨提取时间(15、30、45、60、75 min)对总黄酮提取量的影响。
1.3.4.5料液比对总黄酮提取量的影响
固定乙醇体积分数60%、提取温度80 ℃、提取时间30 min,探讨料液比(1∶20、1∶40、1∶60、1∶80、1∶100(g/mL))对总黄酮提取量的影响。
1.3.5黑果悬钩子叶总黄酮提取的正交试验
在单因素试验的基础上,以提取温度、提取时间、料液比、乙醇体积分数为影响因素,每因素3 个水平,对黑果悬钩子叶的总黄酮提取工艺进行L9(34)正交试验,因素水平见表1。

表1 黑果悬钩子叶总黄酮提取的LL9(334)正交试验因素水平表Table1 Factors and their coded levels for orthogonal array design
1.3.6黑果悬钩子叶和茎总黄酮的纯化工艺优化[17-19]
1.3.6.1大孔树脂的筛选
分别称取已预处理的AB-8、D101等14 种大孔树脂各0.5 g,分别加入茎和叶的提取液20 mL,在120 r/min的条件下振摇6 h,吸取0.5 mL测总黄酮质量浓度,按式(3)计算吸附量。吸附过的大孔树脂抽干,分别加入20 mL无水乙醇解吸附,于120 r/min的条件下振摇11 h,测定解吸液中的总黄酮质量浓度,按式(4)计算解吸量。根据吸附量和解吸量对几种大孔树脂进行筛选。

式(3)、(4)中:Q吸为吸附量/(mg/g);ρ0为吸附前样液中总黄酮的质量浓度/(mg/mL);ρe为吸附后剩余液中总黄酮的质量浓度/(mg/mL);V0为加入的样液体积/mL;m为干树脂质量/mg;Q解为解吸量/(mg/g);ρd为解吸液中总黄酮的质量浓度/(mg/mL);V1为加入的解吸液体积/mL。
1.3.6.2静态吸附时间的选择
称取2 份经预处理的AB-8树脂各0.5 g,分别加入20 mL茎、叶提取液进行静态吸附,室温条件下静置,间歇振荡,分别于不同时间测定剩余总黄酮质量浓度直至吸附平衡。
1.3.6.3乙醇体积分数对总黄酮静态解吸的影响
称取14 份经预处理的AB-8树脂各0.5 g,分别加入相同质量浓度的茎和叶提取液20 mL于120 r/min的条件下振摇6 h,测得吸附后的质量浓度ρe,计算树脂总黄酮吸附量。将吸附平衡后的树脂取出,抽滤,滤出的树脂中分别加入不同体积分数(30%、40%、50%、60%、70%、80%及90%)乙醇溶液20 mL,于120 r/min的条件下振摇12 h,测得解吸液总黄酮质量浓度ρd,计算解吸率。比较不同体积分数乙醇溶液的静态解吸效果。
1.3.6.4最佳上样流速的确定
将预处理好的8 份AB-8 树脂各2.0 g湿法装入10 mm× 200 mm层析柱,将相同质量浓度(0.32 mg/mL)的100 mL叶和茎提取液分别以0.5、1.0、1.5、2.0 mL/min的流速上柱,收集流出液,测定流出液的体积及总黄酮质量浓度,计算不同上样流速条件下树脂对总黄酮的吸附量。
1.3.6.5最佳上样体积的确定
将2 份预处理好的AB-8树脂各2.0 g湿法装入10 mm×200 mm层析柱,将相同质量浓度(0.32 mg/mL)的叶和茎提取液以1 mL/min的流速上样,每10 mL为一个流份收集,测定每个流分中的总黄酮质量浓度,绘制泄露曲线,确定最佳上样体积。
1.3.6.6最佳洗脱流速的确定
按确定的最佳吸附条件上柱,待总黄酮吸附完全后,水洗除去杂质,再用60%乙醇溶液分别以0.5、1.0、1.5、2.0 mL/min速率进行洗脱,洗脱液用量为72 mL。测定洗脱液中的总黄酮质量浓度,计算解吸量,比较不同洗脱流速对解吸效果的影响。
1.3.6.7 最佳洗脱体积的确定
按确定的最佳吸附条件上柱,用60%乙醇溶液,以1.5 mL/min的流速洗脱,每3 mL为一个流份收集,测定每个流份的总黄酮质量浓度,绘制洗脱曲线,以确定最佳的洗脱体积。
1.4统计分析
2 结果与分析
2.1黑果悬钩子叶和茎总黄酮提取的单因素试验结果
2.1.1溶剂种类的影响

表2 溶剂种类对总黄酮提取量和抗氧化活性的影响Table2 Effect of solvents on the extraction rate and antioxidant activity of flavonoiddss
由表2可知,黑果悬钩子叶和茎在用不同溶剂提取时,总黄酮提取量和抗氧化活性均有显著性差异,其中甲醇提取液中总黄酮提取量最高,其抗氧化活性也最高,但其毒性高,不适合作为提取溶剂;水提取液中的总黄酮含量和抗氧化活性次之,但糖等杂质的含量高,水的沸点高,不利于样品后续的浓缩;乙醇的总黄酮提取量和抗氧化活性高于丙酮和乙酸乙酯,且毒性小,沸点低,易于浓缩,适合叶和茎总黄酮、多酚的提取,在后续试验中,选择乙醇作为最佳溶剂进行提取。
2.1.2乙醇体积分数的影响

表3 乙醇体积分数对总黄酮提取量和抗氧化活性的影响Table3 Effect of ethanol concentration on the extraction rate and antioxidant activity of flavonoiddss
由表3可知,黑果悬钩子叶和茎用不同体积分数乙醇溶液提取时,总黄酮提取量和抗氧化活性均有显著性差异;在一定范围内随着乙醇体积分数的升高总黄酮提取量和抗氧化活性也升高,当乙醇体积分数为60%时,总黄酮提取量和抗氧化活性最高,随后总黄酮提取量和抗氧化活性随着乙醇体积分数的增加而降低。这可能是60%乙醇的极性与叶和茎中总黄酮化合物的极性最相近,此时的总黄酮溶解度最高。在后续试验中,以60%作为最佳的乙醇体积分数进行提取。
2.1.3提取温度的影响

表4 提取温度对总黄酮提取量和抗氧化活性的影响Table4 Effect of temperature on the extraction rate and antioxidant activity of flavonoidss
由表4可知,黑果悬钩子叶和茎在40~80 ℃温度范围内,总黄酮提取量和抗氧化活性随着温度的升高而升高,在90 ℃时,总黄酮提取量和抗氧化活性有所下降,说明在一定的温度范围内,总黄酮成分的渗透、扩散和溶解速度加快,90 ℃时可能由于温度太高使部分总黄酮成分降解。因此,在后续试验中,以80 ℃作为最佳的提取温度。
2.1.4提取时间的影响

表5 提取时间对总黄酮提取量和抗氧化活性的影响Table5 Effect of extraction time on the extraction rate and antioxidant activity of flavonoiddss
由表5可知,在15~60 min范围内,黑果悬钩子叶和茎的总黄酮提取量和抗氧化活性呈现出随提取时间延长而增加的趋势,超过60 min后,总黄酮提取量和抗氧化活性增幅缓慢甚至有些下降,并且差异不显著。说明在提取60 min时,总黄酮提取量基本达到饱和,在后续试验中,以60 min作为最佳的提取条件。
2.1.5料液比的影响
由表6可知,黑果悬钩子叶和茎总黄酮提取量和抗氧化活性随着溶剂用量的增大而增大,料液比在1∶80后,总黄酮提取量和抗氧化活性有所下降,综合考虑提取效率和提取成本,料液比宜在1∶80(g/mL)左右。
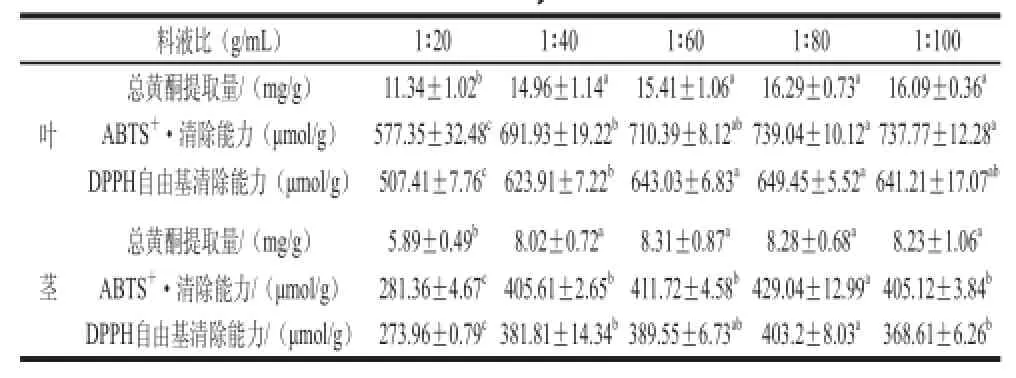
表6 料液比对总黄酮提取量和抗氧化活性的影响Table6 Effect of solid-to-solvent ratio on the extraction rate and antioxidant activity of flavonoidss
2.2正交试验结果

表7 黑果悬钩子叶总黄酮LL9(334)提取工艺优化正交试验设计及结果Table7 Orthogonal array design scheme and corresponding results
由表7可知,影响黑果悬钩子叶的总黄酮提取量的4 个主次顺序为乙醇体积分数>提取温度>料液比>提取时间,最优组合为A2B2C3D3,即黑果悬钩子叶的总黄酮的提取工艺确定为提取温度80 ℃、提取时间70 min、乙醇体积分数60%、料液比1∶90。在此条件下,果悬钩子叶的总黄酮提取量达到(16.32±0.44)mg/g。其总黄酮含量要远远高出同属植物树莓、黑莓等[20-21],这除了种的差异之外还可能和地区差异有关[22]。
2.3黑果悬钩子茎和叶总黄酮提取量和抗氧化活性的比较

表8 黑果悬钩子叶和茎总黄酮提取量和抗氧化活性的比较Table8 Comparison of extraction rates of flavonoids and antioxidant activity between stems and leaves off R. caesiiuuss L.
利用上述单因素试验和正交试验确定的叶总黄酮最佳提取工艺对茎和叶总黄酮进行提取,由表8可知,叶的总黄酮提取量和抗氧化活性均高于茎。其中叶的总黄酮提取量为(16.32±0.44)mg/g;叶提取物对ABTS+·和DPPH自由基清除能力较高,分别为(1 151.91±41.64)、(964.41±81.59)μmol/g。利用ABTS法和DPPH法测得抗氧化活性具有相似的趋势,即总黄酮含量越高,其抗氧化活性越高,提示黑果悬钩子叶中总黄酮成分可能是主要的抗氧化活性成分。测得的ABTS+·清除能力偏高,这和Sariburun等[4]测得结果不一致,可能是黑果悬钩子叶和茎中含有一些不容易和DPPH自由基反应的成分。
2.4黑果悬钩子叶和茎总黄酮纯化工艺优化
2.4.1大孔树脂的选择
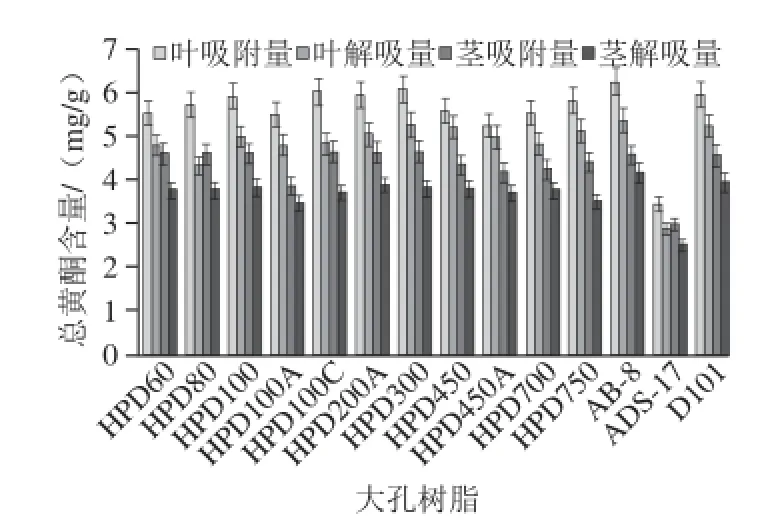
图1 14种不同树脂对黑果悬钩子叶和茎总黄酮的吸附和解吸效果Fig.1 Results of adsorption and desorption for flavonoids from stems and leaves of R. caesius L. by 14 macroporous resins
由图1可知,14 种树脂对黑果悬钩子茎和叶总黄酮的吸附和解吸效果不同,其中AB-8树脂对黑果悬钩子叶的吸附量和解吸量最大,分别达到(6.25±0.05)mg/g和(5.42±0.03)mg/g。AB-8树脂对黑果悬钩子茎的解吸量最大,为(4.11±0.09)mg/g,吸附量虽未达到最大,但和最大值非常接近。故选用AB-8作为黑果悬钩子叶和茎总黄酮纯化的树脂,这可能和同一植物叶和茎含有相似的化学成分有关。
2.4.2静态吸附时间的确定

图2 AB-8大孔树脂静态动力学吸附曲线Fig.2 Static adsorption curves of AB-8 macroporous resin
由图2可知,在一定时间内,随着时间的延长吸附速率变得缓慢,吸附量逐渐达到饱和,在4 h时基本达到吸附平衡,之后随着吸附时间的延长吸附量虽然有所增加但是增加速率很低。因此,在静态吸附实验中选择4 h为吸附时间。
2.4.3 乙醇体积分数对静态解吸的影响

图3 乙醇体积分数对解吸率的影响Fig.3 Effect of ethanol concentration on desorption rate
由图3可知,随着洗脱剂乙醇体积分数的增加,解吸率也在不断的升高。当体积分数为60%时,对黑果悬钩子叶和茎总黄酮的解吸率最大,当体积分数高于60%时,解吸率又逐渐降低,故后续实验采用体积分数为60%的乙醇溶液作为洗脱剂。
2.4.4最佳上样流速的确定
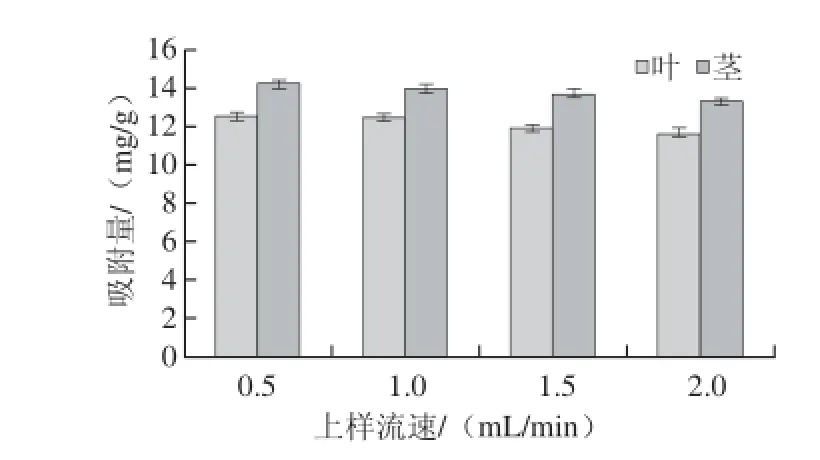
图4 上样流速对吸附量的影响Fig.4 Influence of sample loading flow rate on adsorption capacity
由图4可知,随着吸附流速增加,树脂吸附量逐渐下降。流速低,总黄酮与树脂的接触时间延长,有利于其从液相扩散到树脂相,有利于吸附;流速过快,被吸附物质来不及扩散到树脂表面就会发生泄漏流速过快,会提前泄漏;因此,流速低有利于总黄酮的充分吸附,但会使生产周期延长,成本增加。综合考虑,选定上样流速为1 mL/min,此时,树脂对叶、茎总黄酮的吸附量分别为12.50 mg/g和14.30 mg/g。
2.4.5最佳上样体积的确定
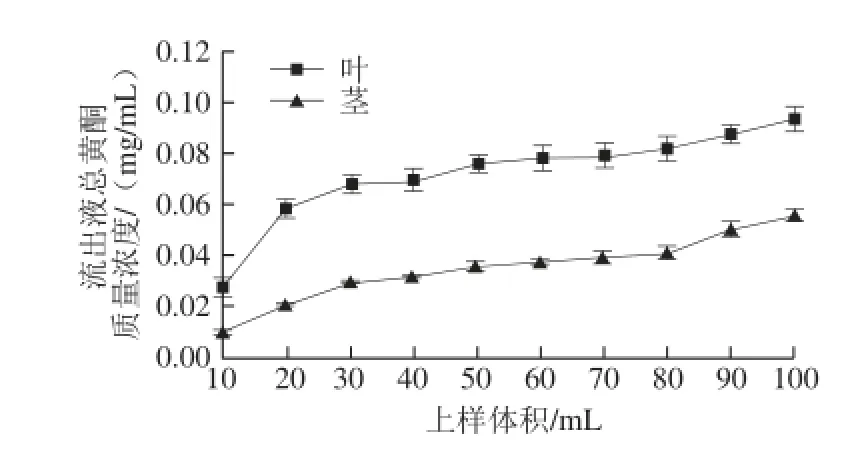
图5 总黄酮的泄露曲线Fig.5 Leakage curves of leaf and stem flavonoids
如图5所示,当上样体积为80 mL时,总黄酮的泄漏率开始明显增加,上样量越大,流出液中总黄酮质量浓度越大,浪费严重;反之,上样量太小,树脂处理量较小,纯化效率低。综合考虑,应选择上样体积为80 mL。
2.4.6 最佳洗脱流速的确定
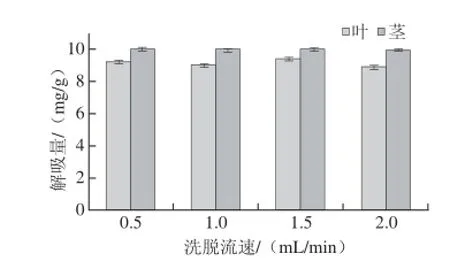
图6 洗脱流速对树脂解吸性能的影响Fig.6 Effect of elution flow rate on desorption rate
由图6可知,洗脱流速对解吸量的影响不大,在流速1.5 mL/min以下,茎和叶的总黄酮解吸量分别保持在10 mg/g及9 mg/g以上的水平。当洗脱流速为2 mL/min时解吸量稍有所下降,为了节省洗脱时间,提高工作效率,选用1.5 mL/min作为最佳洗脱流速。
2.4.7最佳洗脱体积的确定

图7 洗脱曲线Fig.7 Dynamic desorption curves
由图7可知,当洗脱体积达到30mL时洗脱液总黄酮质量浓度接近于零,且基本不再变化,说明30 mL洗脱剂基本洗脱完全,为了保证树脂中的总黄酮完全洗脱下来,用40 mL作为最佳洗脱体积。此时,树脂对叶和茎的总黄酮解吸率分别可达75.28%和70.28%。
2.5AB-8树脂对黑果悬钩子叶和茎总黄酮的纯化效果
在上述AB-8大孔树脂最佳纯化条件下,对黑果悬钩子叶和茎提取液分别进行纯化,比较纯化前后的总黄酮含量和抗氧化活性,结果见表9。经AB-8大孔吸附树脂纯化后,提取液的总黄酮含量和抗氧化能力显著提高。纯化后,叶和茎总黄酮含量为纯化前的1.4 倍和2.4 倍,叶和茎的ABTS+·清除能力分别为纯化前的1.7 倍和2.5倍,DPPH自由基清除能力分别为纯化前的1.7 倍和2.6倍。

表9 纯化前后总黄酮含量和抗氧化能力的比较Table9 Comparison of total flavonoids content and antioxidant activity before and after purificatioonn
3 结 论
通过单因素试验和正交试验,不同因素对黑果悬钩子叶总黄酮提取量和抗氧化活性的影响力大小:乙醇体积分数>提取温度>料液比>提取时间。得到的优化提取工艺条件:提取温度80 ℃、提取时间70 min、乙醇体积分数60%及料液比1∶90。这些提取条件对于黑果悬钩子叶、茎的总黄酮提取量和抗氧化活性表现出相似的作用,可能是由于同一植物叶和茎含有相似的总黄酮化合物。在不同提取条件下,叶和茎的抗氧化活性都是随着总黄酮含量增加而增加,总黄酮含量与ABTS+·、DPPH自由基清除能力的相关系数分别为0.997 9和0.975 7,提示其中总黄酮成分可能是主要的抗氧化活性成分。在此优化提取条件下,黑果悬钩子叶的总黄酮含量和抗氧化活性均高于茎,并且黑果悬钩子叶比茎有更大的生物量,说明黑果悬钩子叶是一种很好的潜在抗氧化植物资源。
确定的黑果悬钩子叶和茎总黄酮的纯化工艺为用AB-8大孔树脂纯化、上样流速1 mL/min、上样液总黄酮质量浓度0.32 mg/mL、上样体积80 mL,进行动态吸附,树脂对叶和茎的总黄酮吸附量分别达到12.50 mg/g和14.30 mg/g。吸附平衡后,以40 mL 60%乙醇溶液1.5 mL/min的流速进行动态洗脱,树脂对叶和茎的总黄酮解吸率分别可达75.28%和70.28%,洗脱峰相对集中、对称,无拖尾现象。经AB-8大孔树脂纯化后,叶的总黄酮含量约为纯化前的1.4 倍,茎的总黄酮含量约为纯化前的2.4 倍,叶和茎的的ABTS+·清除能力分别为纯化前的1.7 倍和2.5 倍,DPPH自由基清除能力分别为纯化前的1.7 倍和2.6 倍。说明AB-8大孔吸附树脂对黑果悬钩子总黄酮成分具有较好的吸附、富集作用,适用于黑果悬钩子总黄酮的分离纯化。
[1] 张彦福. 新疆植物志[M]. 第二卷第二分册, 乌鲁木齐: 新疆科技卫生出版社, 1995: 242-243.
[2] 地达尔·巴合提坚, 木拉提·克扎衣别克, 卡母西别克·努尔哈买提. 哈萨克医常用的几种植物药及其应用[J]. 中国民族医药杂志,2012(5): 28-32.
[3] 孟祥娟, 刘斌, 热增才旦, 等. 悬钩子属植物化学成分及药理活性研究进展[J]. 天然产物研究与开发, 2011, 23(4): 767-775; 778.
[4] SARIBURUN E, ŞAHIN S, DEMIR C, et al. Phenolic content and antioxidant activity of raspberry and blackberry cultivars[J]. Journal of Food Science, 2010, 75(4): 328-335.
[5] CHEN Liang, XIU Lanxin, ZHANG Hucheng, et al. Phytochemical properties and antioxidant capacities of commercial raspberry varieties[J]. Journal of Functional Foods, 2013, 5(1): 508-515.
[6] 王宝珍, 解红霞. 悬钩子属植物化学成分和药理作用研究新进展[J].中南药学, 2014, 12(5): 466-469.
[7] GUDEJ J, TOMCZYK M. Determination of fl avonoidss, tannins and ellagic acid in leaves from Rubus L. species[J]. Archives of Pharmacal Research, 2004, 27: 1114-1119.
[8] NOVRUZOV E N, SHAMSI-ZADE L A. Chemical composition of the fruit of Rubus caesius L. growing in the Azerbaijan SSR[J]. Rastitel'nye Resursy, 1983, 19: 66-70.
[9] DUDZINSKA D, LUAK B, BONCLER M, et al. CD39/NTPDase-1 expression and activity in human umbilical vein endothelial cells are differentially regulated by leaf extracts from Rubus caesius and Rubus idaeus[J]. Cellular and Molecular Biology Letters, 2014,19(3): 361-380.
[10] 蒲凌云. 红三叶草总异黄酮提取、纯化工艺研究及初 步工业设计[D].兰州: 兰州理工大学, 2012: 11-39.
[11] 何书美, 刘敬兰. 茶叶中总黄酮含量测定方法的研究[J]. 分析化学,2007, 35(9): 1365-1368.
[12] LIU Lixiang, SUN Yi, LAUR T, et al. Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C. J. Tseng[J]. Food Chemistry, 2009, 112(1): 35-41.
[13] 杨少辉, 宋英今, 王洁华, 等. 雪莲果体外抗氧化和自由基清除能力[J].食品科学, 2010, 31(17): 166-169.
[14] OZGEN M, REESE R N, TULIO A Z, et al. Modifi ed 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (ABTS) method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power (FRAP) and 2,2'-diphenyl-1-picrylhydrazyl (DPPH) methods[J]. Journal of Agricultural and Food Chemistry, 2006, 54(4): 1151-1157.
[15] 陈虎, 蒲俊松, 向仲怀, 等. 药桑葚总黄酮的提取工艺及其抗氧化活性分析[J]. 食品科学, 2014, 35(12): 7-12. doi: 10.7506/spkx1002-6630-201412002.
[16] 田国政, 何义发. 薇菜叶总黄酮提取工艺条件优化[J]. 食品科学,2010, 31(22): 283-285.
[17] 孙京沙, 张朝辉. 大叶藻总黄酮的大孔树脂纯化工艺[J]. 食品科学,2014, 35(14): 5-10. doi: 10.7506/spkx1002-6630-201414002.
[18] 陶莎, 黄英, 康玉凡, 等. 大孔吸附树脂分离纯化红小豆多酚工艺及效果[J]. 农业工程学报, 2013, 29(23): 276-285.
[19] 李淑珍, 李进, 杨志江, 等. 大孔树脂分离纯化黑果枸杞总黄酮的研究[J]. 食品科学, 2009, 30(1): 19-24.
[20] 杨昱, 徐雅琴, 于泽源. 树莓叶片黄酮成分分离纯化研究[J]. 高校化学工程学报, 2011(6): 948-954.
[21] 周鸣谦, 刘云鹤, 夏久云. 均匀试验设计优化黑莓叶黄酮的提取及组分分析[J]. 食品科学, 2013, 34(16): 129-133. doi: 10.7506/ spkx1002-6630-201316026.
[22] 史云东, 贾琳, 张霁, 等. 不同地区灯盏花总黄酮与野黄芩苷含量比较[J]. 安徽农业科学, 2011, 39(4): 2102; 2112.
Extraction, Purification and Antioxidant Activity of Total Flavonoids from the Leaves and Stems of Rubus caesius L.
GUO Han, GE Juan, LI Xin, Gulimire·ALIMU, HE Dajun*
(College of Life Science, Shihezi University, Shihezi 832000, China)
The extraction of flavonoids from the leaves and stems of Rubus caesius L. was optimized by single factor experiments and an orthogonal array design. Antioxidant activity of flavonoids extracts was determined by 2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate) (ABTS), 1,1-diphenyl-2-picrylhydrazyl (DPPH) radical scavenging assays. The optimal extraction conditions for total flavonoids were determined as follows: 80 ℃, 70 min, and 60% ethanol as the extraction solvent with a solid- to-liquid ratio of 1:90 (g/mL). By comparing the adsorption and separation efficiencies of flavonoids with 14 different macroporous resins, AB-8 resin was selected as the most efficient adsorbent as it had the best adsorption and desorption capa city for flavonoids from R. caesius L. By single factor experiments, the optimal purification conditions for crude flavonoids from R. caesius L. leaves and stems were established as follows: sample loading flow rate, 1 mL/min;flavonoids concentration of sample, 0.32 mg/mL; sample volume, 80 mL; desorption solvent, 40 mL of 60% ethanol; and desorption flow rate, 1.5 mL/min. After being separated and purified by AB-8 resin, both total flavonoids content and total antioxidant capacity were significantly improved. The total flavonoids contents from leaves and stems were increased by 1.4 and 2.4 times, the ABTS radical scavenging rates by 1.7 and 2.5 times, and the DPPH radical scavenging rates by 1.7 and 2.6 times, respectively. These results demonstrate that the leaves and stems of R. caesius L. have high flavonoids contents and antioxidant activity, and can be potential sources of natural antioxidants.
Rubus caesius L.; fl avonoids; extraction and purifi cation; antioxidant activity
Q946.8
A
1002-6630(2015)14-0010-07
10.7506/spkx1002-6630-201514003
2014-12-23
国家自然科学基金青年科学基金项目(31200259);石河子大学高层次人才科研启动项目(RCZX2011011)
郭寒(1990—),女,硕士研究生,研究方向为植物化学。E-mail:guohan525@126.com
何大俊(1980—),男,副教授,博士,研究方向为植物化学。E-mail:hedajunww@163.com
