牦牛肌原纤维蛋白与热改性大豆分离蛋白共凝胶条件的优化
2015-10-14孔杭如唐善虎闫利国李思宁
孔杭如,孙 莎,唐善虎,闫利国,李思宁,王 柳
(西南民族大学生命科学与技术学院,四川 成都 610041)
牦牛肌原纤维蛋白与热改性大豆分离蛋白共凝胶条件的优化
孔杭如,孙莎,唐善虎*,闫利国,李思宁,王柳
(西南民族大学生命科学与技术学院,四川 成都 610041)
牦牛肉是纯天然食品原料,然而牦牛肉蛋白资源的开发利用不够,特别是利用质构重组技术将牦牛肉中的肌原纤维蛋白和大豆分离蛋白用于开发凝胶产品鲜见研究报道。本研究以牦牛肌原纤维蛋白(myofi brillar protein isolate,MPI)与热改性大豆分离蛋白(soybean protein isolate,SPI)为原料,分别采用单因素试验和正交试验设计,研究SPI-MPI溶液体积比、SPI热改性温度、离子强度和转谷氨酰胺酶(TGase)用量对共凝胶硬度、弹性和持水性的影响。单因素试验结果表明:改变4 个因素条件均能显著地提高热改性SPI-MPI溶液的凝胶性能,各因素对共凝胶特性综合指标影响的主次顺序为SPI-MPI溶液体积比>TG用量>离子强度>SPI热改性温度。正交试验结果表明形成共凝胶的最优条件是:SPI-MPI溶液体积比1∶9、SPI热改性温度100 ℃、TG用量50 U/g、不添加镁离子。
大豆分离蛋白;牦牛;肌原纤维蛋白;凝胶
牦牛肉蛋白质含量高(21%~22%),脂肪含量低(2%~3%),并含有丰富的必需氨基酸、多种多不饱和脂肪酸和维生素,是营养丰富的肉中精品。牦牛肉也因为具有绿色天然、高蛋白、低脂肪等优点,能够独立占有市场,并成为消费者真正意义上优质的肉食品[1]。然而,有关牦牛肉蛋白资源的利用和开发的研究几乎未见报道,特别是缺少利用质构重组技术研发新型牦牛肉蛋白产品研究。大豆分离蛋白(soybean protein isolate,SPI)具有特殊的功能特性和较高的营养价值,在肉制品加工中可作为功能成分添加到碎肉制品和乳化肉制品中[2]。Matulis等[3]曾报道,在frankfurter香肠中添加3% SPI替代肉蛋白可以增加肌肉凝胶的硬度。研究[4]表明,SPI的凝胶性与其结构有密切的关系,热处理能使蛋白质分子变性和聚集,在合适的蛋白质质量浓度条件下,会形成自我支撑的凝胶。由于SPI对改善肉制品色、香、味、组织结构及营养价值等品质具有重要的作用,通过在牦牛肉蛋白中合理添加SPI,有可能获得低成本、高品质和营养平衡的牦牛肉制品。
那治国等[5]利用热改性大豆分离蛋白和去酰胺改性大豆分离蛋白研究了猪肌肉盐溶蛋白共凝胶特性的影响,发现热改性大豆分离蛋白的添加对共凝胶的形成具有一定的抑制作用,而去酰胺改性大豆分离蛋白的添加能够提高共凝胶的硬度。也有研究[6]表明,大豆分离蛋白经过热变性后大大提高了肌纤维蛋白凝胶的强度和弹性,而未经加热的大豆分离蛋白却对凝胶起到负面作用。欧阳艳华等[7]研究了鸡肉肌原纤维蛋白(myofi brillar protein isolate,MPI)和SPI在转谷氨酰胺酶(transglutaminase,TG)催化条件下的相互作用及经酶改性后的蛋白质的凝胶性和乳化性,结果表明:酶能催化鸡肉蛋白和大豆蛋白发生共价交联反应,能明显改善MPI-SPI混合蛋白的凝胶性和乳化性。彭增起等[8]研究了Mg2+作用下鸡腿肉凝胶的保水性,发现Mg2+对改善凝胶的保水性有较大的影响。目前为止,尚未见有将牦牛肉中的肌原纤维蛋白和大豆分离蛋白用于开发凝胶产品的报道。本研究旨在以牦牛肉和大豆分离蛋白为原料,通过研究不同因素对热改性SPI与牦牛肉MPI共凝胶的影响,确定SPI与MPI成胶的最佳条件,为开发新型牦牛肉蛋白产品提供基础的理论依据。
1 材料与方法
1.1材料与试剂
选取自然放牧状态下,健康无病的3 岁龄牦牛,屠宰后现场采集背最长肌,装入洁净保鲜袋中密封,放入-18 ℃冰箱急冻2 h,在0~4 ℃条件下运往实验室,冻藏。
SPI(蛋白质含量为87.6%) 郑州诚旺化工食品添加剂有限公司;乙二胺四乙酸二钠、氯化镁、磷酸氢二钠、硫酸铜、硫酸钾、氢氧化钠、硼酸、浓盐酸(均为分析纯) 成都苌钲化玻试剂有限公司;TG(活力80 U/g) 泰兴市东圣食品科技有限公司。
1.2仪器与设备
TA-XT plus质构仪 英国Stable Micro System公司;BCD-221TMBA冰箱 青岛海尔股份有限公司;Centrifuge 5804R高速冷冻离心机 德国Eppendorf公司;FSH-2A可调高速组织匀浆机 金坛市华城海龙实验仪器厂;PL303分析天平 梅特勒-托利多国际股份有限公司;MP511 Lab pH计 上海三信仪表厂;Scino DT208消化单元、Kjeltec 2200自动凯氏定氮仪 瑞士Foss公司;HH-6数显恒温水浴锅 常州国华电器有限公司。
1.3方法
1.3.1牦牛肉中MPI的提取
MPI是肌肉中最重要的蛋白,占肌肉蛋白质总量的40%~60%[9-10]。牦牛肉中MPI提取参照Xiong等[11]方法并略作修改。取冻藏牦牛肉(背最长肌)300 g,室温经过6 h自然解冻,剔除脂肪和结缔组织,切成2 mm大小的肉粒,加入4 倍体积的磷酸缓冲溶液(0.1 mol/L NaCl、5 mmol/L EDTA、0.05 mol/L Na2HPO4,pH 7.0),在高速组织匀浆机里高速匀浆60 s,2 000×g、4 ℃离心15 min,倒掉上清液,取沉淀,重复3 次。将经过3 次提取的沉淀与4 倍体积的0.1 mol/L NaCl溶液混合,高速匀浆30 s,2 000×g、4 ℃离心15 min,倒掉上清液,将沉淀与8 倍体积的0.1 mol/L NaCl混合匀浆,四层纱布过滤,调整滤液的pH值为6.25,在4 ℃使用2 000×g离心15 min,弃去上清液,即为MPI。最后得到的蛋白膏保存于冰盒中备用,保存24 h。采用凯氏定氮法测得MPI含量为12%,提取流程见图1。

图1 牦牛肉MPI提取流程Fig.1 Extraction procedure for myofibrillar protein from yak meat
1.3.2SPI的热改性
将SPI溶于蒸馏水中,制备成4%(m/m,pH 7.0)的SPI溶液,加热,待中心温度分别升至80、90、100 ℃时,保温5 min后冷却至室温,备用。
1.3.3凝胶的制备
将牦牛MPI与缓冲溶液混合,采用稀释的方法和凯氏定氮的方法调整蛋白质质量分数约4%、Na2HPO4浓度50 mmol/L、NaCl浓度0.6 mol/L、pH 5.6。将配制好的牦牛MPI溶液与热改性SPI溶液按照正交设计表进行不同体积比混合,将混合溶液倒入内径2 cm、高5 cm的玻璃管中,使液面高度为25 mm,加入MgCl2溶液以及TG。将蛋白溶液放入4 ℃冰箱2 h,然后取出振荡除去气泡,20 ℃水浴锅中加热,以1.5 ℃/min的速率升温,待玻璃管内中心温度为80 ℃时停止加热,迅速置于冰浴中冷却到4 ℃,在4 ℃冰箱中存放12 h,使用前将凝胶试样取出,25 ℃放置1 h,待测。
1.3.4单因素试验
1.3.4.1SPI-MPI溶液体积比对凝胶特性的影响
将MPI溶液与SPI溶液按体积比9∶1、8∶2、7∶3、6∶4、5∶5、4∶6、3∶7、2∶8的比例混合成总粗蛋白含量为4%的混合蛋白溶液,且设置对照组,对照组均为牦牛MPI溶液,调节pH值为6.0,在20 ℃水浴中平衡10 min,以1.5~2 ℃/min的速率加热至80 ℃,保持20 min,取出冰浴冷却,然后在4 ℃放置过夜,每组设置3 个重复。分别测定凝胶的硬度、弹性及持水性并求出平均值。
1.3.4.2SPI热改性温度对凝胶特性的影响
将SPI溶液分别加热到50、60、70、80、90、100 ℃,与MPI溶液以2∶8的体积比混合成总粗蛋白含量为4%的混合蛋白溶液,调节pH值为6.0,在20 ℃水浴中平衡10 min,以1.5~2 ℃/min的速率加热至80 ℃,保持20 min,取出冰浴冷却,然后在4 ℃放置过夜,每组设置3个重复。分别测定凝胶的硬度、弹性及持水性并求出平均值。
1.3.4.3离子强度对凝胶特性的影响
将热改性温度为90 ℃的SPI溶液与MPI溶液以2∶8的体积比混合成总粗蛋白含量为4%的混合蛋白溶液,依次加入0.01、0.03、0.05、0.07、0.09 mol/L氯化镁溶液,调节pH值为6.0,在20 ℃水浴中平衡10 min,以1.5~2 ℃/min的速率加热至80 ℃,保持20 min,取出冰浴冷却,然后在4 ℃放置过夜,每组设置3 个重复。分别测定凝胶的硬度、弹性及持水性并求出平均值。
1.3.4.4TG用量对凝胶特性的影响
将热改性温度为90 ℃的SPI溶液与MPI溶液以2∶8的比例混合成总粗蛋白含量为4%的混合蛋白溶液,依次加入TG 0、10、30、50、70、90 U/g,调节pH值为6.0,在20 ℃水浴中平衡10 min,以1.5~2 ℃/min的速率加热至80 ℃,保持20 min,取出冰浴冷却,然后在4 ℃放置过夜,每组设置3个重复。分别测定凝胶的硬度、弹性及持水性并求出平均值。
1.3.5各因素对凝胶特性影响的正交试验
根据贺江航[12]、王苑[13]等研究结论及单因素试验结果,选取对凝胶形成影响较大的因素:SPI-MPI溶液体积比、SPI热改性温度、离子强度和TG添加量,选用L9(34)正交试验设计,研究这4 个因素对共凝胶体系凝胶的硬度、弹性及持水性的影响。正交试验因素水平设置见表1。
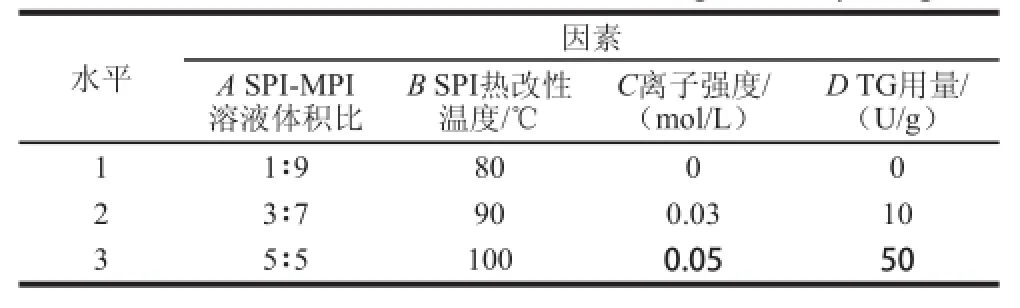
表1 正交试验因素与水平表Tab1el Factors and coded levels for orthogonal array design
1.3.6蛋白凝胶指标的测定
1.3.6.1蛋白凝胶硬度和弹性的测定
凝胶硬度和弹性测定方法参照Xiong等[14]的方法。将凝胶从冰箱中取出,室温条件下放置1 h,将待测样品置于测定平台上固定好,室温条件下使用TA-XT plus质构仪测定制备的蛋白凝胶。以质构剖面分析(texture profi le analyser,TPA)方法测定凝胶的硬度和弹性。
质构仪主要参数:探头类型为P/0.5,物性仪重力传感器选择5 kg,测前速率2.0 mm/s,测定速率1 mm/s,测定距离5.0 mm,测后速率2.0 mm/s,触发类型为自动,触发力5 g,数据采集率200 pps。
1.3.6.2蛋白凝胶持水性的测定
将4 ℃过夜后的凝胶(约5 g,M1)移至50 mL的离心管中并记总质量(M2),离心(10 000×g,15 min,4 ℃)。倒掉离出的水,将含有样品的离心管倒置于铺有吸水纸巾的桌面上,15 min后称质量(M3)[15]。蛋白凝胶持水性计算公式如下:

1.4数据处理
所有实验处理均设置至少3 次重复,数据经PASW Statistics 18软件进行方差分析,并用Duncan法进行多重比较分析。
2 结果与分析
2.1单因素试验结果
2.1.1SPI-MPI溶液体积比对共凝胶硬度、弹性及持水性的影响
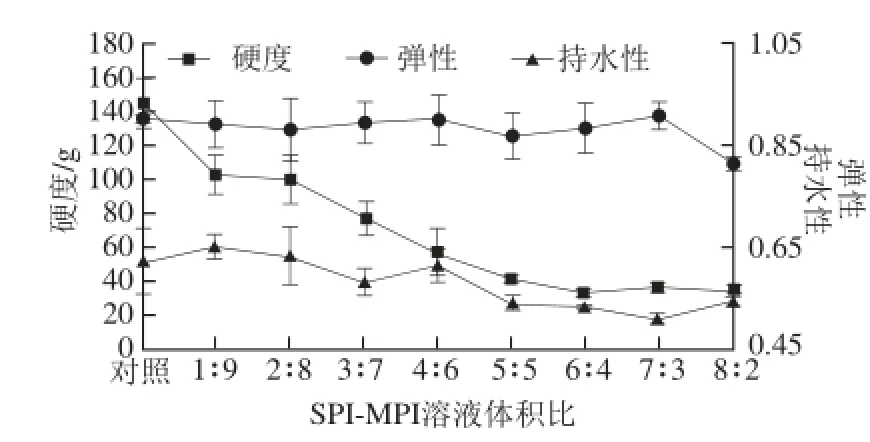
图2 蛋白混合比例对共凝胶硬度、弹性及持水性的影响Fig.2 Effects of SPI/MPI ratio on the hardness, springiness and water-holding capacity of SPI-MPI gel
由图2可知,随着SPI-MPI溶液中SPI比例的增大,共凝胶的硬度呈下降趋势;SPI-MPI共凝胶的弹性呈先下降后上升再下降再上升再下降的趋势;SPI-MPI共凝胶的持水性呈先上升后下降再上升再下降再上升的趋势。由显著性分析可知,改变SPI-MPI溶液混合蛋白的比例对共凝胶的硬度弹性及持水性有不同程度的影响:对共凝胶的硬度及持水性有显著的影响(P<0.05),对共凝胶的弹性影响较小(P>0.05)。
2.1.2TG用量对共凝胶硬度、弹性及持水性的影响
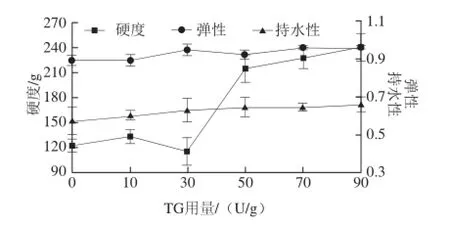
图3 TG用量对共凝胶硬度、弹性及持水性的影响Fig.3 Effects of TGase concentration on the hardness, springiness and water-holding capacity of SPI-MPI gel
由图3可知,随着TG用量的增大,SPI-MPI共凝胶的硬度呈先上升后下降再上升的趋势;SPI-MPI共凝胶的弹性呈先上升后下降再上升的趋势,幅度不明显;SPI-MPI共凝胶的持水性呈一直缓慢上升的趋势。当TG用量为50 U/g时,SPI-MPI共凝胶的硬度具有突跃性的上升,之后趋于平缓。由方差分析可得,改变TG用量对共凝胶的硬度弹性及持水性有不同程度的影响:对SPI-MPI共凝胶的硬度有显著的影响(P<0.05),对弹性及持水性的影响较小(P>0.05)。
2.1.3离子强度对凝胶硬度、弹性及持水性的影响

图4 离子强度对凝胶硬度、弹性及持水性的影响Fig.4 Effects of ion concentration on the hardness,springiness and water-holding capacity of SPI-MPI gel
由图4可知,随着离子强度的升高,SPI-MPI共凝胶的硬度呈先上升再下降再上升再下降的趋势;SPI-MPI共凝胶的弹性呈先上升后下降,最后趋于平缓的趋势;SPI-MPI共凝胶的持水性呈先上升再下降再上升再下降的趋势。当离子强度是0.07 mol/L时,SPI-MPI共凝胶的硬度达到最大值,为90.332g。当离子强度是0.03mol/L时,SPI-MPI共凝胶的弹性及持水性达到最大值,分别为1.067、0.590。分析图4可得,改变离子强度对SPI-MPI共凝胶的硬度及弹性有显著的影响(P<0.05),对持水性的影响较小(P>0.05)。
2.1.4SPI热改性温度对凝胶硬度、弹性及持水性的影响

图5 SPI热改性温度对凝胶硬度、弹性及持水性的影响Fig.5 Effects of SPI heating temperature on the hardness springiness and water-holding capacity of SPI-MPI gel
由图5可知,随着SPI热改性温度的升高,SPI-MPI共凝胶的硬度呈先上升再下降再上升再下降的趋势;SPIMPI共凝胶的弹性呈先下降再上升再下降的趋势;SPIMPI共凝胶的持水性呈先下降再上升再下降再上升的趋势。当SPI热改性温度为60 ℃时,共凝胶的硬度和弹性达到最大值,分别为88.419g、0.948。分析图5可得,改变SPI热改性温度对SPI-MPI共凝胶的硬度弹性及持水性的影响其他3 个因素不显著(P>0.05)。
2.2共凝胶形成条件正交优化试验结果

表2 不同正交组合处理对凝胶硬度、弹性和持水性影响Table2 Orthogonal array design with experimental values of hardness, elasticity and water-holding capacityy
由表2极差分析可以看出,各因素对于硬度指标的影响顺序是A>D>C>B,弹性指标是D>B>C>A,持水性指标是A>C>D>B。凝胶硬度的最优组合为A1B3C3D3,弹性的最优组合为A1B3C2D1,持水性的最优组合为A1B1C1D3。
2.3正交试验各因素趋势图分析

图6 正交各因素趋势图Fig.6 Trend charts for the effects of four factors on gel hardness,water-holding capacity and springiness
由图6可知,在SPI-MPI溶液体积比为1∶9时,凝胶的硬度、弹性和持水性均为最大值,分别是139.071g、0.937、0.537。凝胶硬度和持水性的整体趋势是硬度不断下降,持水性不断下降。而弹性呈先下降后上升的趋势。综上分析,试验水平应选择SPI-MPI溶液体积比为1∶9,即A1。这与那治国等[5]报道的添加比例相同,可以看出MPI所占比例越大,越有助于凝胶的形成。
当SPI热改性温度为100 ℃时,凝胶的硬度和弹性达到最大值,分别为101.325g和0.961,且SPI热改性温度对凝胶的持水性有较大的影响。热改性温度对于持水性的影响不大,曲线变化幅度趋于平缓。综上所述,试验水平应选择SPI热改性温度为100 ℃,即B3。王苑[13]报道了类似的温度。
随着离子强度的增加,凝胶的持水性不断下降,硬度不断增大,弹性先上升后下降,当离子强度为0时,持水性最大,为0.515。当离子强度为0.03 mol/L时,硬度较大,弹性达到最大值,为0.942。但各水平之间相差不大,差异不显著(P>0.05)。综上所述,仅从此图分析可得,试验水平应选择离子强度为0,即C1。有报道[13]表明低浓度的MgCl2(0.01~0.02 mol/L)对混合凝胶有影响,降低了凝胶的硬度,但是与未添加MgCl2的混合蛋白凝胶无显著差异(P>0.05)。
当TG用量为50 U/g时,凝胶的硬度最大达到117.258g,与祖海珍等[16]研究的酶活浓度相差5 倍,这可能是由于各因素之间相互作用及样本测定方法不同导致的。当TG用量为10 U/g时,有最小值,但TG用量为50 U/g和0 U/g时的弹性区别不大。综上所述,为有良好的凝胶特性,应该选择试验的水平为50 U/g。当TG用量为50 U/g时,持水性最大,为0.500,与之前的研究的酶用量一致[16]。
2.4各因素水平多重比较分析结果
采用最小显著差数法对A、B、C、D单个因素条件下各水平进行多重比较分析,其结果见表3。

表3 同一因素各水平之间多重比较分析结果Table3 Multiple comparison analysis of each factor at different levels
硬度是凝胶能否形成的决定性因素,也是消费者最首先直观感受到的,因此,选择将凝胶硬度作为第一评价指标;弹性在凝胶中起重要的作用,是消费者重视的食用品质,将其作为第二评价指标。由表3中A因素3 个水平多重比较结果可知,随着SPI添加比例的增大,凝胶弹性降低,因为在相同蛋白质量分数条件下,SPI形成凝胶的能力远不如MPI的成胶能力。当混合蛋白体系中SPI添加量越多时,MPI也被稀释到越低的质量分数,削弱了成胶蛋白间的相互作用,所形成的凝胶网络结构强度越低[17];在相关水平之间,凝胶硬度、持水性存在显著差异(P<0.05),但A因素对凝胶弹性影响不显著,综合3 个评价指标,选择A1水平。
B因素对凝胶持水性影响不显著(P>0.05),随着热改性温度的升高,凝胶硬度增大,差异不显著(P>0.05),但100 ℃热改性温度的凝胶弹性显著增大(P<0.05)。这是因为大豆蛋白中的7S和11S的变性温度分别在75 ℃和90 ℃[18-19],而在100 ℃条件下,大豆蛋白已经发生变性,并且部分变性甚至完全变性的SPI能够参与到MPI的胶凝作用中,并对混合凝胶的弹性有显著影响|(P<0.05)。因此选择100 ℃热改性的SPI,即B3水平。
离子强度能够影响MPI的溶解能力,因此对凝胶特性有着重要的影响[20]添加MgCl2可以提高凝胶的硬度,且随着离子强度的增大凝胶硬度随之增大,但是差异并不显著(P>0.05),且不添加MgCl2的凝胶硬度在可接受范围之内。使用0.03 mol/L MgCl2提高了凝胶的弹性,0.05 mol/L MgCl2破坏了凝胶的弹性,它们之间差异不显著(P>0.05)。随着MgCl2浓度的升高,凝胶持水性下降,差异也不显著(P>0.05)。在高盐浓度条件下,Mg2+并没能显著改善混合凝胶的相关特性,可能是由于电负性过强,导致蛋白质之间盐桥的形成,降低了蛋白质之间的相互作用[21]。综合考虑MgCl2对凝胶硬度、弹性及持水性的影响,选择在凝胶中不添加MgCl2。
TG促进肽内或肽之间的肽键形成,催化蛋白的交链形成网状结构[22]。Dondero等[23]指出添加质量分数0.5%TG的牛肉蛋白,在经2 h、60 ℃加热后,其凝胶抗断裂强度比对照组高88%。在试验水平范围内,随着TG用量的增加凝胶硬度和持水性上升,但当TG用量为10 U/g时,凝胶弹性明显下降(P<0.05);当TG用量为50 U/g时,弹性又上升。江波等[24]证明了TG可催化肌球蛋白分子和大豆蛋白分子之间的共价交联,增加蛋白质凝胶结构的强度。由于TG是产生黏着的混合凝胶结构的较好的添加剂[25],结合硬度指标,TG的添加量选择D3水平。
综合凝胶形成最佳条件及经济效益考虑:牦牛MPI与热改性SPI共凝胶的最优条件组合为A1B3C1D3,即热改性SPI溶液与牦牛MPI溶液体积比1∶9、SPI热改性温度100 ℃、不添加Mg2+、TG用量50 U/g。
3 结 论
本实验研究SPI-MPI溶液体积比、SPI热改性温度、离子强度以及TG用量这4 个因素对SPI-MPI溶液形成共凝胶的影响,各因素对共凝胶特性综合指标影响的主次顺序为热改性SPI-MPI溶液体积比>TG用量>离子强度>SPI热改性温度。综合分析试验结果可知,热改性SPI与牦牛MPI共凝胶的最优组合为A1B3C1D3,即热改性SPI溶液与牦牛MPI溶液体积比1∶9、SPI热改性温度100 ℃、Mg2+添加量0、TG用量50 U/g。
[1] 王喜群, 王明金. 牦牛肉营养成分分析与研究[J]. 肉类研究, 2006,20(5): 24-26.
[2] GARCIA M C, TORRE M, MARINA M L, et al. Compositions andcharacterization of soybean and related products[J]. Critical Reviews in Food Science and Nutrition, 1997, 37(4): 361-391.
[3] MATULIS R J, MCKEITH F K. Sensory characteristics of frankfurters as affected by salt, fat, soy protein, and carrageenan[J]. Journal of Food Science, 1995, 60(1): 48-54.
[4] NIEUWENHUYZEN W V. lecithin production and properties[J]. Journal of the American Oil Chemists' Society, 1976, 53(6): 425-427.
[5] 那治国, 马永强, 韩春然, 等. 猪肌肉盐溶蛋白与大豆分离蛋白共凝胶特性的研究[J]. 食品科学, 2009, 30(19): 138-142.
[6] FENG J, XIONG Y L. Interaction of myofi brillar and preheated soy proteins[J]. Journal of Food Science, 2002, 67: 2851-2856.
[7] 欧阳艳华, 汪少芸, 周红, 等. 鸡肉蛋白和大豆蛋白的相互作用和机理研究[J]. 中国食品学报, 2011, 11(4): 90-95.
[8] 彭增起. 肌肉盐溶蛋白质溶解性和凝胶特性研究[D]. 南京: 南京农业大学, 2005.
[9] 赵晋府. 食品工艺学[M]. 北京: 中国轻工业出版社, 2013: 40-41.
[10] FOEGEDING E A, DAYTON W R, ALLENC A. Evaluation of moleeular interactions in myosin, fi brinogen and myosin fi brinogen gels[J]. Journal of Agricultural and Food Chemistry, 1987, 35: 559-563.
[11] XIONG Y L, BREKKE C J. Changes in protein solubility and gelation properties of chicken myofibrils during storage[J]. Journal of Food Science, 1989, 54(5): 1141-1146.
[12] 贺江航, 吕峰, 黄金燕. TG催化鱼肉蛋白共价交联作用研究[J]. 徐州工程学院学报, 2012, 27(2): 50-56.
[13] 王苑. 不同处理方式对肌原纤维蛋白和大豆分离蛋白混合凝胶特性的影响[D]. 南京: 南京农业大学, 2007.
[14] XIONG Y L, BLANCHARD S P, OOIZUMI T, et al. Hydroxyl radical and ferryl-generating systems promote gel network formation of myofi brillar protein[J]. Journal of Food Science, 2010, 75: C215-C221.
[15] XIONG Y L, BLANCHARD S P, MEANS W J. Properties of broiler myofibril gels containing emulsified lipids[J]. Journal of Poultry Science, 1992, 71: 1548-1555.
[16] 祖海珍, 徐幸莲. 转谷氨酸胺酶对大豆分离蛋白和肌原纤维混合蛋白成胶性的影响[D]. 南京: 南京农业大学, 2005.
[17] 简华君. 大豆分离蛋白对肌原纤维蛋白凝胶性质的影响[D]. 无锡:江南大学, 2009.
[18] 汪建斌, 邓勇. Alcalase碱性蛋白酶对大豆分离蛋白水解作用的研究[J].食品工业科技, 2002, 23(1): 61-63.
[19] DINKAR D, ARUM K. Enhancing the functionality of food proteins by enzymatic modifi cation[J]. Journal of Trends in Food Science and Technology, 1996, 7(4): 120-125.
[20] 郭世良, 赵改名, 王玉芬, 等. 离子强度和pH值对肌原纤维蛋白热诱导凝胶特性的影响[J]. 食品科技, 2008, 33(1): 84-87.
[21] 李继红. 不同种类肉盐溶蛋白凝胶特性的研究[D]. 保定: 河北农业大学, 2004.
[22] SAREEVORAVITKUL R, SIMPSON B K, RAMASWAMY H S. Comparative properties of bluefi sh (Pomatomus saltatrix) gels formulated by high hydrostatic pressure and heat[J]. Journal of Aquatic Food Product Technology, 1996(5): 65-79.
[23] DONDERO M, FIGUEROA V, MORALES X, et al. Transglutaminase effects on gelation capacity of thermally induced beef protein gels[J]. Food Chemistry, 2006, 99(3): 546-554.
[24] 江波, 周红霞. 转谷氨酞胺酶对大豆7S蛋白质及肌球蛋白质胶凝性质的影响[J]. 无锡轻工业大学学报, 2001, 20(2): 122-127.
[25] RAMIREZ J C, XIONG Y L. Effect of transglutaminase-induced cross-linking on gelation of myofi brillar/soy protein mixtures[J]. Meat Science, 2003, 63: 899-907.
Optimization of Co-Gelation Conditions of Yak Myofibrillar Protein and Heat Modified Soy Protein Isolate
KONG Hangru, SUN Sha, TANG Shanhu*, YAN Liguo, LI Sining, WANG Liu
(College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, China)
Yak meat has not yet been fully exploited as an excellent source of natural protein, especially yak myofi brillar the combined application of which with soy protein isolate (SPI) in gel products by texture and structure recombination has not yet been reported. The objectives of this study were to investigate the effects of myofi brillar protein isolate (MPI)/SPI ratio, heating temperature of SPI, ion concentration, and transglutaminase (TGase) concentration on co-gelation properties and consequently to obtain the optimized gelation conditions for MPI and SPI. All the four factors had a significant positive on gelation properties of thermally modifi ed SPI and MPI in the decreasing order of SPI/MPI ratio (by volume) >TG concentration > ion concentration > heating temperature of SPI. Using an orthogonal array design, the optimal cogelation conditions were determined as follows: SPI/MPI ratio, 1:9; heat modifi cation temperature for SPI, 100 ℃; TGase concentration, 50 U/g; and no added magnesium.
soy protein isolate; yak; myofi brillar protein; gel
TS251.1
A
1002-6630(2015)14-0044-06
10.7506/spkx1002-6630-201514009
2014-11-26
四川省重大科技专项(2012NZ0047);四川省科技支撑计划项目(2014NZ0052)
孔杭如(1995—),女,本科生,研究方向为食品科学。E-mail:konghangru@sina.cn
唐善虎(1964—),男,教授,博士,研究方向为食品科学和食品安全。E-mail:stang01@126.com
