miR-34a通过靶向抗凋亡基因Survivin抑制皮肤鳞状细胞癌增殖的研究
2015-10-14施学清
施学清
(大连市第二人民医院 皮肤科,辽宁 大连 116011)
论 著
miR-34a通过靶向抗凋亡基因Survivin抑制皮肤鳞状细胞癌增殖的研究
施学清
(大连市第二人民医院 皮肤科,辽宁 大连 116011)
目的 研究miR-34a在皮肤鳞状细胞癌(SCC)中的表达及对肿瘤细胞增殖、抗凋亡的调控作用及机制。方法 采用实时定量PCR检测46例SCC病人肿瘤组织及15例正常皮肤组织中miR-34a及Survivin的表达;将miR-34a mimic转染进皮肤鳞状细胞癌A431细胞系,探讨miR-34a对SCC细胞增殖、Survivin表达的影响;评估miR-34a及Survivin表达对SCC预后的生物诊断价值。 结果 (1)低分化SCC患者miR-34a显著低于高分化组,而Survivin则显著高于高分化组(P均<0.05)。与正常皮肤比较,SCC病人的miR-34a显著降低,而Survivin表达则显著提高,P值分别为0.0013及<0.0001,差异均有极显著性意义。(2)与未转染组相比,miR-34a mimic可以显著抑制A431细胞增殖(P<0.05);同时显著降低Survivin蛋白表达(P<0.01)。(3)高miR-34a表达的SCC患者生存率显著高于低表达者,P=0.020567;高Survivin表达的SCC患者生存率则显著低于高表达者,P=0.008198。 结论 miR-34a可通过对Survivin表达调控影响SCC细胞增殖,同时它也可作为一个很好的生物学诊断指标为评估SCC病人预后提供参考。
皮肤鳞状细胞癌;miR-34a;Survivin;增殖
在中国,每年约有250万人罹患皮肤鳞状细胞癌(squamous cell carcinoma, SCC),其发病率呈现逐渐上升的趋势[1-3],是导致非黑色素瘤皮肤癌患者死亡的主要病因。SCC侵袭力高,易发生转移与复发,远期预后差[1-2]。因此,探索皮肤鳞状细胞癌的发生机制,寻找其发生、发展过程中关键调控因子可以为SCC的分子治疗奠定基础。
MicroRNA(miRNA)是一类高度保守,长度约为22~25nt小非编码RNA,通过对靶基因表达进行调控,在作发育、细胞增殖、分化、凋亡以及代谢等方面均发挥重要作用[4-6]。Survivin 基因是近年新发现的凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族成员之一,可以抑制细胞凋亡、促进细胞增殖,其与肿瘤的发生、发展有密切关系。Survivin在人类肿瘤及胚胎组织中呈高表达,但在成人的正常组织中则很少表达[7-8]。
miR-34家族包括3个主要成员,miR-34a、miR-34b和miR-34c。基因表达谱已证实在肿瘤细胞中miR-34a表达下调[9]。研究发现,miR-34a能够降低肺癌细胞中的Survivin启动子活性。此外,在恶性黑色素瘤细胞中也被证实能够抑制Survivin表达并且降低促分裂原活化蛋白激酶活性[10]。目前关于miR-34a通过Survivin表达调控在SCC发病机制中的作用还未见报道。本文旨在探索miR-34a在SCC组织及A431细胞系中的表达,及miR-34a影响SCC细胞增殖的可能机制。
1 材料和方法
1.1 材 料
DMEM培养基为Gibco公司产品;Lipofectamine 2000(Invitrogen,德国);miR-34a mimic(上海吉玛制药技术有限公司合成,上海,中国);CellTiter 96®AQueous非放射性细胞增殖分析试剂盒(Cat.No.P9625; Promega Co.,美国);TRIzol(Invitrogen, Karlsruhe, 德国);TaqMan MicroRNA反转录试剂盒(Applied Biosystems, Foster City CA, 美国);兔抗人Survivin抗体(Abcam, Cambridge, 英国);山羊抗兔抗体(Sigma-Aldrich,Saint Louis,MO,美国);β-actin(Santa Cruz Biotechnology,Santa Cruz,CA,美国);Mx3000P QPCR系统(美国)。
1.2 实验方法
1.2.1 病例资料:46例皮肤鳞癌患者均来自2009—2013年间大连市第二人民医院皮肤及普外科,经病理活组织检查证实为皮肤鳞状细胞癌,其中男性26例,女性20例;年龄32~75岁,平均年龄53岁;病程2个月~10年,平均病程18.26个月;根据Border改良分级标准,I级22例,II级19例,III级5例,IV级0例。I、II级为高分化鳞癌,III、IV级为低分化鳞癌。全部病例术前均未接受任何抗癌治疗。另取15例正常组织做对照。对照组性别、年龄等与鳞癌患者差异无统计学意义。
1.2.2 细胞培养:皮肤鳞状细胞癌A431细胞株用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM高糖培养基于37 ℃,100%湿度,5%CO2孵箱单层传代培养。每隔48~72 h更换一次培养基。实验选用对数生长期的细胞(培养24h后)。
1.2.3 转染miR-34a mimic:将A431细胞铺于无抗生素的6孔培板皿中,细胞密度为2×105个/孔。24h后,利用Lipofectamine 2000将miR-34a mimic转染进A431细胞,转染浓度分别为60 nmol/L,80 nmol/L,100 nmol/L。miR-34a mimic的序列如下:5′-UGG CAG UGU CUU AGC UGG UUG U-3′及5′-ACA ACC AGC UAA GAC ACU GCC A-3′。其非特异性对照组(non-specific control, NC)的序列如下:5′-UUC UCC GAA CGU GUC ACG UTT-3′及5′-ACG UGA CAC GUU CGG AGA ATT-3′。转染48 h后,收集细胞进行后续分析。
1.2.4 四唑化合物(MTS)分析:将A431细胞以1×103个/孔的密度种于96孔板中,待转染miR-34a mimic及NC 48 h后,利用CellTiter 96®AQueous非放射性细胞增殖分析试剂盒分析细胞增殖活性。向每孔含有100 μL培养基的96孔板中加入20 μL的MTS与电子偶联剂(PMS)混合溶液,放入37 ℃加湿的含5%CO2孵箱中孵育1 h,然后利用酶标仪(PowerWavex 340,Instruments有限公司,美国)读取490 nm的吸光度。
1.2.5 总RNA提取及实时定量及半定量RT-PCR:组织、A431细胞及分别转染NC序列和100 mol/L miR-34a mimic的A431细胞的总RNA提取,按TRIzol试剂说明书操作。实时定量RT-PCR检测miR-34a及Survivin表达。RT采用TaqMan MicroRNA反转录试剂盒,PCR采用ABI miRNA特殊引物试剂盒并通过Mx3000P(美国)QPCR系统来进行。U6 RNA作为内参。实时PCR反应条件:95℃ 15min,94℃ 15s 40个循环,55℃ 30 s,70 ℃ 30 s。产物通过SYBR-Green I进行检测。以比较Ct值[2-△ct]法检测miR-34a及Survivin实时PCR表达。各引物序列见表1。

表1 qPCR引物序列
1.2.6 Western blotting分析:在细胞和组织中加入蛋白裂解液(1 mL RIPA和10 μL PMSF),待完全裂解后,利用12%SDS-PAGE进行电泳分离蛋白(总蛋白上样量为40 μg),然后转移至聚偏二氟乙烯(PVDF)膜(Millipore公司,Bedford,MA,美国)。将膜放入封闭液(5%脱脂奶粉)中封闭2 h后,加入兔抗人Survivin抗体4℃过夜,再加入碱性磷酸酶偶联的山羊抗兔抗体室温孵育2 h,β-actin作为内参。
随访时间6~58个月。总生存期指从手术日期到最后一次随访或死亡的时间间隔(月),分别以患者miR-34a及Survivin mRNA表达均值作为分层依据,观察miR-34a及Survivin表达水平对皮肤鳞状细胞癌预后的评估价值。
1.3 统计学方法

2 结 果
2.1 SCC病人癌组织及正常皮肤组织中miR-34a及Survivin表达情况
结果显示不同年龄组(<60岁组及≥60岁组)SCC病人中,miR-34a及Survivin mRNA表达无明显差异。而根据改良的Border分级法,低分化SCC患者miR-34a显著低于高分化组,而Survivin则显著高于高分化组(P均<0.05)。与正常皮肤比较,SCC病人的miR-34a显著降低,而Survivin表达则显著提高,P值分别为0.0013及<0.0001,差异均有极显著性意义,见表2。
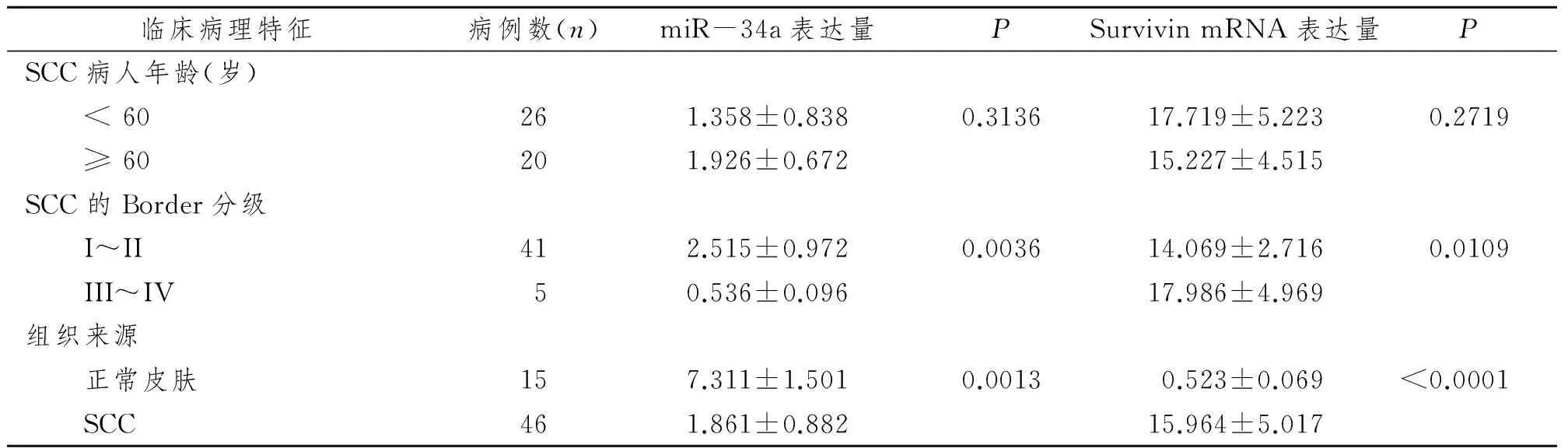
表2 SCC病人癌组织及正常皮肤组织中miR-34a及Survivin mRNA表达及临床病理特征
2.2 miR-34a转染对A431细胞增殖活性的影响
MTS检测发现,与未转染组(non-transfection,NT)及阴性对照组(NC)相比,miR-34a mimic转染后能够显著抑制A431细胞增殖活性,并且具有剂量依赖关系。NT与NC组间差异未见显著性意义。见图1。
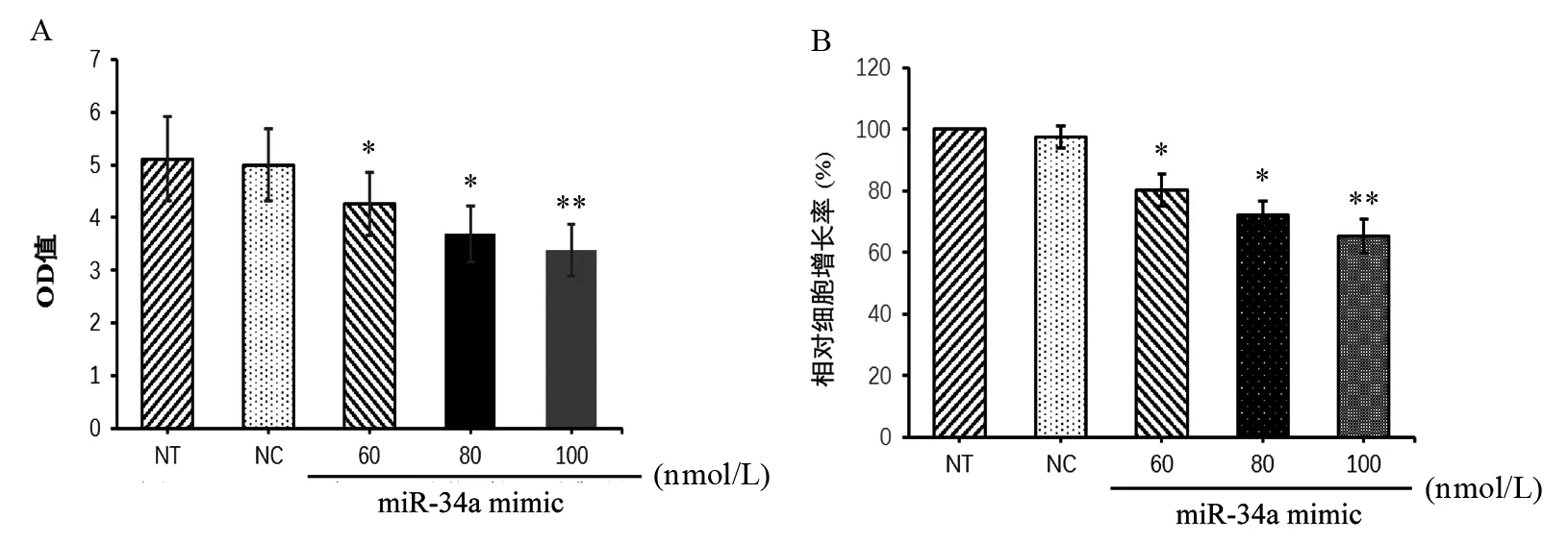
图1 miR-34a对A431细胞增殖的影响
2.3 miR-34a对A431细胞Survivin mRNA及蛋白的表达调控
qRT-PCR结果显示,转染miR-34a mimic 48 h后,miR-34a表达较NC组显著提高,P<0.001,但未见Survivin mRNA表达增高,见图 2A和B。
Western blotting结果表明,转染48 h后,miR-34a mimic组Survivin蛋白表达均显著低于NT组及NC组(P均<0.001),见图2C。
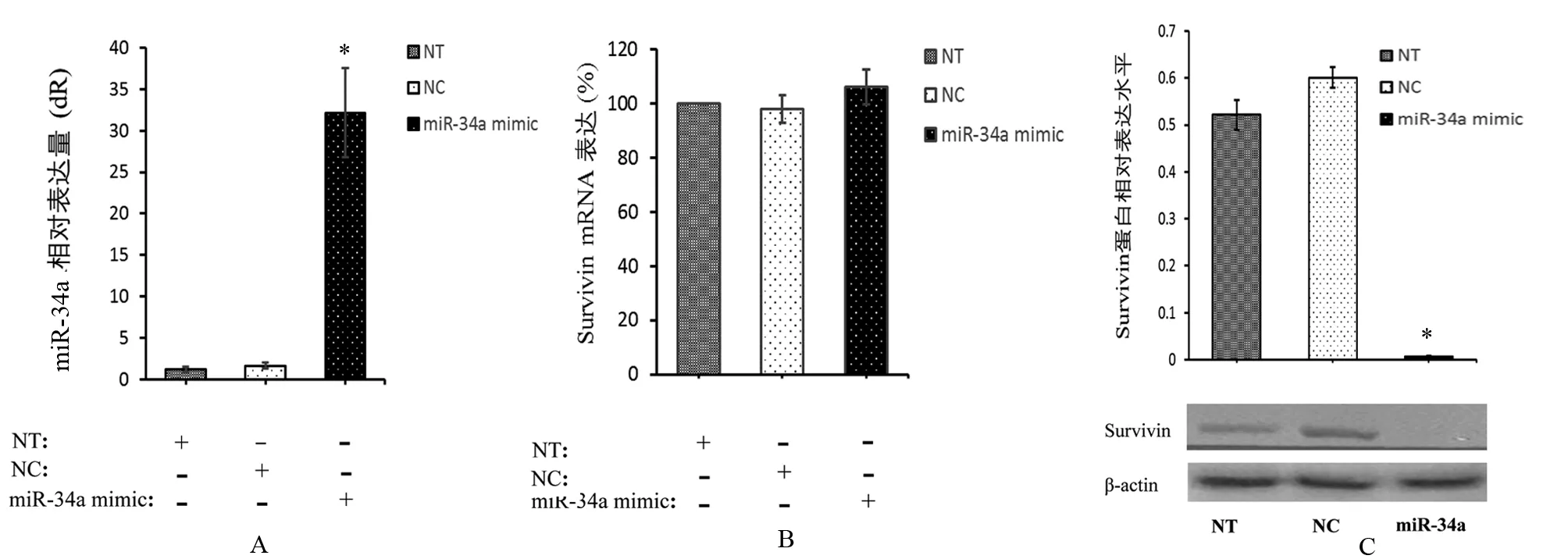
图2 miR-34a对Survivin的表达调控
2.4 生存分析
对全部46名SCC患者进行随访。其中死亡8例,失访2例。总5年生存率为78.26%(36/46)。Kaplan-Meier生存分析,见图3。
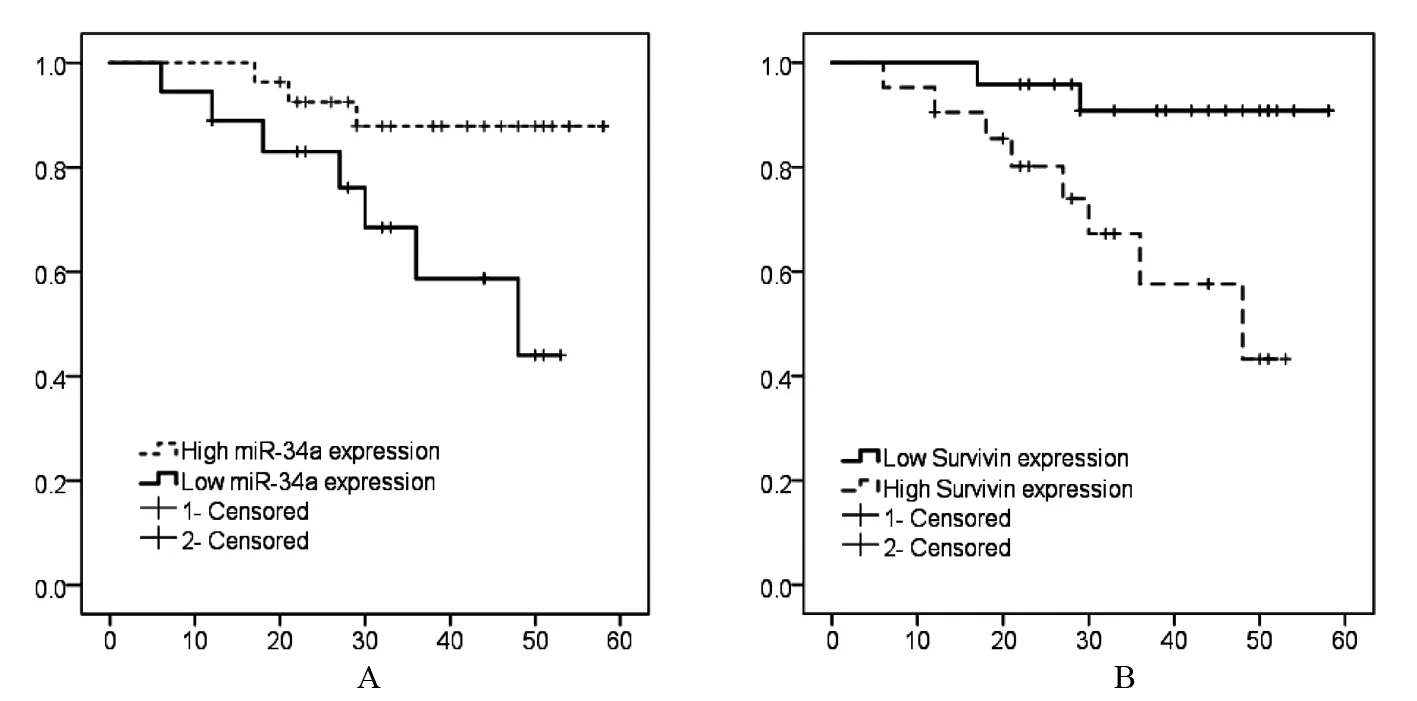
图3 Kaplan-Meier生存分析
3 讨 论
皮肤鳞状细胞癌是中国常见的皮肤恶性肿瘤之一,容易发生转移和复发,是导致非黑色素瘤皮肤癌患者死亡的主要病因。因此,寻找其发病过程中发挥关键作用的分子对鳞癌的诊断和治疗是必不可少的。
以siRNA及miRNA模拟物为手段的RNA治疗方案为肿瘤的治疗提供了新的方向和策略[11]。miRNAs是近年来发现的一类小的非编码RNA,主要参与对目的基因的负性调控。研究显示,miRNA对肿瘤的发生发展有着广泛的影响[4-6]。miR-34a是2007年首次发现的p53通路的下游靶基因,它能够诱导凋亡,导致细胞周期阻滞,抑制肿瘤细胞的迁移和侵袭[12]。很多研究显示,miR-34a在多种肿瘤中表达降低[9]。
Survivin是IAPs家族的新成员,能够抑制细胞凋亡、促进细胞增殖,其与肿瘤的发生、发展有密切关系。很多研究显示miR-34a与Survivin与多种肿瘤密切相关[13-14]。然而,miR-34a与Survivin在人类皮肤鳞癌发病机制中的作用并没有充分的报道。本研究中,SCC病人肿瘤组织中miR-34a表达显著低于正常皮肤组织,Survivin表达则显著高于正常皮肤组织。不同分化程度的SCC肿瘤组织中也存在这一变化趋势,提示miR-34a与Survivin在SCC发病机制中发挥重要作用。
为了进一步探讨miR-34a、Survivin及相关调控在SCC发病机制中的作用,本研究选用了人类皮肤鳞癌细胞系A431作为研究模型。研究结果显示,miR-34a mimic能够显著抑制肿瘤细胞的增殖,同时降低细胞内Survivin蛋白的表达,但对Survivin mRNA表达则没有显著的影响。这一结果提示,miR-34a很可能是通过对SCC细胞内Survivin进行转录后调节进而影响肿瘤的发生发展。此外,Kaplan-Meier生存分析的结果显示miR-34a及Survivin均可以作为比较好的SCC病人预后评估指标。
这些结果提示,miR-34a可能通过转录后调节Survivin进而影响SCC细胞的凋亡、增殖,从而参与了SCC的发生发展,同时它也可以作为一个很好的生物学诊断指标为评估SCC病人预后提供参考。
[1] Prieto-Granada C, Rodriguez-Waitkus P. Cutaneous squamous cell carcinoma and related entities: Epidemiology, clinical and histological features, and basic science overview[J]. Curr Probl Cancer, 2015, 39(4): 206-215.
[2] Solus JF, Murphy GF, Kraft S. Cutaneous Squamous Cell Carcinomas of the Lower Extremities Show Distinct Clinical and Pathologic Features[J]. Int J Surg Pathol, 2015, pii: 1066896915599058. [Epub ahead of print]
[3] Kuma Y, Ito T, Nagae K, et al. Two Cases of Cutaneous Squamous Cell Carcinoma Arising in Immunosuppressed Patients with Chronic Human Papillomavirus Infection[J]. Case Rep Dermatol, 2015, 7(2): 178-182.
[4] Balci S, Ayaz L, Gorur A, et al. microRNA profiling for early detection of nonmelanoma skin cancer[J]. Clin Exp Dermatol, 2015, doi: 10. 1111/ced. 12736. [Epub ahead of print].
[5] Sampson VB, Yoo S, Kumar A, et al. MicroRNAs and Potential Targets in Osteosarcoma: Review[J]. Front Pediatr, 2015, 3: 69.
[6] Cong J, Liu R, Wang X, et al. MiR-634decreases cell proliferation and induces apoptosis by targeting mTOR signaling pathway in cervical cancer cells[J]. Artif Cells Nanomed Biotechnol, 2015, 14: 1-8.
[7] Plewka D, Jakubiec-Bartnik B, Morek M, et al. Survivin in ovary tumors[J]. Ginekol Pol, 2015, 86(7): 525-530.
[8] Jaiswal PK, Goel A, Mittal RD. Survivin: A molecular biomarker in cancer[J]. Indian J Med Res, 2015, 141(4): 389-397.
[9] Li T, Li L, Li D, et al. MiR-34a inhibits oral cancer progression partially by repression of interleukin-6-receptor[J]. Int J Clin Exp Pathol, 2015, 8(2): 1364-1373.
[10] Chen Y, Zhu X, Zhang X, et al. Nanoparticles modified with tumor-targeting scFv deliver siRNA and miRNA for cancer therapy[J]. Mol Ther, 2010, 18(9): 1650-1656.
[11] Farra R, Grassi M, Grassi G, et al. Therapeutic potential of small interfering RNAs/micro interfering RNA in hepatocellular carcinoma[J]. World J Gastroenterol, 2015, 21(30): 8994-9001.
[12] Wei B, Huang QY, Huang SR, et al. MicroRNA-34a attenuates the proliferation, invasion and metastasis of gastric cancer cells via downregulation of MET[J]. Mol Med Rep, 2015, 12(4): 5255-5261.
[13] Geng D, Song X, Ning F, et al. MiR-34a Inhibits Viability and Invasion of Human Papillomavirus-Positive Cervical Cancer Cells by Targeting E2F3 and Regulating Survivin[J]. Int J Gynecol Cancer, 2015, 25(4): 707-713.
[14] Chen Y, Tsai YH, Tseng SH. Inhibition of cyclin-dependent kinase 1-induced cell death in neuroblastoma cells through the microRNA-34a-MYCN-survivin pathway[J]. Surgery, 2013, 153(1): 4-16.
miR-34a affect the proliferation of squamous cell carcinoma by targeting SurvivinSHI
Xue-qing
(DepartmentofDermatology,theSecondPeople’sHospitalofDalian,Dalian116011,China)
Objective To analyze the relationship between miR-34a and Survivin in proliferation of cutaneous squamous cell carcinoma (SCC). Methods miR-34a and Survivin expression in SCC tissues were detected by quantitative real-time polymerase chain reaction. miR-34a mimic was transfected into SCC cell line A431 to increase its level. The effects of miR-34a on cell proliferation and Survivin expression were tested by MTS, semi-RT-PCR and western blotting analyses. Results The expression of miR-34a was significantly lower in SCC tissue than that in normal tissue, and lower in low differentiation SCC than that in high differentiation SCC. Survivin expression was higher in SCC tissue than that in normal tissue, and higher in low differentiation SCC than that in high differentiation SCC. The miR-34a expression was positively correlated with histologic differentiation and negatively correlated with Survivin expression. The transfection of miR-34a mimic significantly suppressed cell proliferation and decreased Survivin protein expression, but did not affect Survivin mRNA expression level. SCC patients with miR-34a high expression and Survivin low expression have a better prognosis. Conclusion miR-34a could affect the occurrence of SCC by targeting antiapoptotic gene Survivin.
squamous cell carcinoma; miR-34a; Survivin; proliferation
10.11724/jdmu.2015.06.07
施学清(1970-),女,辽宁大连人,副主任医师。E-mail:dajia-luntan@dl.cn
R739.5
A
1671-7295(2015)06-0547-05
施学清. miR-34a通过靶向抗凋亡基因Survivin抑制皮肤鳞状细胞癌增殖的研究[J].大连医科大学学报,2015,37(6):547-551.
2015-09-21;
2015-11-03)
