种植体周围龈沟液中TNF-α和MMP-8水平的研究
2015-10-14左恩俊胡书海
左恩俊,许 诺,胡书海
(1.大连医科大学 口腔医学院 修复工艺教研室, 辽宁 大连 116044;2.大连医科大学 中山学院, 辽宁 大连 116085)
论 著
种植体周围龈沟液中TNF-α和MMP-8水平的研究
左恩俊1,许 诺2,胡书海1
(1.大连医科大学 口腔医学院 修复工艺教研室, 辽宁 大连 116044;2.大连医科大学 中山学院, 辽宁 大连 116085)
目的 探讨种植体周围龈沟液中肿瘤坏死因子-α(TNF-α)和基质金属蛋白酶-8(MMP-8)的水平与种植体周围炎的关系。方法 选择2012年5月至2014年5月在大连医科大学口腔医学院行OSSTEM种植体种植修复的患者36例作为研究对象(种植体48颗),根据种植体周围情况将其分为健康种植体组(38颗)和炎症种植体组(10颗),将对侧同名健康天然牙作为对照组(48颗)。收集各组种植体和天然牙周围龈沟液,运用ELISA法检测其中TNF-α和MMP-8的浓度,同时检测牙周探诊深度(PD)和牙龈出血指数(SBI)。分析PD、SBI值与龈沟液中TNF-α、MMP-8水平的相关性。结果 炎症种植体组PD、SBI以及龈沟液中TNF-α和MMP-8水平均高于健康种植体组和健康天然牙组,差异具有显著性意义(P<0.05)。SBI、PD与TNF-α、MMP-8水平均呈正相关关系(P<0.01)。结论 种植体周围龈沟液中TNF-α和MMP-8水平和种植体周围炎密切相关,可在一定程度上反映种植体周围组织的健康状态。
种植体周围炎; 肿瘤坏死因子-α; 基质金属蛋白酶-8
种植修复技术在过去的30年间取得了巨大的发展,已成为牙列缺损和牙列缺失患者重要的修复方式,其10年的成功率已达到95%以上[1]。然而种植修复后的生物学并发症如:种植体周围黏膜炎、种植体周围炎等仍具有较高的普遍性[2-3]。种植体周围炎是由于细菌聚集和机体免疫反应引起的种植体周围软、硬组织的炎症反应[4],进而破坏种植体周围的上皮封闭,形成深牙周袋,最终导致进行性骨吸收。这种由细菌感染导致的炎症发展过程受到细胞因子如:肿瘤坏死因子-α(TNF-α)等的调控,这些细胞因子通过激活胶原酶如:基质金属蛋白酶-8(MMP-8)等通过骨保护素/核因子κB受体活化因子配体(OPG/RANKL)系统刺激破骨细胞分化来导致组织的破坏和骨质的吸收[5]。但目前尚无足够的证据表明TNF-α和MMP-8与种植体周围炎的发生发展密切相关。本研究检测TNF-α和MMP-8在健康种植体、炎症种植体和健康天然牙龈沟液中的表达,初步探讨TNF-α和MMP-8与种植体周围炎的关系,为种植体周围炎的预防、诊断、治疗和预后提供检测依据。
1 材料和方法
1.1 病例选择
选择2012年5月至2014年5月在大连医科大学口腔医学院行OSSTEM种植体种植的患者36例作为研究对象(种植体48颗)。其中男25例,女11例,年龄23~65岁。病例纳入标准:无全身系统性疾病;无吸烟嗜好;妇女未妊娠;至少1个月内未使用抗生素、免疫制剂及非甾体类药物;种植义齿无咬合创伤;依从性好,种植后能自觉进行口腔卫生的维护;种植义齿行使功能3个月以上;患者知情同意。
1.2 临床分组
根据种植体周围情况将其分为健康种植体组(38颗)和炎症种植体组(10颗),将对侧同名健康天然牙作为对照组(48颗)。健康天然牙:牙周探诊深度(PD)≤3 mm,牙龈出血指数(SBI)<2;健康种植体:PD≤4mm,SBI<2;炎症种植体:PD>4mm,SBI≥2。
1.3 研究方法
1.3.1 牙周状况记录:使用牙周探针轻缓地插入龈沟内,探针与牙体/种植体长轴平行,紧贴牙根,保持不超过20 g的探诊压力。记录种植体和同名健康牙的近中颊侧、远中颊侧、近中舌侧、远中舌侧4个位点的PD值。根据SBI记分方法:0=探诊无出血;1=仅在探诊处呈点状出血;2=出血在龈沟内成线状;3=出血沿龈缘扩展或溢出龈缘。检查并记录种植体和同名健康牙的SBI。
1.3.2 龈沟液的采集:将 Whatman Ⅲ号滤纸裁成宽 2 mm、长 20 mm的纸条,置于干净的容器中待用。用无菌干棉球擦干牙面,隔湿,去除较大的菌斑,轻吹牙龈,将制备好的滤纸条插入牙体/种植体颊侧近远中、舌(腭)侧近远中龈沟中,直到遇到轻微阻力为止,1 min 后取出。采集动作轻柔避免对牙周组织造成机械损伤,任何被唾液和血液污染的滤纸条被遗弃,重新采集。即刻放入装有300 μL PBS缓冲液的EP管中,每管皆含一个样本的4条滤纸,-70 ℃冷冻保存。
1.3.3 龈沟液样本的生化分析:样本在常温下解冻后,在高速台式冷冻离心机上以5000 r/min的速度运行15min,使其悬浮于溶液中的杂质通过离心作用沉淀于 Ep 管底,然后用微量移液器取上清液100 μL分别加入另两个 Ep 管中,采用双抗体夹心ELISA法,根据试剂盒操作方法和步骤检测标本中TNF-α和MMP-8的浓度。
1.4 统计学方法
2 结 果
炎症种植体组PD、SBI值及龈沟液中TNF-α和MMP-8水平均高于健康种植体组和健康天然牙组,差异具有显著性意义(P<0.05)。健康种植体组与健康天然牙组的PD、SBI值以及龈沟液中TNF-α和MMP-8水平的差异均无显著性意义(P>0.05)。见表1。
经Spearman秩相关检验,临床牙周指标SBI、PD值与龈沟液中TNF-α、MMP-8水平均呈正相关(P<0.01)。见表2。
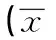
表1 各组牙周指数和龈沟液中TNF-α、MMP-8水平比较
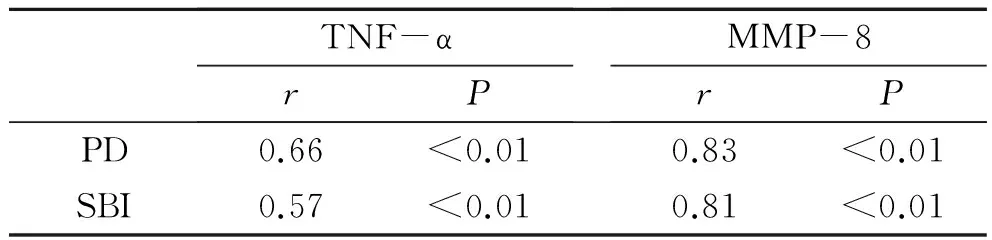
表2 牙周指数和龈沟液中TNF-α、MMP-8水平的相关性分析
3 讨 论
种植体周围炎是指影响已经形成骨结合并行使功能的种植体周围组织的炎性过程,与种植体周围黏膜炎相比,种植体周围炎不仅涉及到周围软组织的炎症,还可以导致种植体周围支持骨组织不可逆性吸收,破坏已经形成的骨结合,造成种植体的松动、脱落[6]。种植体周围炎是多因素的感染性疾病,其原因包括菌斑、过载和吸烟等,其中菌斑被认为是种植体周围炎最主要的病原性因素[7]。已有研究证实,细菌表面抗原、毒素以及代谢产物都可以刺激宿主的机体产生相应细胞因子,尤其是促炎症反应性细胞因子,如白细胞介素、肿瘤坏死因子、前列腺素等均可以造成骨质吸收,进而造成天然牙周围组织的水肿、渗出、化脓,探诊出血、探诊深度增加,牙齿松动直至脱落[8]。种植体周围炎同牙周炎的病理过程相类似,其龈沟液中促炎因子的种类和含量会根据种植体周围组织状态的不同而改变,临床医生可以通过评价龈沟液中相应的炎症介质作为种植体周围组织健康状况的诊断和治疗预后的监测指标。TNF-α一方面可以直接激活骨髓中的破骨细胞前体,另一方面间接作用于OPG/RANKL系统,导致牙周组织的破坏[9-10]。本项研究表明种植体周围炎龈沟液中TNF-α水平高于牙周健康的种植体和天然牙,且TNF-α水平与牙周探诊深度和牙龈出血指数呈正相关关系,提示TNF-α在种植体周围炎的发生发展过程中起着重要作用,与Machtei等[11]和Venza等[12]的研究结果相一致。基质金属蛋白酶主要分为胶原酶、明胶酶、溶基质蛋白酶等5种酶类,被认为无论是在病理还是生理修复的情况下,都具有破坏几乎所有细胞外基质和基底膜分子的作用[13],胶原酶主要由MMP-1, MMP-8, MMP-13组成,并与牙周组织降解密切相关,能特异地作用于构成牙周支持组织主要组成部分的I、II、III型胶原,并且在牙周附着丧失,牙槽骨吸收和牙周疾病进展中起着中心作用。种植体周围的牙龈组织,纤维结缔组织和骨组织中,Ⅰ型和Ⅲ型胶原纤维的含量最丰富,构成了种植体周围组织的主要成分。牙周病学研究中发现,在无炎症和轻度炎症牙龈组织的龈沟渗出液中,这些胶原酶的活性和水平及胶原裂解产物要低于重症炎症部位,而且牙周组织的炎症程度愈严重,龈沟液中MMP-8的水平和活性就愈高。Arakawa等[14]采用蛋白质免疫印迹法(Western Blot)检测种植体周围龈沟液中MMP的表达,结果仅在重度种植体周围炎龈沟液中检测到MMP-8,而MMP-1, MMP-13在正常组和轻、重种植体周围炎龈沟液中均未检查到。而本文采取更为敏感的ELISA法作为MMP-8的检测手段,实验各组均能够检测到MMP-8的表达,同时随着探诊深度的增加,种植体周围软组织炎症逐渐加重,骨吸收增高,龈沟液中MMP-8的含量不断升高。提示病理状态下MMP-8对Ⅰ型和Ⅲ型胶原纤维的降解是种植体周围炎发生机制中的关键因素。但有不同观点,Kuula等[15]对比研究了MMP-8基因敲除鼠和正常鼠在细菌感染导致的牙槽骨吸收的严重程度,结果MMP-8基因敲除鼠骨吸收要更加广泛。从而认为MMP-8伴随种植体周围炎症和骨吸收加剧而升高,是机体的一种保护机制,MMP-8能够抑制骨吸收。但无论MMP-8的作用是保护还是破坏,MMP-8都可以作为活动性种植体周围炎的标记。
TNF-α和MMP-8在种植体周围炎的发生和发展过程中的作用机制有待进一步研究,以期在种植体周围炎的预防、诊断和治疗方面有所突破。
[1] Ravald N, Dahlgren S, Teiwik A,et al.Long-term evaluation of Astra Tech and Brånemark implants in patients treated with full-arch bridges. Results after 12-15years[J]. Clin Oral Implants Res,2013,24(10):1144-1151.
[2] Koldsland OC, Scheie AA, Aass AM. Prevalence of peri-implantitis related to severity of the disease with different degrees of bone loss[J]. J Periodontol, 2010, 81(2):231-238.
[3] Mir-Mari J, Mir-Orfila P, Figueiredo R, et al. Prevalence of peri-implant diseases. A cross-sectional study based on a private practice environment[J]. J Clin Periodontol, 2012,39(5):490-494.
[4] 李德超,周彦鹏,王泽.种植体周围炎患者龈沟液中IL-18和MMP-13表达研究[J]. 中国实用口腔科杂志,2014,7(4):213-216.
[5] Boyce BF, Li P, Yao Z, et al. TNF-alpha and pathologic bone resorption[J]. Keio J Med,2005,54(3):127-131.
[6] Fonseca FJ, Moraes Junior M, Lourenço EJ, et al. Cytokines expression in saliva and peri-implant crevicular fluid of patients with peri-implant disease[J]. Clin Oral Implants Res,2014,25(2):68-72.
[7] Lamster IB. Evaluation of components of gingival crevicular fluid as diagnostic tests[J]. Ann Periodontol,1997,2(1):123-137.
[8] Dosseva-Panova VT, Popova CL, Panov VE. Subgingival microbial profile and production of proinflammatory cytokines in chronic periodontitis[J]. Folia Med (Plovdiv), 2014,56(3):152-160.
[9] Lachmann S, Kimmerle-Müller E, Axmann D, et al. Associations between peri-implant crevicular fluid volume, concentrations of crevicular inflammatory mediators, and composite IL-1A -889 and IL-1B +3954genotype. A cross-sectional study onimplant recalls patients with and without clinical signs of peri-implantitis[J].Clin Oral Implants Res,2007,18(2):212-223.
[10] Bostanci N, Ilgenli T, Emingil G, et al. Gingival crevicular fluid levels of RANKL and OPG in periodontal diseases: Implications of their relative ratio [J].J Clin Periodontol,2007,34(5):370-376.
[11] Machtei EE,Oved-Peleg E, Peled M.Comparison of clinical, radiographic and immunological parameters of teeth and different dental implant platforms[J].Clin Oral Implants Res,2006,17(6):658-665.
[12] Venza I, Visalli M, Cucinotta M, et al. Proinflammatory gene expression at chronic periodontitis and peri-implantitis sites in patients with or without type 2 diabetes[J]. J Periodontol, 2010,81(1):99-108.
[13] Giannobile WV. Host-response therapeutics for periodontal diseases[J]. J Periodontol,2008,79(8):1592-1600.
[14] Arakawa H, Uehara J, Hara ES, et al. Matrix metalloproteinase-8 is the major potential collagenase in active peri-implantitis[J]. J Prosthodont Res, 2012,56(4):249-255.
[15] Kuula H, Salo T, Pirila E, et al.Local and systemic responses in matrix metalloproteinase 8-deficient mice during Porphyromonas gingivalis-induced periodontitis[J]. Infect Immun,2009,77(2):850-859.
Levels of TNF-α and MMP-8 in peri-implant sulcular fluid
ZUO En-jun1,XU Nuo2,HU Shu-hai1
(1.CollegeofStomatology,DalianMedicalUniversity,Dalian116044,China;2.ZhongshanCollege,DalianMedicalUniversity,Dalian116085,China)
Objective To investigate the relation of TNF-α and MMP-8 levels in peri-implant sulcular fluid with peri-implantitis. Methods 36 patients were enrolled who received oral implant treatment at the College of Stomatology of Dalian Medical University. All the implants (n=48) were divided into health implant group(n=38)and inflammation implant group(n=10),and 48 healthy natural teeth were collected as the control group. Gingival crevicular fluid was sampled and levels of TNF-α and MMP-8,PD and SBI were measured and analyzed. Results PD, SBI and the levels of TNF-α and MMP-8 of inflammation implant group were higher than healthy natural teeth group and healthy implant group(P<0.05). PD and SBI had positive correlation with the levels of TNF-α and MMP-8(P<0.01). Conclusion The levels of TNF-α and MMP-8 in gingival crevicular fluid have close relationship with peri-implantitis,which can reflect the health condition of peri-implant tissues to some extent.
peri-implantitis; TNF-α;MMP-8
10.11724/jdmu.2015.06.04
辽宁省科技厅科学事业公益研究基金项目(2013001007)
左恩俊(1981-),男,黑龙江鹤岗人,副教授。E-mail:zuoej@163.com
胡书海,教授。E-mail: shuhaihu4141@aliyun.com
R782.2
A
1671-7295(2015)06-0533-04
左恩俊,许诺,胡书海. 种植体周围龈沟液中TNF-α和MMP-8水平的研究[J].大连医科大学学报,2015,37(6):533-536.
2015-06-04;
2015-11-09)
