鲤鱼卵中丝氨酸蛋白酶抑制剂活性的初步研究
2015-10-13杨书婷等
杨书婷等

摘要:利用凝胶层析法从鲤鱼(Cyprinus carpio)卵中分离纯化得到一种丝氨酸蛋白酶抑制剂。选择胰蛋白酶、弹性蛋白酶、枯草杆菌蛋白酶、胰凝乳蛋白酶、凝血酶及其特异底物,建立比色法检测,对初步分离的丝氨酸蛋白酶抑制剂活性进行了分析。结果表明,丝氨酸蛋白酶抑制除对胰凝乳蛋白酶无抑制作用外,对其他的蛋白酶均有抑制效果;当温度超过70 ℃时,丝氨酸蛋白酶抑制剂失活,但在pH 2~11均保持活性,具有较强的酸碱稳定性。
关键词:丝氨酸蛋白酶抑制剂;比色法;酸碱稳定性
中图分类号:S917.4;TS254.9 文献标识码:A 文章编号:0439-8114(2015)18-4556-04
DOI:10.14088/j.cnki.issn0439-8114.2015.18.041
蛋白酶抑制剂(Proteinase inhibitor,PI) 泛指对蛋白水解酶具有抑制活性的蛋白质,由于其分子量相对较小,广泛存在于植物、动物和微生物中[1,2]。其中丝氨酸蛋白酶抑制剂(Serine protease inhibitory,SPI)首先在动物血清中被发现[3],蛋白酶抑制剂因子的活性中心可与蛋白酶结合形成稳定的复合体从而发挥作用,防止不必要的蛋白酶水解。它们在调节蛋白酶活性及机体免疫调控方面发挥重要的功能,如纤维蛋白溶解作用、血淋巴凝结,细胞活素类、肿瘤调控机制及激素的转运[4,5]。
中国淡水鱼产业发展迅速,动物蛋白资源仍有待开发[6]。目前,已有大量的报道针对鱼类的下脚料如鱼鳞中提取胶原蛋白和明胶[7]、鱼内脏中提取消化蛋白酶[8]和鱼脑中提取磷脂[9]进行研究。然而对于鱼卵的研究涉及较少,本试验从鲤鱼卵中分离纯化出丝氨酸蛋白酶抑制剂,并对其酶动力学性质进行初步研究,旨在为淡水鱼和该蛋白酶抑制剂的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
鲤鱼(Cyprinus carpio) 购于农贸市场,体长20~30 cm,体重0.3~0.5 kg,为性成熟雌体;胰蛋白酶、弹性蛋白酶、枯草杆菌蛋白酶、胰凝乳蛋白酶及凝血酶均购自Sigma公司,发色底物Nα-Benzoyl-L-arginine 4-nitroanilide hydrochloride (B3133)、N-Succinyl-Ala-Ala-Ala-pNA(S4760)、N-CBZ-Gly-Gly-Leu-pNA (C3022)、N-Benzoyl-L-tyrosine ethyl ester(BTEE)、N-(p-Tosyl)-Gly-Pro-Arg pNA (T1637)均购自Sigma公司,其他试剂均为分析纯,符合试验要求。
主要仪器:pH计、SephadexG50层析柱(2.6 cm×100 cm)、TU-1901 紫外可见分光光度计、高速冷冻离心机、LGJ-10冷冻干燥机、酶标仪。
1.2 方法
1.2.1 蛋白酶抑制剂的提取与纯化 从新鲜鲤鱼腹腔中取出鱼卵,蒸馏水洗净后加适量的纯水,按1∶1(m∶V)的比例用研钵研磨至匀浆,离心30 min(10 000 r/min,4 ℃),收集上清液,重复3次,合并上清液,冷冻干燥备用。将冻干粉溶解于适量的pH 6.0的0.1 mol/L磷酸氢盐缓冲液溶液中,10 000 r/min,4 ℃离心30 min,取上清液利用0.22 μm的滤膜过滤后加样至SephadexG50层析柱(2.6 cm×100 cm)中,用pH 6.0的0.1 mol/L磷酸氢盐缓冲液溶液(PBS)洗脱,流速为3.0 mL/min,收集活性组分,将收集的活性蛋白组分处理后加样至SephadexG75层析柱(2.6 cm×100 cm)中,用0.1 mol/L PBS洗脱,收集其活性成分,冷冻干燥备用。
通过微量样本多指标流式蛋白定量技术(BCA)试剂盒法测定蛋白质的含量,以牛血清为标准品,酶标仪法在562 nm处测定收集样品的吸光度。
1.2.2 蛋白酶抑制剂检测及胰蛋白酶抑制常数的测定 在pH 7.8含有1 mmol/L CaCl2的50 mmol/L Tris-Hcl缓冲液反应体系中,测定待测样品于25 ℃对丝氨酸蛋白酶家族的胰蛋白酶、弹性蛋白酶、胰凝乳蛋白酶、凝血酶水解生色底物的抑制影响。对枯草杆菌蛋白酶水解生色底物的抑制影响于pH 8.45含有1 mmol/L CaCl2的50 mmol/L Tris-HCl缓冲液反应体系中进行。将不同含量的待测样品(终浓度2.5~50 mg/mL)与蛋白酶(胰蛋白酶、弹性蛋白酶、枯草杆菌蛋白酶、胰凝乳蛋白酶浓度均为2 mg/mL,凝血酶浓度为100 U/mL)于25 ℃保温15 min,加入浓度为1 mg/mL的底物(胰凝乳蛋白酶底物质量浓度为5 mg/mL)起始反应。于410 nm (胰凝乳蛋白酶253 nm)处连续2 min检测吸光度的变化,通过比较添加抑制剂前后蛋白酶活力的变化来检测抑制剂的抑制活性。1单位的酶活力定义为:在25 ℃酶催化底物产生1 nmol的硝基苯胺所需的酶量。
取胰蛋白酶分别与不同浓度的底物(0.2、0.4、0.6、0.8 mg/mL)于25 ℃,pH 7.8的条件下反应,405 nm处连续检测5 min测定蛋白酶的活力。根据底物的浓度、酶活力,利用公式Ki=[I]/(V0/V1+1)计算动力学常数,其中,[I]为鲤鱼卵丝氨酸蛋白酶抑制剂的浓度,V0为空白对照测定的反应速度,V1为加入蛋白抑制剂的反应速度。每组做3个平行试验取平均值。
1.2.3 蛋白酶抑制剂的热稳定性及酸碱稳定性检测 参考Tzeng等[10]方法将纯化后的样品(终浓度为50 mg/mL)溶液于温度梯度为30、40、50、60、70、80、90、100 ℃中加热10 min,取出立即放置于冰上冷却,并测定其残留抑制剂活性;同时将样品pH 2.0~5.0的50 mmol/L甘氨酸-盐酸缓冲液;pH 6.0~8.0的50 mmol/L磷酸缓冲液;pH 9.0~10.0的50 mmol/L甘氨酸-NaOH缓冲液;pH 10.0~11.0的50 mmol/L磷酸-NaOH缓冲液。在25 ℃条件下反应10 min,通过比较各pH条件下抑制剂的活性以反应抑制剂的酸碱稳定性。
2 结果与分析
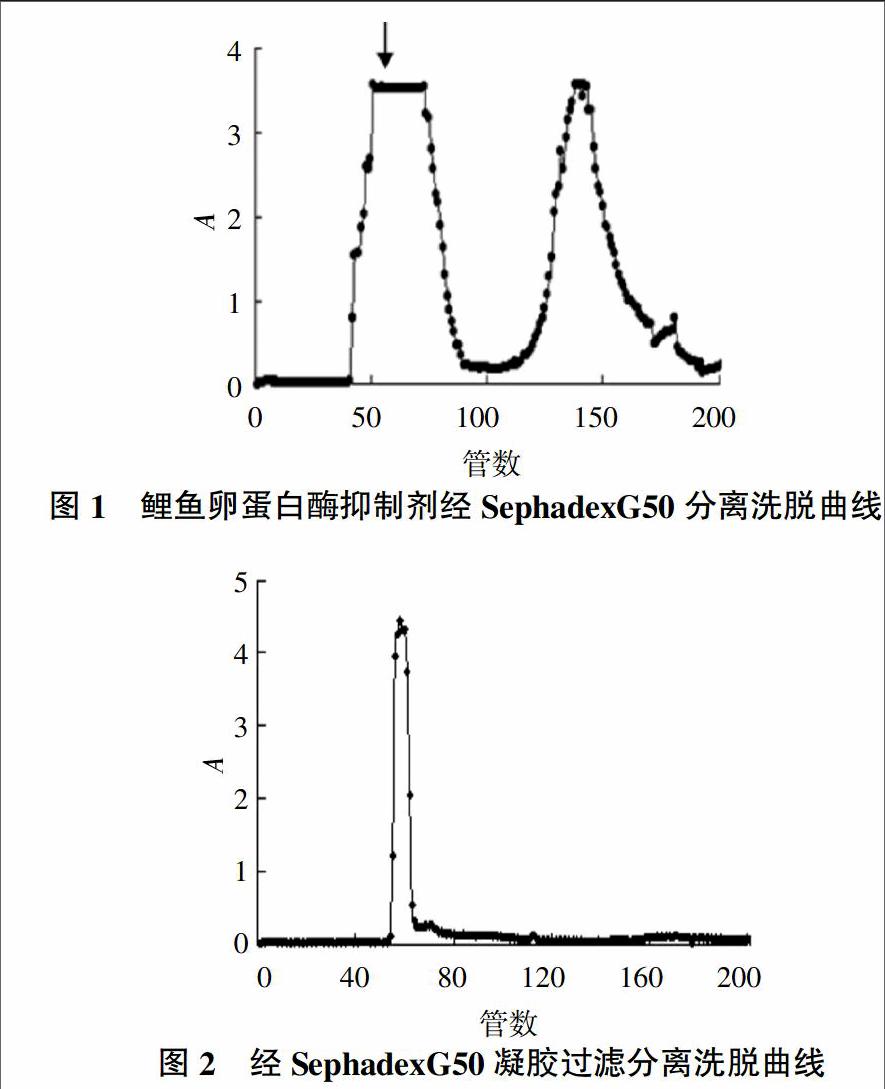
2.1 蛋白酶抑制剂的分离纯化
通过凝胶过滤层析可以使目的蛋白与鱼卵中其他大量杂蛋白质及一些酶类的结合状态打开,达到快速、有效分离。结果显示,经SephadexG50分离纯化,洗脱曲线出现了两个相似的蛋白峰(图1),通过胰蛋白酶抑制剂的胰蛋白酶活性分析结果显示,第一个蛋白峰具有蛋白酶活。合并收集具有酶活的蛋白洗出液。经SephadexG75分离纯化,洗脱结果显示只出现1条曲线(图2),其蛋白浓度为222.08 μg/mL。通过胰蛋白酶抑制剂的胰蛋白酶活性检测其峰值具有抑制活性,收集并冷冻干燥备用。
2.2 蛋白酶抑制剂活性及抑制常数的确定
鱼卵中存在天然丝氨酸蛋白酶抑制剂。不同浓度的蛋白酶抑制剂,其抑制活性差别很大。如图3所示,除对胰凝乳蛋白酶(BTEE)无明显的抑制活性外,对胰蛋白酶(T1426)、枯草杆菌蛋白酶(P5380)、弹性蛋白酶(S4760)、凝血酶(T4648)均有不同程度的抑制。当蛋白酶抑制剂浓度为2.5、5、10、25、50 mg/mL时,剩余酶活力分别达到80%、60%、40%、20%、10%以上。随着蛋白酶抑制剂浓度的增加,其抑制活性逐渐增强。根据Ki公式计算得出,鲤鱼卵蛋白酶抑制剂的抑制常数Ki为12.1 nmol/mL(n=3)。
2.3 鱼卵中丝氨酸蛋白酶抑制剂的pH及热稳定性
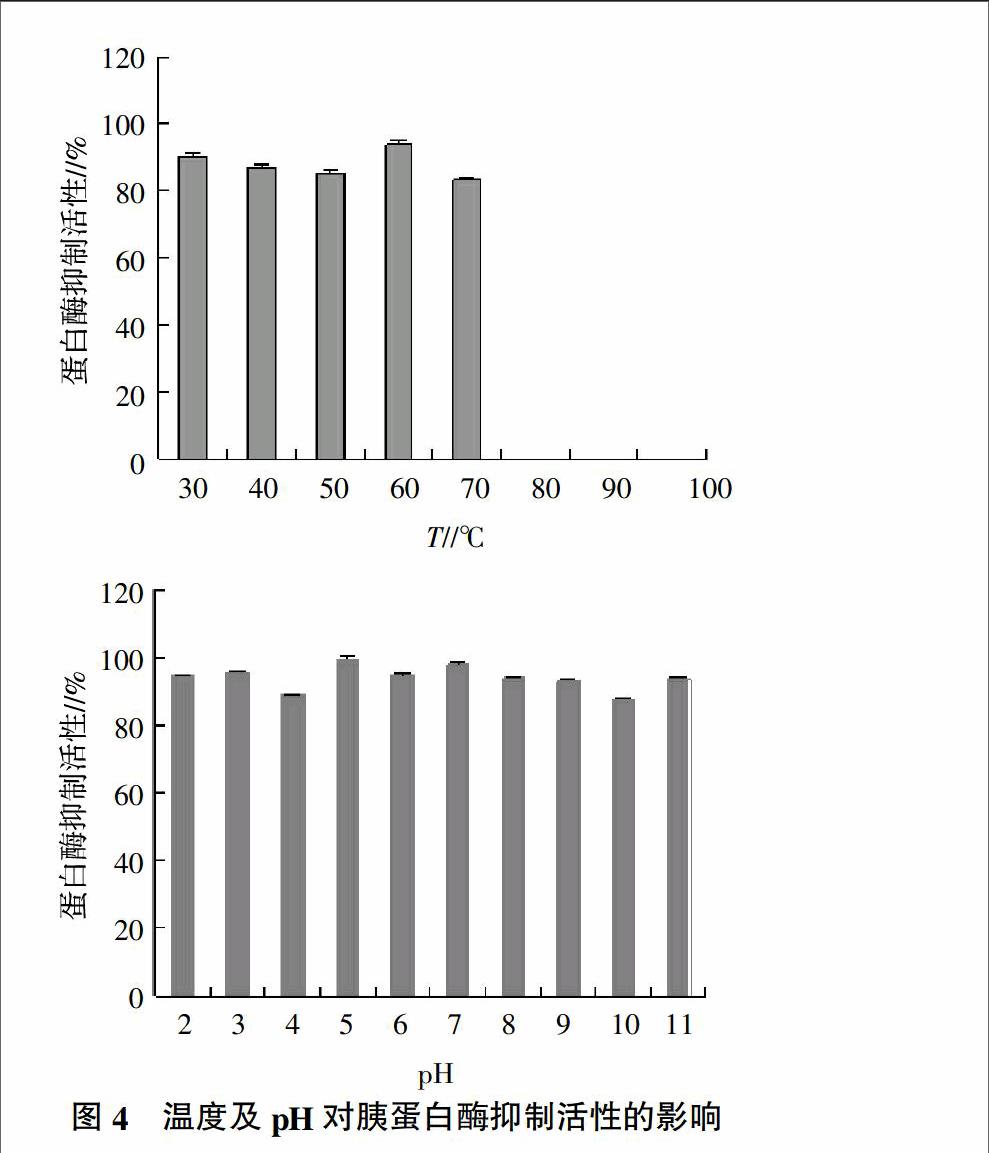
根据纯化后的蛋白酶抑制剂的基本特性研究表明(图4),该抑制剂的热稳定性温度在30~70 ℃时,鲤鱼卵中丝氨酸蛋白酶抑制剂保持在85%以上,但温度超过70 ℃时,则失去对特异性底物的水解活性。而鲤鱼卵具有广泛的酸碱稳定性,在pH 2~11抑制剂的活性始终保持在85%以上,表明该蛋白酶抑制剂具有较好的pH稳定性。温度会影响蛋白酶抑制剂与蛋白酶的有效结合,而高温会引起蛋白酶抑制剂发生显著的结构变化甚至使其活性丧失。
3 讨论
鱼卵中存在着高效的蛋白酶抑制剂[10-12]。而本研究通过凝胶色谱柱技术从鲤鱼卵中分离出SPI,通过对该抑制剂的温度和酸碱稳定性的研究表明,鲤鱼卵SPI在30~70 ℃有较好的稳定性,在pH 3~11含有较好的酸碱稳定性。温度会影响蛋白酶抑制剂与蛋白酶的有效结合,而高温会引起蛋白酶抑制剂发生显著的结构变化甚至使其活性丧失,根据蛋白酶抑制剂具有较好的耐温及耐酸碱的特性,可以合理的控制鱼类养殖的生存环境,以避免因恶劣环境的影响而造成养殖经济的损失。
胰蛋白酶、凝血酶、枯草杆菌蛋白酶以及弹性蛋白酶都是先天免疫防御系统中占重要地位的体液免疫因子[13]。目前有Ustadi等[14]等在玻璃鱼卵中提取蛋白酶抑制剂进行研究;郭强等[15]研究了四种鱼卵的丝氨酸蛋白酶抑制剂酶学活性比较。本试验通过对这些蛋白酶的活性研究表明该抑制剂具有较好的专一抑制作用。其可针对病原性分泌的蛋白酶,选择性消化病原体,改变真菌和细菌的生长速率来调控鱼类的防御系统并重新构建宿主防御体系。因此,可通过进一步纯化技术得到纯的SPI,通过生化分子技术分析其蛋白结构序列及功能,以提高鲤鱼鱼卵的综合利用效率。
参考文献:
[1] KNIGHT P J K,CRICKMORE N,ELLAR D J. The receptor for Bacilius thuringiensis CryIA(c) deltaendotoxin in the brushborder membrane of the lepidopteran Manduca sexta is a minopeptiase[J].N Mol Microbiol,1994(11):429-436.
[2] SANGADALA S,WALTERS F S,ENGLISH L H,et al.A mixture of Manduca sexta aninopeptidase and phosphatase enhances Bacillus thuringiensis insecticidal CryIA(c) toxin binding and 86Rb+-K+ efflux in vitro[J]. J Biol Chen,1994,269:10088-10092.
[3] IRVING J A,STEENBAKKERS P J,LESK A M,et al. Serpins in prokaryotes[J].Mol Biol Evol, 2002,19:1881-1890.
[4] OPDENAKKER G ,VAN D J.Cytokines and proteases in invasive processes: Molecular similarities between in ammation and cancer[J].Cytokine, 1992(4):251-258.
[5] KREM M M,CERA E D.Evolution of enzyme cascades from embryonic development to blood coagulation[J]. Trends in Biochemical Sciences,2002,27(2):67-74.
[6] 张俊杰,曾庆孝.我国淡水鱼鱼糜的研究情况[J].食品与发酵工业,2002,28(9):57-63.
[7] 卢 航,胡建恩,张 丽,等.罗非鱼鳞明胶的制备及其酶解产物活性研究[J].食品科技,2013 (2):75-79.
[8] 吴燕燕,李来好,郝志明,等.罗非鱼肝脏中超氧化物歧化酶的提取、纯化与分析[J].水产学报,2007,31(4):83-90.
[9] 张 丽,胡建恩,刘 迪,等.超声波辅助鱼脑磷脂的方法研究[J].大连海洋大学学报,2014,29(1):66-69.
[10] TZENG S S,CHEN G H,JIANG S T.Expression of soluble thioredoxin fused-carp(Cyprinus Carpio) ovarian cystatin in Escherichia coli[J].Food Sci,2002,67:2309-2316.
[11] YAMASHITA M,KONAGAYA S.A novel cysteine protease inhibitor of the egg of chum salmon,containing a cystein erich thyroglobulin-like motif[J]. J Biol Chem,1996,271(3):1282-1284.
[12] CHOI J H,PARK P J,KIM S K. Purification and characterization of a trypsin inhibitor from the egg of skipjack tuna Katsuwonus pelamis[J].Fisheries Science,2002,68:1367-1373.
[13]HOMVISES T,TASSANAKAJON A,SOMBOONWIW K.Penaeus monodon SERPIN,PmSERPIN6,is implicated in the shrimp innate immunity[J]. Fish&Shellfish Immunology,2010,29(5):890-898.
[14] USTADI,KIM K Y,KIM S M. Purification and identification of a protease inhibitor from glassfish(Liparis tanakai) eggs[J]. J Agric Food Chem,2005,53(20):7667-7672.
[15] 郭 强,欧 雪,周 平,等.四种常见鱼卵对丝氨酸蛋白酶抑制剂活性比较[J].水产科学,2012,31(1):221-229.
