基于微波辅助提取八角莲黄酮类化合物的工艺优化及抗氧化性研究
2015-10-11陈仕学聂文丹秦志亮
陈仕学,聂文丹,秦志亮,钟 新
(铜仁学院 材料与化学工程学院;梵净山特色动植物资源重点实验室;应用化学研究所,贵州 铜仁 554300 )
基于微波辅助提取八角莲黄酮类化合物的工艺优化及抗氧化性研究
陈仕学,聂文丹,秦志亮,钟新
(铜仁学院 材料与化学工程学院;梵净山特色动植物资源重点实验室;应用化学研究所,贵州 铜仁 554300 )
采用单因素和正交试验对梵净山野生八角莲中黄酮类化合物的提取工艺进行研究,主要考察乙醇体积分数、料液比、微波时间及微波功率4个因素对提取率的影响,结果表明:微波辅助提取的最佳工艺条件为:乙醇体积分数40%、料液比1:30、微波时间4min和微波功率中低火(264w),黄酮类化合物的提取率为9.038%。另外,八角莲黄酮类化合物对Fenton反应产生羟基自由基、邻苯三酚自氧化反应产生超氧阴离子自由基和猪油有较高的清除能力。因此,采用微波辅助浸提法具有时间短、耗能少、含量高及抗氧化作用等特点。
八角莲;黄酮类化合物;微波提取;工艺优化;抗氧化性
1.引言
八角莲(Dysosma versipellis (Hance) M. Cheng ex Ying),小檗科八角莲属植物,湖北、贵州、广东、等地方分布有大量该物质[1],并有清除自由基和抗氧化活性作用[2,3]。到目前为止,对梵净山八角莲没有研究报道。本文以梵净山野生八角莲为原料,通过微波方法提取并开展抗氧化性研究,为开发本地药用材料打基础。
2.器材与方法
2.1.材料
梵净山野生八角莲,60℃烘干,室温保存备用。
2.2.试剂
Al(NO3)3、 FeSO4、H2O2;无水乙醇、冰醋酸Na2S2O3、三氯甲烷;NaOH;NaNO2、乙酸乙酯;水杨酸;盐酸;Tris;邻苯三酚。
2.3.仪器
恒温干燥、MM823EC8-PS(X)型美的微波炉、800型低速离心机、AR1140型电子天平、粉碎机、分光光度计。
2.4.方法
2.4.1.制作标准曲线
取10mg芦丁,30%乙醇溶液溶解,用容量瓶定溶到100mL刻度,搅拌均匀,得到0.1mg/mL标准溶液。分别取标准溶液0、1.0、2.0、3.0、4.0、5.0mL 于10mL容量瓶中,加5g/100mL亚硝酸钠1.0mL,放置5min,加10g/100mL硝酸铝1.0mL,放置5min,再加4g/100mL氢氧化钠5mL,摇匀,放置10min,定容 100mL。用质量浓度作横坐标,吸光度作纵坐标,作标准曲线[4]。
2.4.2.含量测定。
称取药材粉,溶解加热提取,滤液倒入100mL容量瓶,在瓶中加入1.0mL 5%的亚硝酸钠溶液,放置一会儿;加1.0mL 10%硝酸铝溶液,放一会儿,再加 5.0mL 4%L氢氧化钠溶液,然后用蒸馏水加到100mL,震荡,放10min测定,计算该物质含量。
2.4.3.提取条件的优化
2.4.3.1.单因素实验
分别准确称取已处理好的八角莲粉末 1.0000g,以乙醇为浸提剂进行单因素试验,料液比1:10,1:20,1:30,1:40,1:50;微波时间3、4、5、6、7、8min;乙醇浓度20%、30%、40%、50%、60%;功率设置为低火、中低火、中火、中高火、高火做单因素试验。
2.4.3.2.正交试验
由于各单因素影响不同,因此需对单因素通过正交试验得到最佳浸提条件。
2.4.4.抗氧化活性研究
2.4.4.1.•OH自由基清除率的测定[5]
取7个25mL容量瓶编号为1、2、3、4、5、6、7。依次加入2mmol/LFeSO4溶液5mL、6mmol/L水杨酸-乙醇15mL。向1号加2mL蒸馏水,向2-7号分别加浓度不同的2mL黄酮类化合物,然后在1-6号中加5mL 3%双氧水,7号加5mL蒸馏水,40℃水浴加热25min。测吸光度。
清除率(%)=(A0—(Ax—Ax0))/A0×100%,式中:A0表示空白吸光度;Ax表示加待测溶液后的吸光度;Ax0表示待测溶液本底吸光值。
2.4.4.2.·O2-清除率的测定
取7个50mL容量瓶编号为1、2、3、4、5、6、7。依次加入0.05mol/LTris-HCl 5mL,37℃水浴加热20min。1号加2mL蒸馏水,2到7号分别加入浓度不同样品溶液 2mL,1-6号加 3mmol/L邻苯三酚0.5mL,7号加入0.01mL/L 盐酸0.5mL,将1-7号同时放于37℃水浴加热6min,加入0.1mol/L盐酸1mL,在320nm处测其吸光值[6-7]。
清除率(%)=(A0-(Ax-Ax0))/A0×100%,式中:A0表示空白吸光度;Ax表示加待测溶液后吸光度;Ax0表示待测溶液本底吸光值。
2.4.4.3.POV值的测定
取1mL猪油于250mL碘量瓶中,加入不同体积的黄酮类化合物提取液,于 60℃恒温干燥箱保温48h,取出加入氯仿-冰乙酸(2:3)混合液20mL,震荡,加1mL饱和碘化钾使之溶解,震荡均匀,密封、暗处保存 5min,立刻加蒸馏水 25mL,摇均匀,Na2S2O3滴至淡黄色,加1mL 1%淀粉作指示剂,至蓝色消去,记录体积 V1,同法作空白实验,消耗Na2S2O3体积为V0[8],计算POV值。
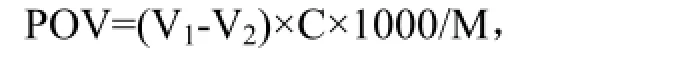
式中:V1表示样品消耗 Na2S2O3的体积(mL);V2表示空白消耗Na2S2O3的体积(mL);M:1mL猪油的质量(1mL猪油相当于0.6g)。
3.结果与分析
3.1.芦丁标准曲线的制作
由2.4.1.的方法得到的标准曲线方程为:Y=0.084C-0.004(R2=0.999),二者呈良好的线性关系(见图1)。

图1 芦丁标准曲线
提取率Y(%)=C×V/M,
式中:Y表示提取率(%);C表示待测样含量(mg/mL);V为提取液的体积(mL);M为样品质量(g)。
3.2.单因素实验
3.2.1.乙醇体积分数的影响
由图 2不难看出,开始时提取率与体积分数关系变化不大,到 40%时,提取率为最高值,以后随之下降。原因是与微波作用原理有一定关系,即是增加乙醇体积分数可以使原料充分溶解;但是乙醇体积分数如果太高,又会使细胞内醇溶性杂质溶出,导致提取率下降[9]。因此,选择40%作为最佳条件。
3.2.2.料液比的影响
由图3看出,开始料液比增大提取率缓慢增加,到达1:30的时候提取率为最大,大于1:30,会逐渐降低。是因为料液比加大利于有效成分充分溶出,进而提高了得率,比例加大反而使细胞不能完全破裂,不能充分溶出有效成分,综合考虑[10],选择1:30作为最佳值。
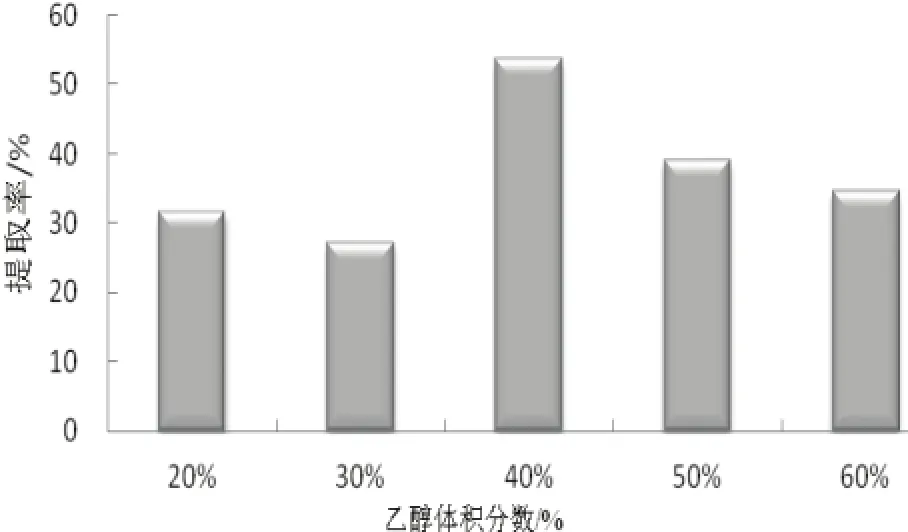
图2 乙醇体积分数的影响
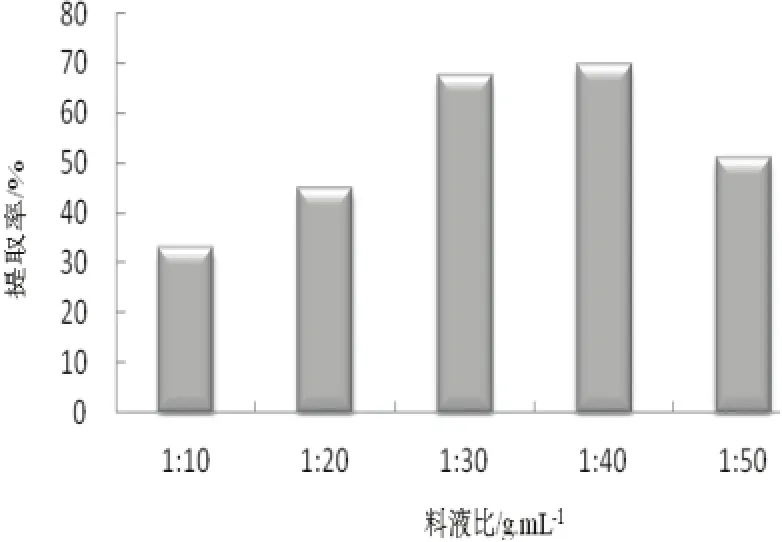
图3 料液比的影响
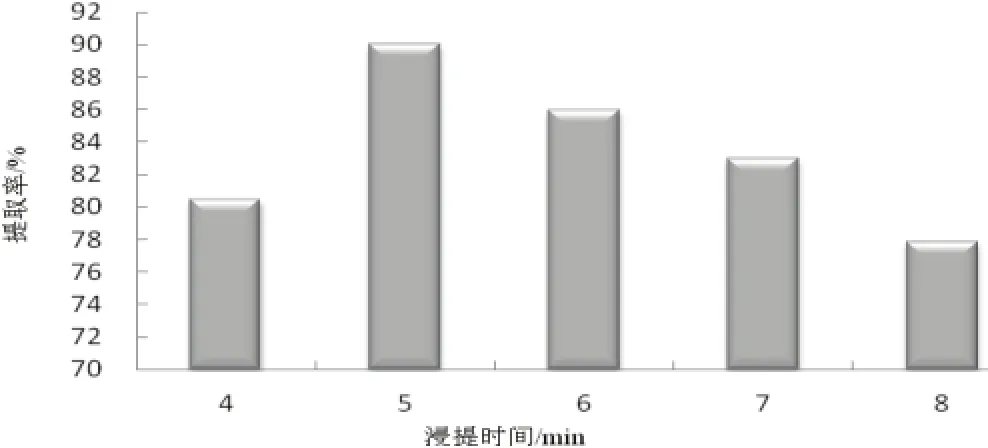
图4 浸提时间对提取率的影响

图5 功率的影响
3.2.3.浸提时间的影响
由图 4得到,随着时间加长,提取显著加大,5min时,达最佳值,并随时间加长反而降低,可能原因是时间短,微波作用不全,有效成分溶出不多,导致得率也不高,总黄酮得率也相应提高,但随着时间进一步延长,细胞膜破碎,从而影响提取效果[11-12]。另外,时间长,温度会上升,使有效成分遭到破坏并分解[13-14],因此,应选择5min为最佳时间。
3.2.4.功率的影响
由图5得知,随着功率加大,提取率有所增加,在264w时,提取率为最大值,并随着功率加大而降低,若要达到相应的提取率,采用低火加热时需要较长的微波辐射时间,采用中火加热,十分容易爆沸,严重影响提取效果[15]。因此,选择264w为最佳值。
3.3.正交实验结果及分析
由于各因素影响不一,为了更好确定影响情况,对各单因素进行正交试验,得到最佳提取工艺,结果见表1和表2。
由表2得到,对其影响因素顺序是D>A>B>C,因此得到最优条件是A2B2C1D2,即体积分数40%、1:30为料液比、4min为最佳浸提时间、功率为中低火(264w)。
3.4.验证性实验
为了检验最佳工艺条件是否稳定,利用最佳工艺条件重复操作5次,测提取率,计算RSD值,实验结果如表3。
由表 3得出,黄酮类化合物平均提取率为9.038%,比正交试验中的最佳值均大,计算得出RSD 为0.68%,由此表明该提工艺是比较稳定的。
3.5.不同产地八角莲黄酮类化合物的提取率比较
分别称取不同产地八角莲1g在最佳条件下提取黄酮类化合物,测定吸光值,通过回归方程计算提取率,结果见表4。由表4得到,产地不同,其提取率有一定差异,且梵净山野生八角莲黄酮类化合物提取率比其他地方的稍微较高。
3.6.抗氧化性研究
3.6.1.羟基自由基清除
由图 6可知,该化合物对羟基自由基有一定清除作用,随着浓度的增加清除作用也增大。

表1 因素水平表
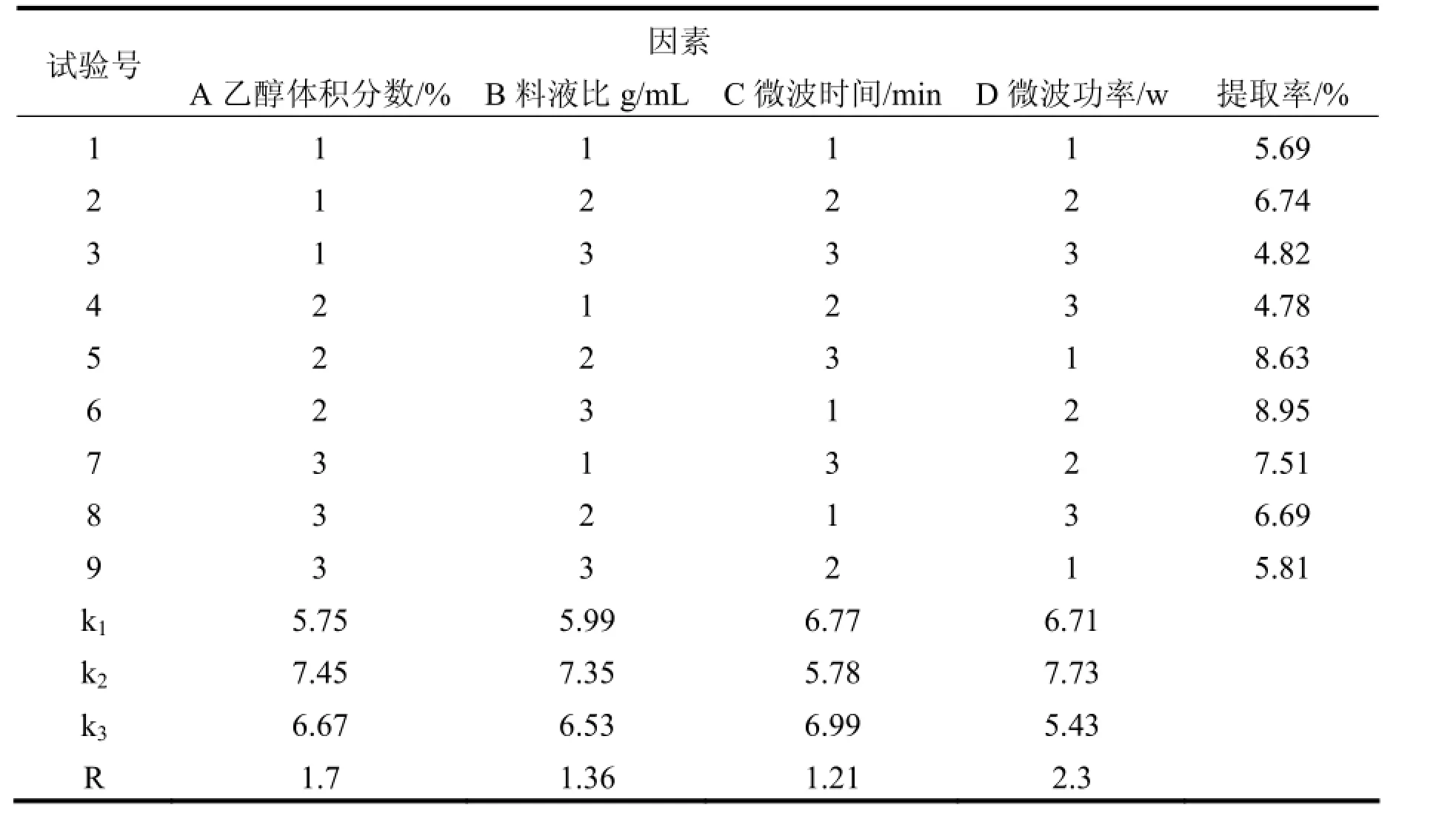
表2 正交试验结果
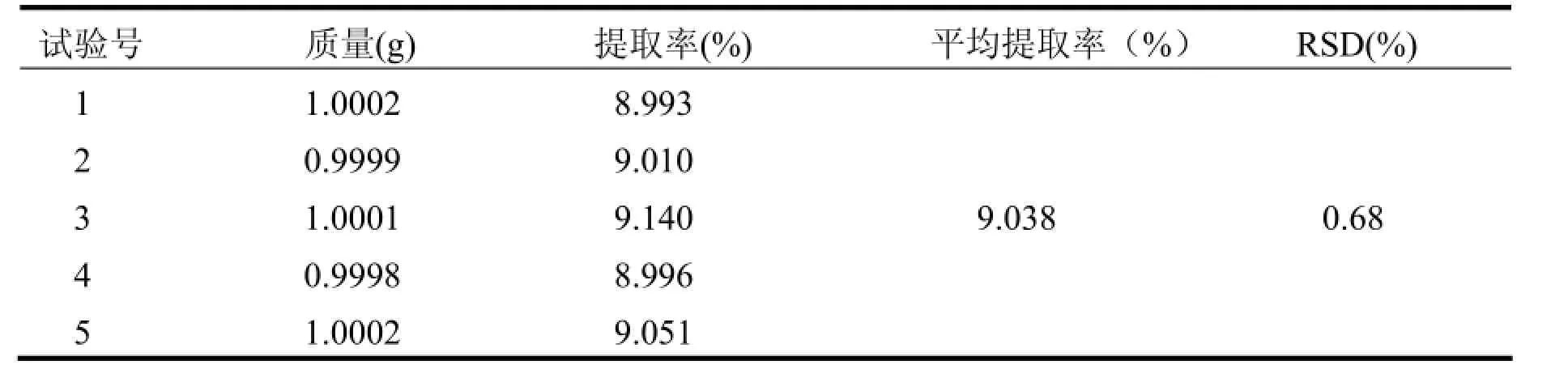
表3 验证实验结果
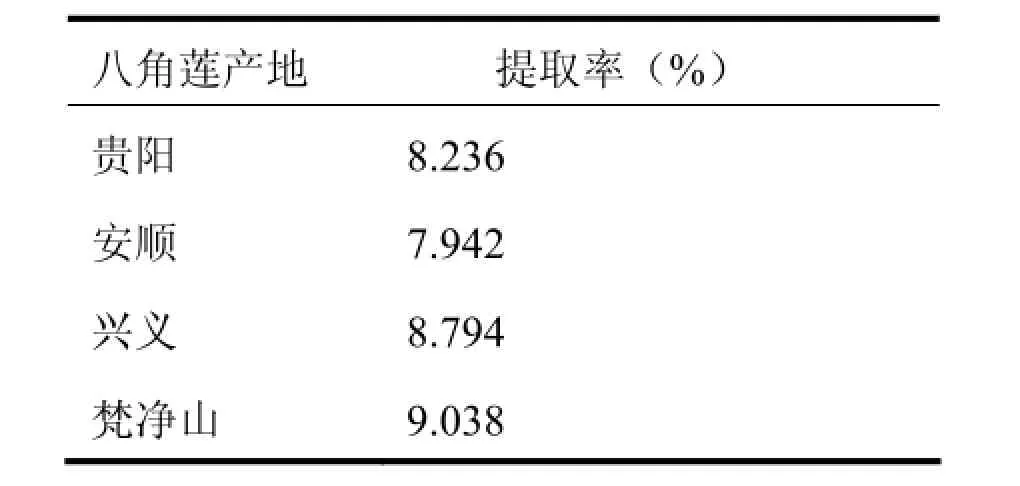
表 4 不同产地八角莲黄酮类化合物的提取率比较
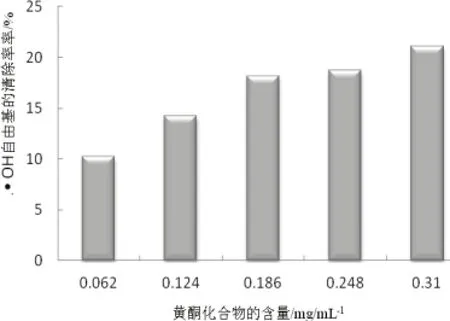
图6 八角莲黄酮类化合物•OH自由基的清除能力
3.6.2.超氧阴离子的清除
由图 7可知,邻苯三酚在碱性情况下自氧化迅速,放出·O2-,当加清除剂后容易清除·O2-,使得邻苯三酚自氧化速度显著降低。由此看出,该文章对邻苯三酚自氧化有很好抑制作用,且随浓度的增加抑制作用加大。

图7 八角莲黄酮类化合物对·O2-的清除能力
3.6.3.POV值测定
由图8可知,随该物质含量增加POV值逐渐减小,POV值小对猪油有氧化抑制作用,POV值越小对猪油有氧化抑制有增强的趋势。初期趋势明显,随后趋势越小,总之,该物质对猪油有极好的抗氧化活性。
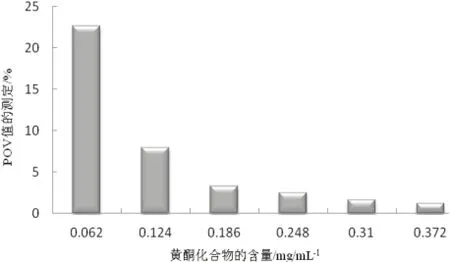
图8 POV值测定
4.结论
通过正交分析得出最佳工艺条件:乙醇浓度30%,料液比1:40g/mL,最佳时间4min,功率264w。此条件下,对贵州不同产地八角莲黄酮类化合物提取,其提取率有所差异,梵净山的稍偏高;并检验抗氧化活性,结果为:八角莲黄酮类化合物对·OH 和·O2-均具有清除作用,通过测定 POV值,得知对猪油氧化有抑制作用,并与含量有关系。
[1]张践,张秀丽,孙成仁,等.八角莲属植物根的比较解剖学研究[J],西华师范大学学报(自然科学版),2008,29 (4):417-420.
[2]李楠.金莲花中黄酮类化合物稳定性研究[J].食品研究与开发,2011,32(11):76-77,103.
[3]李忠超,王武源.濒危药用植物八角莲生态生物学特征[J].热带亚热带植物学报,2006,14(3):190-195.
[4]陈仕学,龚孝芳,冯胜容,等.超声波辅助提取八角莲黄酮类化合物的初步研究[J].广州化工,2014,42(21):99-21.
[5]王永宁,石玉平,郭珍.沙枣花中黄酮类化合物对羟基自由基的清除研究[J].青海医学院报,2003,24(4):281-283.
[6]杨明俊,王亮,吴婧,等.菊芋叶黄酮类化合物的体外抗氧化活性研究[J].贵州农业科学,2011,39(4):52-54.
[7]朱宇旌,李新华,张勇,等.苜蓿黄酮抗氧化性研究[J].沈阳农业大学学报,2006,37(4):615-618.
[8]付莉,彭威威.紫茄皮红色素抗氧化活性的研究[J].中国农学通报,2012,28(24):283-287.
[9]万凌燕,张超.影响动植物油中过氧化值测定的因素[J].计量与测试技术,2009,36(2):64-65.
[10]杨书珍,宁正祥,张友胜.油溶性二氢杨梅素对油脂的抗氧化作用[J].中国油脂,2003,28(1):44-46.
[11]付为琳,杨立刚,孙桂菊.微波萃取在菊花黄酮提取工艺的应用研究[J].食品研究与开发,2008,29(1):1-3.
[12]林燕玲,周文富.微波提取苹果渣中总黄酮的工艺研究[J].应用化学,2011,40(2):311-315.
[13]吴永兰,文耀智,卞杰松,等.微波萃取在苦瓜叶黄酮提取中的工艺研究[J].湖南文理学院学报(自然科学),2010,22(4):29-30.
[14]符稳群,林雨婷.微波辅助萃取百花蛇舌草黄酮的研究[J].安微农业科学,2009,37(30):14680-14681,15088.
[15]阚微娜,谭天伟.微波提取甘草中有效成分的研究[J].中草药,2006,37(1):61-64.
Study on Microwave Extraction Process Optimization and Anti-oxidative Activity of Flavones from The Wild Dysosma Versipellis
CHEN Shi-xue,NIE Wen-dan,QIN Zhi-liang,ZHONG Xin
(School of Material and Chemical Engineering,Tongren University; Key Laboratory of Special Animal and Plant Resource in Fanjing Mountain; Institute of Applied Chemistry,Tongren,Guizhou 554300,China )
The extraction conditions were approached by single factor and orthogonal test for the flavonoids from Dysosma versipellis. The results showed that the optimum extracting conditions were ethanolvolume fraction 40%,solid -liquid ratio 1:30 g/mL,microwave time 4min and microwave power 264w. The flavonoids yield reached 9.038%. In addition,the flavonoids of Dysosma versipellis could scavenge hydroxyl free radical formed in Fenton reaction,Oxygenfree radicals of self oxidation of pyrogallol and lard. Therefore,microwave assistance could be in possession of shorter time,lower energy. Improving efficiency and the oxidation resistance was stronger and high removal capacity of flaovues from Dysosma versipellis.
Dysosma versipellis,flavonoids,microwave extraction,process optimization,anti-oxidative activity
O652
A
1673-9639 (2015) 04-0019-05
(责任编辑 徐松金)(责任校对 毛志)(英文编辑 田兴斌)
2015-06-22
本文系贵州省科学技术基金项目(黔科合LH字[2014]7493),铜仁学院院级学生项目(trxyS1351),贵州省教育厅基金项目“梵净山特色动植物资源保护与利用重点支持学科”(黔教合KY(2011)005)成果。
陈仕学(1976-),女,贵州铜仁人,副教授,硕士,研究方向:生化分离及天然药物研究。
