微波辅助提取蓝莓酒糟中花青素的研究
2015-10-10廖婷婷胡咏梅
廖婷婷,石 彬,肖 兵,许 定,胡咏梅*
(华中农业大学生命科学技术学院农业微生物学国家重点实验室,湖北武汉430070)
微波辅助提取蓝莓酒糟中花青素的研究
廖婷婷,石彬,肖兵,许定,胡咏梅*
(华中农业大学生命科学技术学院农业微生物学国家重点实验室,湖北武汉430070)
通过单因素试验和正交试验对蓝莓酒糟中花青素的提取工艺进行了研究。结果表明,各因素对花青素提取量的影响从大到小依次为乙醇体积分数>微波提取时间>柠檬酸含量>微波功率>液固比;最佳提取条件为乙醇体积分数60%,柠檬酸含量0.6%,液固比60∶1(mL∶g),微波功率420 W,微波提取时间20 s。在此最佳提取条件下,从蓝莓酒糟中可提取花青素(1.847±0.079)mg/g,1次提取率达84.22%。
蓝莓酒糟;花青素;提取工艺;微波辅助
近年来,各种合成色素层出不穷,扰乱了国内外的食品色素市场。合成色素几乎都有不同程度的毒性,长期使用会危害人体健康。因此,人们迫切需要寻求天然无害的色素。花青素的出现无疑给人们带来了希望。花青素(anthocyanin)是构成花瓣和果实颜色的主要色素之一,是一种类黄酮化合物,不仅具有抗氧化、抑制肿瘤、抑制炎症、抗辐射和保护心脏等功效,而且可以有效降低血糖,帮助对抗肥胖以及作为饲料添加剂等[1-3],因而越来越受到科研领域的关注。
鉴于花青素的诸多优点,从植物中提取花青素成为热门[4-12]。花青素的来源很多(如蓝莓、桑葚、紫甘薯和紫玉米等),蓝莓是花青素含量最多的水果。近年来,国内的蓝莓种植面积和产量以年均50%的速度递增。但由于保质期很短,除了作为鲜果销售和加工成果汁、果酱外,蓝莓并没有得到充分的开发和利用,造成大量鲜果积压和腐烂。而用蓝莓酿酒不仅能有效保留蓝莓的营养价值和保健价值,还可充分利用资源,丰富酒类品种,具有很大的竞争力和市场潜力。花青素是一种水溶性色素,可随细胞液的酸碱而改变颜色—细胞液呈酸性则偏红,呈碱性则偏蓝。用蓝莓酿制成的酒多呈宝石红色或琥珀色,不仅在色泽和口感上比蓝莓果、蓝莓汁更具有吸引力,而且蓝莓酒中的花青素和多种营养素更丰富且更易为人体吸收,因而被越来越多的人所接受与推崇。不过,酿造蓝莓酒后的蓝莓酒糟(仍含有2 mg/g左右的花青素,约为鲜果花青素含量的一半)往往被丢弃,不但资源没有得到充分利用,还给环境造成了较大的污染,因此如何充分利用蓝莓酒糟,从中提取出天然无公害的食用色素,是科研工作者亟待解决的难题之一。
目前,提取花青素的方法很多,相对于其他方法来说,微波辅助提取不仅可保持花青素的活性,而且具有设备简单和提取效率快的优点[13-15]。酸化乙醇或甲醇是花青素提取中常用的提取溶剂[16-22],若采用柠檬酸代替盐酸酸化乙醇,可保障提取的花青素更安全。本研究以蓝莓酒糟为原料,研究微波辅助提取蓝莓酒糟中花青素的工艺参数,为天然色素的开发利用提供理论依据,将蓝莓酒糟变废为宝,以期实现资源的最大利用。
1 材料与方法
1.1材料与试剂
蓝莓酒糟:来源于华中农业大学生命科学技术学院发酵工程室,水分含量为75.10%,经冷冻干燥后含水量为2.50%,花青素含量为2.193 mg/g,于-20℃保藏。
冰醋酸、KCl、醋酸钠、浓HCl、无水乙醇、柠檬酸等(均为分析纯):国药集团化学试剂有限公司。
1.2仪器与设备
Alpha 1-2 LD plus冻干机:武汉递爱生物科技公司;中草药粉碎机:天津市泰斯特仪器公司;ST16R台式高速冷冻离心机:北京嘉信恒润科贸公司;722s可见分光光度计:上海精密科学仪器公司;PL303电子天平、FE20实验室pH计:梅特勒-托利多仪器公司;M1-211A美的微波炉:广东美的微波电器制造公司。
1.3试验方法
1.3.1蓝莓酒糟的预处理
将蓝莓酒糟于-20℃冰箱冷冻24 h后,置于冷冻干燥器中,在升华温度为-40℃的条件下冷冻干燥48 h,粉碎后过60目筛,于-20℃冰箱保藏备用。
1.3.2微波辅助提取蓝莓酒糟中花青素的单因素试验
准确称取冷冻干燥后的蓝莓酒糟1.000 g置于锥形瓶中,分别设定不同的乙醇体积分数(20%、40%、60%、80%、100%)、提取时间(10 s、20 s、30 s、50 s、70 s、90 s)、柠檬酸含量(0.2%、0.3%、0.4%、0.5%、0.6%)、液固比(20∶1、30∶1、40∶1、50∶1、60∶1(mL∶g))及微波功率(140 W、280 W、420 W、560 W、700 W)进行提取,室温浸提20 min。考察各影响因素对从蓝莓酒糟中提取花青素的影响。
1.3.3微波辅助提取蓝莓酒糟中花青素的正交试验
根据单因素试验结果,选取L16(54)正交设计进行5因素4水平的正交试验,以花青素含量为评价指标,确定最佳的提取条件。正交试验因素与水平见表1。

表1 提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for extraction conditions optimization
1.3.4花青素含量的测定
(1)缓冲溶液的配制:
根据参考文献[22]配制氯化钾-盐酸缓冲液(pH 1.0)和醋酸-醋酸钠缓冲液(pH 4.5)。
(2)pH示差法测定花青素含量
将蓝莓酒糟花青素的提取液于25℃水浴锅预冷20 min后,4 000 r/min离心10 min,然后用0.45 μm微孔滤膜过滤取滤液。取1.0 mL适当稀释的滤液,分别加入9.0 mL的pH 1.0和pH 4.5的缓冲体系中,分别于波长510 nm和700 nm处测定吸光度值,花青素的提取量计算公式如下:

式中:TAcy为花青素提取量,mg/g;A=(A510nm-A700nm)pH1.0-(A510nm-A700nm)pH4.5;V为滤液总体积,mL;n为稀释倍数;M为矢车菊-3-葡萄糖苷的分子质量,449.2;m为原料质量,g;ε为矢车菊-3-葡萄糖苷的摩尔吸光系数的消光系数,26 900;L为光程,1 cm。
2 结果与分析
2.1微波辅助提取蓝莓酒糟中花青素的单因素试验
2.1.1乙醇体积分数对花青素提取量的影响
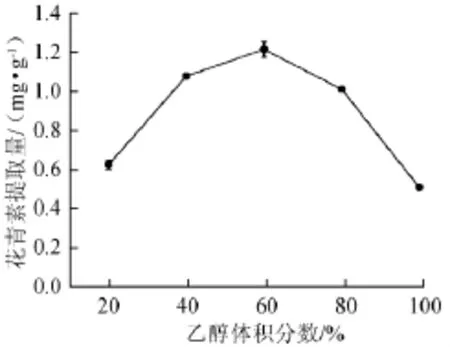
图1 乙醇体积分数对蓝莓酒糟花青素提取量的影响Fig.1 Effects of ethanol concentration on the anthocyanin extraction yield of blueberry wine lees
由图1可知,蓝莓酒糟中花青素的提取量随乙醇体积分数的增加先增大后减小。当乙醇体积分数为60%时,花青素提取量达到最大值,为(1.215±0.040)mg/g。因此,乙醇体积分数60%为宜。
2.1.2提取时间对花青素提取量的影响
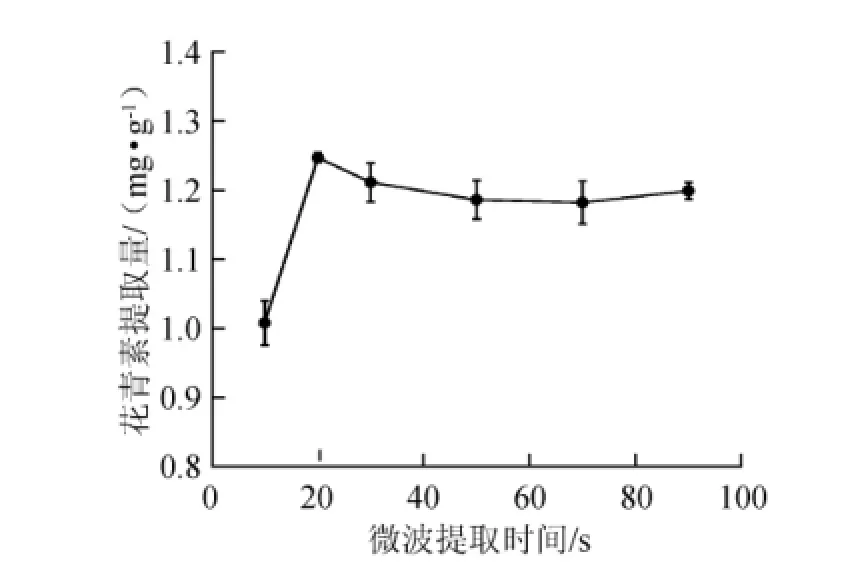
图2 微波提取时间对蓝莓酒糟花青素提取量的影响Fig.2 Effects of extraction time on the anthocyanin extraction yield of blueberry wine lees
由图2可知,在供试的条件下,微波提取20 s时花青素提取量为(1.247±0.007)mg/g,达到最大值。继续延长微波提取时间,花青素提取量不仅没有明显的增加,反而略有下降,分析原因可能是由于微波时间延长后,提取体系中的温度过高导致花青素发生降解,从而影响了花青素的提取量,所以确定20 s作为最佳微波提取时间。
2.1.3溶剂中柠檬酸含量对花青素提取量的影响
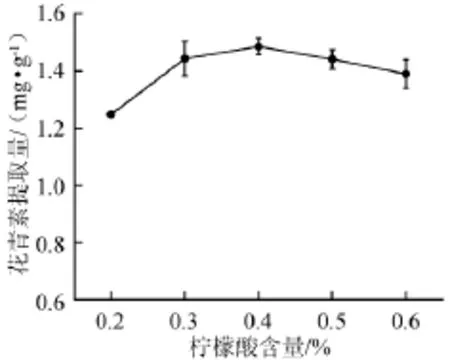
图3 柠檬酸含量对蓝莓酒糟花青素提取量的影响Fig.3 Effects of citric acid concentration on the anthocyanin extraction yield of blueberry wine lees
由图3可知,柠檬酸在提取溶剂乙醇中的含量为0.4%时,花青素提取量达到峰值,为(1.485±0.028)mg/g。因此,柠檬酸含量0.4%为宜。
2.1.4液固比对花青素提取量的影响

图4 液固比对蓝莓酒糟花青素提取量的影响Fig.4 Effects of liquid-to-solid ratio on the anthocyanin extraction yield of blueberry wine lees
由图4可知,在柠檬酸含量为0.4%的条件下,在一定的范围内,随着液固比的增大,花青素提取量不断提高,当液固比为50∶1(mL∶g)时,花青素的提取量达到最大,为(1.507±0.029)mg/g。继续增大液固比时,花青素的提取量反而有所降低。因此,适宜的液固比为50∶1(mL∶g)。
2.1.5微波功率对花青素提取量的影响
由图5可知,在柠檬酸含量为0.4%,液固比为50∶1(mL∶g)的条件下,在一定的范围内,随着微波功率的增长,花青素提取量不断提高,当微波功率为420 W时花青素提取量达到峰值,为(1.690±0.053)mg/g。继续增大微波功率,花青素提取量下降。因此,微波功率为420 W时为宜。
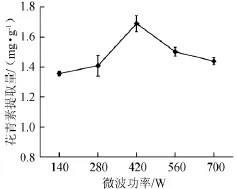
图5 微波功率对蓝莓酒糟花青素提取量的影响Fig.5 Effects of extraction power on the anthocyanin extraction yield of blueberry wine lees
采用SPSS软件对单因素试验进行方差分析,结果表明,各因素对花青素提取的影响程度排序为:乙醇体积分数(P<0.01)>提取时间(P<0.01)>微波功率(P<0.01)>柠檬酸含量(P<0.01)>液固比(0.01<P<0.05)。
2.2微波辅助提取蓝莓酒糟中花青素的正交试验
2.2.1正交试验结果与方差分析
根据单因素试验及其方差分析的结果,选取L16(45)正交表进行正交试验,以花青素提取量为考察指标,确定最佳的提取条件。正交试验结果与分析见表2,方差分析见表3。

表2 提取条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal tests for extraction conditions optimization

表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal test results
正交试验结果(表2)和方差分析(表3)结果表明,各因素对花青素提取量的影响程度由大到小依次为乙醇体积分数>微波提取时间>柠檬酸含量>微波功率>液固比。在5个因素中,乙醇体积分数,提取时间和柠檬酸含量对花青素的影响为显著水平(P<0.05),而微波功率和液固比的影响不显著,说明在花青素提取中,溶剂和提取时间极为重要。通过极差分析得到的正交最优组合为A2B3C2D4E4,即乙醇体积分数为60%,微波提取时间20 s,微波功率为420 W,柠檬酸含量0.6%,液固比60∶1(mL∶g)。在此最佳条件下进行验证试验,花青素提取量为(1.847±0.079)mg/g。
2.2.2微波辅助提取蓝莓酒糟花青素的得率
为探究蓝莓酒糟中的花青素绝对含量以及该工艺的首次提取率,在最优提取条件下对蓝莓酒糟共进行了4次提取。如图6所示,第4次提取时花青素的提取量接近零。合计4次提取量可知供试蓝莓酒糟中花青素的总含量为2.193 mg/g;在最优提取条件下,花青素的1次提取率可达84.22%。

图6 提取次数对蓝莓酒糟花青素提取量的影响Fig.6 Effects of extraction times on the anthocyanin yield of blueberry lees
3 结论
本试验采用微波辅助对蓝莓酒糟中的花青素提取工艺进行了研究。在单因素试验的基础上,采用L16(45)正交表进行了5因素4水平的正交试验,对花青素的提取工艺进行了优化。研究结果表明,各因素对花青素提取量的影响从大到小依次为:乙醇体积分数>微波提取时间>柠檬酸含量>微波功率>液固比。最佳提取条件为乙醇体积分数60%,微波提取时间20 s,微波功率为420 W,乙醇中柠檬酸含量0.6%,液固比60∶1(mL∶g)。在此最佳提取条件下得到花青素提取量为(1.847±0.079)mg/g,1次提取率达到84.22%。
本研究采用微波辅助提取蓝莓酒糟中的花青素,有以下几个方面的优势:其一,在方法上,采用微波辅助提取,与传统溶剂提取相比,花青素提取率提高了15个百分点,并且操作简单,耗时短,与ZOU T等[23]中的结果相符;其二,在溶剂方面,采用乙醇为提取剂,相对常用的甲醇和丙酮而言,更安全,提取的花青素可用于食品、医用以及化妆品等方面,增加了花青素使用的广泛性,而且,用柠檬酸替代普遍使用的乙醇酸化剂盐酸,能有效避免Cl-污染;其三,从原料上看,目前国内外直接从水果中提取花青素的研究报道较多,而从蓝莓酒糟中提取花青素较少。蓝莓酒糟中还有较多未能完全浸入到酒中的花青素,直接丢弃既浪费资源又污染环境。
本研究采用单因素试验和正交试验对蓝莓酒糟中花青素的提取工艺作了初步的研究,为工业化生产的蓝莓酒糟的利用奠定了良好的基础。在此基础上,可采用响应面试验设计作进一步的研究,并找到合适的纯化方法对花青素提取液进行纯化,以得到高纯度的花青素产品。
[1]GIUSEPPE M.Anthocyanins and heart health[J].Ann Ist Super Sanita,2007,43(4):369-374.
[2]BUCKOW R,KASTELL A,SHIFERAW N,et al.Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J].J Agr Food Chem,2010,58(18):10076-10084.
[3]RUENROENGKLIN N,ZHONG J,DUAN X,et al.Effects of various temperatures and pH values on the extraction yield of phenolics from litchi fruit pericarp tissue and the antioxidant activity of the extracted anthocyanins[J].Int J Mol Sci,2008,9(7):1333-1341.
[4]BORNSEK S M,ZIBERNA L,POLAK T,et al.Bilberry and blueberry anthocyanins act as powerful intracellular antioxidants in mammalian cells[J].Food Chem,2012,134(4):1878-1884.
[5]RUGINA D,SCONTA Z,LEOPOLD L,et al.Antioxidant activities of chokeberry extracts and the cytotoxic action of their anthocyanin fraction on HeLa human cervical tumor cells[J].J Med Food,2012,15(8):700-706.
[6]CHEN P N,CHU S C,CHIOU H L,et al.Mulberry anthocyanins,cyanidin 3-rutinoside and cyanidin 3-glucoside,exhibited an inhibitory effect on the migration and invasion of a human lung cancer cell line[J].Cancer Lett,2006,235(2):248-259.
[7]ESPOSITO D,CHEN A,GRACE M H,et al.Inhibitory effects of wild blueberry anthocyanins and other flavonoids on biomarkers of acute and chronic inflammationin vitro[J].J Agr Food Chem,2014,62(29):7022-7028.
[8]FAN Z L,WANG Z Y,ZUO L L,et al.Protective effect of anthocyanins from lingonberry on radiation-induced damages[J].Int J Environ Res Public Health,2012,9(12):4732-4743.
[9]LIU W,LU X,HE G,et al.Cytosolic protection against ultraviolet induced DNA damage by blueberry anthocyanins and anthocyanidins in hepatocarcinoma HepG2 cells[J].Biotech Lett,2013,35(4):491-498.
[10]JEONG J W,LEE W S,SHIN S C,et al.Anthocyanins downregulate lipopolysaccharide-Induced inflammatory responses in BV2 microglial cells by suppressing the NF-kB and Akt/MAPKs signaling pathways[J]. Int J Mol Sci,2013,14(1):1502-1515.
[11]JOHNSON H M,DEMEJIA E G,FAN J,et al.Anthocyanins and proanthocyanidins from blueberry-blackberry fermented beverages inhibit markers of inflammation in macrophages and carbohydrate-utilizing enzymesin vitro[J].Mol Nutr Food Res,2013,57(7):1182-1197.
[12]KAEWKAEN P,TONG T,WATTANATHORN J,et al.Mulberry fruit extract protects against memory impairment and hippocampal damage in animal model of vascular dementia[J].Evid Based Complement Alternat Med,2012,8:1-9.
[13]WU T,TANG Q,GAO Z,et al.Blueberry and mulberry juice prevent obesity development in C57BL/6 mice[J].Plos One,2013,8(10):1-7.
[14]徐俊杰,姜艳霞,张巍,等.微波辅助提取越橘果实花色苷的工艺优化[J].安徽农业科学,2011,39(28):17232-17234.
[15]张学宁,高志华,刘庆忠,等.蓝莓花色苷提取工艺的优化研究[J].河北工业科技,2013,30(2):66-72.
[16]潘利华,王建飞,叶兴乾,等.蓝莓花青素的提取工艺及其免疫调节活性[J].食品科学,2014,35(2):81-86.
[17]权静.蓝莓花色苷提取工艺及稳定性研究[J].广州化工,2012,40(16):113-115.
[18]孙婧超,赵玉平,欧燕,等.pH示差法测定蓝莓酒中花色苷条件的优化[J].中国酿造,2011,30(11):171-174.
[19]宋德群,孟宪军,王晨阳,等.蓝莓花色苷的pH示差法测定[J].沈阳农业大学学报,2013,44(2):231-233.
[20]王秀菊,杜金华,马磊,等.蓝莓酒渣中花色苷提取工艺的优化及其稳定性的研究[J].食品与发酵工业,2009,35(9):151-156.
[21]OSSEINIAN F S,BETA T.Saskatoon and wild blueberries have higher anthocyanincontentsthan other manitoba berries[J].J Agr Food Chem,2007,55(26):10832-10838.
[22]左勇,李杨,谢晖,等.桑椹果酒酒糟中原花青素提取工艺研究[J].中国酿造,2012,31(8):40-44.
[23]ZOU T,WANG D,GUO H,et al.Optimization of microwave-assisted extraction of anthocyanins from mulberry and identification of anthocyanins in extract using HPLC-ESI-MS[J].J Food Sci,2012,77(1): C46-C50.
Optimization of microwave-assisted extraction process for anthocyanin from blueberry wine lees
LIAO Tingting,SHI Bin,XIAO Bing,XU Ding,HU Yongmei*
(State Key Laboratory of Agricultural Microbiology,College of Life Science and Technology,Huazhong Agricultural University,Wuhan 430070,China)
The extraction conditions of anthocyanin from blueberry wine lees were studied by single factor and orthogonal experiment.The results showed that the effect of each factor on the extraction of anthocyanin in order was ethanol concentration,extraction time,citric acid content,microwave power,and liquid-to-solid ratio.The optimum conditions were confirmed as follows:ethanol concentration 60%,citric acid concentration 0.6%,liquid-solid ratio 60∶1(ml:g),microwave power 420 W,extraction time 20 s.Under the optimal extraction conditions,the yield of anthocyanin was(1.847±0.079)mg/g and the extraction rate reached 84.22%.
blueberry wine lees;anthocyanin;extraction process;microwave-assisted
TS252.54
A
0254-5071(2015)10-0111-05
10.11882/j.issn.0254-5071.2015.10.025
2015-09-12
国家基金委国家基础科学人才培养基金项目(No.201315)
廖婷婷(1990-),女,硕士研究生,研究方向为生理活性物质的开发与应用。
胡咏梅(1973-),女,副教授,博士,研究方向为应用微生物。
