引入中性氨基酸对木聚糖酶XynZF-2热稳定性的影响
2015-10-10陈亚文周晨妍谢晶晶索婧琪魏阳阳李同彪
陈亚文,周晨妍*,谢晶晶,索婧琪,魏阳阳,李同彪
(新乡医学院生命科学技术学院,河南新乡453003)
引入中性氨基酸对木聚糖酶XynZF-2热稳定性的影响
陈亚文,周晨妍*,谢晶晶,索婧琪,魏阳阳,李同彪
(新乡医学院生命科学技术学院,河南新乡453003)
通过对黑曲霉(Aspergillus niger)XZ-3S木聚糖酶XynZF-2进行生物信息学分析,在N-端区域引入半胱氨酸,定点突变E27C,构建突变基因xyn-E27C,并在大肠杆菌BL21(DE3)中表达。酶学性质分析发现,突变酶Xyn-E27C的最适温度为45℃,与原酶XynZF-2相比提高了5℃。在40℃条件下,突变酶Xyn-E27C的半衰期t1/240℃为100 min,相比原酶XynZF-2(t1/245℃=55 min)提高了45 min。在45℃条件下,突变酶Xyn-E27C的半衰期t1/245℃为24 min,相比原酶XynZF-2(t1/245℃=7 min)提高了17 min;突变酶Xyn-E27C的最适pH值由5.0提高至5.5,而pH稳定范围均为5.0~9.0。因此,定点突变E27C对木聚糖酶XynZF-2的热稳定性以及最适pH值均有重要影响。
木聚糖酶;热稳定性;定点突变;中性氨基酸
木聚糖酶(EC 3.2.1.8)是催化水解木聚糖β-1,4糖苷键的一类多功能酶总称[1],产物主要是低聚木糖,有时还有少许的阿拉伯糖、木糖等成分[2]。木聚糖酶是木聚糖降解酶中最关键的酶[3],其广泛分布于各种生物体中,如海洋藻类、细菌、真菌、酵母、甲壳动物、陆地植物以及各种无脊椎动物[4]等,目前研究的木聚糖酶主要来源于微生物[5]。
在工业应用方面,木聚糖酶具有很大的潜力和价值,它是一种重要的酶制剂,广泛应用于食品加工、纸浆漂白、制药、饲料添加剂、医药、纺织、生物转化等行业[6]。一般来说,在工业应用上的酶都需要高催化活性、耐高温等性质。如在纸浆漂白工艺中添加木聚糖酶,可以增加纸张白度,改善纸张性能,降低漂白用化学物质用量,减少造纸业对环境的污染等[7]。而工业上纸浆漂白需要60℃左右处理过程,自然界中的木聚糖酶大多属于中温木聚糖酶,难以达到其工业需求[8]。因此,对于木聚糖酶的热稳定性改造已成为广泛关注的热点[9]。研究表明,很多因素可以影响木聚糖酶的热稳定性(如二硫键、氢键、疏水作用、离子键等[10])。GH11家族木聚糖酶具有分子质量小、底物特异性高、空间结构为右手半握形状、结构比较简单等特点[11]。N端区域是影响GH11家族的热稳定性的重要因素,如DUMAN C等[12]对GH11家族木聚糖酶(EvXyn11TS)N端的7个氨基酸进行定点突变(T13F、S9P、N14H、Y18F、Q34L、S35E和S71T),突变酶比野生酶的Tm值提高了约25℃。LEEY E等[13]将木聚糖酶XynA的N-端删除,发现突变酶热稳定性丧失但活性不变,可确定木聚糖酶的N-端是其热稳定性区。
来源于黑曲霉(Aspergillus niger)XZ-3S的木聚糖酶XynZF-2属于GH11家族中温木聚糖酶,木聚糖酶基因xynZF-2已由本实验室分离,并构建在pET-28a-xynZF-2保存[14]。该研究在对xynZF-2基因进行生物信息学分析的基础上,选择N-端的第27位点氨基酸进行定点突变(E27C),在大肠杆菌BL21(DE3)中诱导表达,期望提高木聚糖酶XynZF-2的热稳定性,为该酶的后续研究奠定基础。
1 材料与方法
1.1材料与试剂
菌种:黑曲霉(Aspergillus niger)XZ-3S:本实验室保存。大肠杆菌JM109、BL21(DE3)及表达质粒pET-28a:Novagen公司。
质粒:重组质粒pET-28a-xynZF-2:本实验室构建并保存。
工具酶和生化试剂:T4脱氧核糖核酸链接酶(T4 deoxyribonucleic acidligase,T4DNALigase)、限制性内切酶、DL1000 DNA Marker、异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)以及5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-bromo-4-chloro-3-indolyl β-D-galactopyranoside,x-gal):TaKaRa公司;DNA质粒提取试剂盒:生工生物工程(上海)有限公司;蛋白分子量标准:碧云天生物技术有限公司;DNA片段回收试剂盒:北京鼎国昌盛生物技术公司;其他化学试剂为国产或进口分析纯。
1.2仪器与设备
C1000梯度PCR扩增仪:美国Bio-Rad公司;DYY-2稳压稳流电泳仪:北京市六一仪器厂;DC-0506低温恒温槽:上海比朗仪器有限公司;HZQ-F160A恒温振荡器:上海一恒科学仪器有限公司;Neofuge 23R高速冷冻离心机:上海力申科学仪器有限公司。
1.3方法
1.3.1同源序列比对以及同源建模
通过ProtParam程序(http://web.expasy.org/protparam/)分析木聚糖酶的理化性质,利用Phyre2对木聚糖酶同源建模,并通过DS ViewerPro6.0分析木聚糖酶三维结构。
1.3.2定点突变和重组表达载体pET-28a-xyn-E27C构建
以pET-28a-xynZF-2为模板,采用重叠延伸聚合酶链式反应(gene splicing by overlap extension polymerase chain reaction,SOE PCR)法[15],引物见表1,扩增得到突变基因E27C,割胶回收。EcoRⅠ、HindⅢ限制性内切酶对突变基因E27C和空质粒pET-28a进行双酶切,37℃、3 h,电泳酶切产物,切胶回收。用T4 DNA Ligase连接以上两种双酶切产物,16℃过夜,转化大肠杆菌BL21(DE3),涂布于含卡那霉素(kalamycin,Kan)抗性的LB固体培养基,构建重组大肠杆菌BL21-pET-28a-xyn-E27C。筛选阳性单克隆菌落,提取重组质粒进行验证,送金唯智公司测序。

表1 突变基因引物Table 1 The primers of mutated gene
1.3.3重组木聚糖酶XynZF-2和Xyn-E27C的表达与纯化
IPTG诱导表达重组菌株BL21/pET-28a-xyn-E27C,采用超声波细胞破碎等方法提取粗酶液,具体方法见参考文献[16]。采用镍金属螯合亲和层析柱纯化重组木聚糖酶XynZF-2和Xyn-E27C,收集洗脱样品液,即为重组原酶XynZF-2和突变酶Xyn-E27C,对XynZF-2、Xyn-E27C进行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测(5%浓缩胶,15%分离胶)[17]。
1.3.4重组木聚糖酶活性测定
木聚糖酶活性测定:3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[18]。添加1 mL适当稀释的酶液于1.5 mL的0.5%桦木木聚糖溶液中,40℃水浴反应15 min,加DNS终止反应,测定OD值。将此反应条件下每分钟产生1 μmol还原糖所需的酶量定义为1个单位,U。
1.3.5重组木聚糖酶酶学性质比较及分析
对纯化后的重组原酶(XynZF-2)和突变酶(Xyn-E27C)进行酶学性质分析,测定温度和pH值对重组木聚糖酶酶活性的影响[17]。
2 结果与分析
2.1重组木聚糖酶同源序列比对建模及突变位点确定
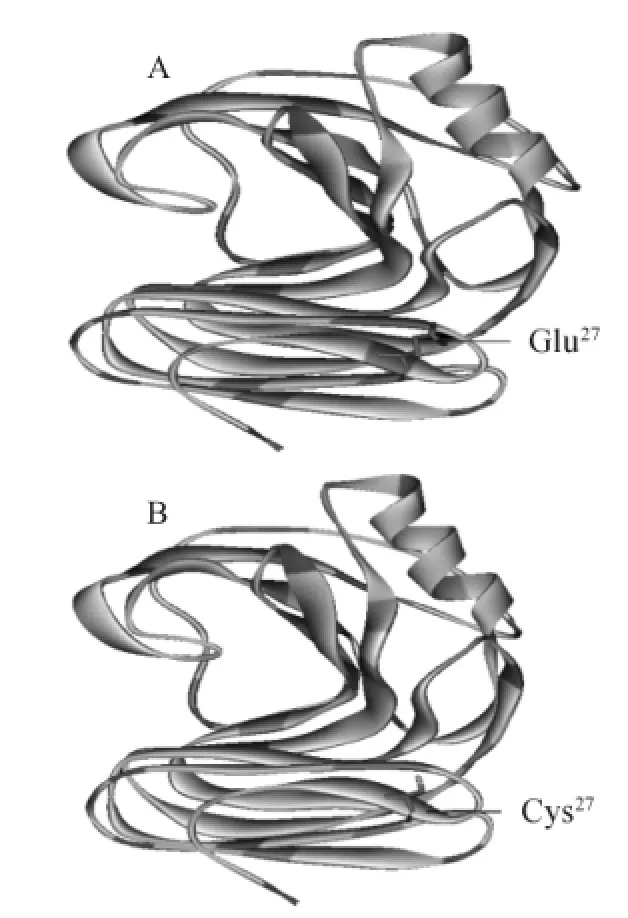
图1 XynZF-2(A)与Xyn-E27C(B)同源建模Fig.1 Homology modeling of XynZF-2(A)and Xyn-E27C(B)
将原酶XynZF-2和突变酶Xyn-E27C的氨基酸序列提交到Phyre2,分别自动同源序列比对建模,结果如图1所示,原酶XynZF-2和突变酶Xyn-E27C基本相似,都是由1个α-螺旋和2个β-折叠片层组成,属于GH11家族木聚糖酶。利用DNAMAN6.0以及DS ViewerPro6.0对氨基酸序列、木聚糖酶XynZF-2结构分析,发现在N-端的β-折叠区域的B1链从第22个氨基酸开始到第29氨基酸结束,依次为:PSSTGENN,由此发现,除第27位点的谷氨酸带负电荷外,其他氨基酸均不带电的中性氨基酸,为稳定B1链与酶分子内外部的相互作用,将第27位点带负电荷的谷氨酸随机突变为相对分子质量相近且不带电荷的中性氨基酸(半胱氨酸)。
2.2定点突变和重组表达载体构建
采用重叠延伸PCR对突变基因E27C进行扩增,琼脂糖凝胶电泳PCR产物(见图2、图3)。通过DNAMAN6.0对突变基因E27C限制性酶切位点进行分析,发现突变基因E27C不含EcoRⅠ、HindⅢ酶切位点,利用引物对突变基因E27C引入EcoRⅠ、HindⅢ酶切位点,通过EcoRⅠ、HindⅢ双酶切将突变基因E27C克隆在载体pET-28a上,构建重组表达载体。
图2 突变基因xyn-E27C上下游片段PCR扩增Fig.2 PCR amplification of the upstream and downstream fragments of mutated genexyn-E27C
图3 突变基因xyn-E27C的PCR扩增Fig.3 PCR amplification of mutated genexyn-E27C
2.3重组木聚糖酶在大肠杆菌中表达和纯化
将重组质粒pET-28a-xyn-E27C转化大肠杆菌BL21(DE3),构建大肠杆菌工程菌。经IPTG诱导表达,通过细胞破碎提取粗酶液,对含有His6标签的原酶和突变酶,经镍金属螯合亲及层析柱法得到纯化的重组木聚糖酶,用SDS-PAGE蛋白电泳检测纯化的木聚糖酶XynZF-2和Xyn-E27C。由图4可见,原酶XynZF-2和突变酶Xyn-E27C均在32 ku处有明显条带,突变酶Xyn-E27C在相对分子质量上与原酶XynZF-2一致。

图4 木聚糖酶XynZF-2和Xyn-E27C的SDS-PAGE分析Fig.4 SDS-PAGE analysis of XynZF-2 and Xyn-E27C
2.4酶学性质比较与分析
2.4.1重组木聚糖酶与原酶最适温度及热稳定性比较
按1.3.5方法测定原酶与突变酶最适温度(Topt)结果如图5所示,突变酶Xyn-E27C的Topt为45℃,较原酶XynZF-2(Topt=40℃)提高了5℃,最适温度有一定提高。由图6可见,40℃保温1 h,突变酶Xyn-E27C相对酶活性下降至保温处理前的61.8%,较原酶XynZF-2(42.0%)有大幅度的提高,且突变酶Xyn-E27C的半衰期t1/240℃为100 min,相比原酶XynZF-2(t1/245℃=55 min)提高了45 min。在45℃条件下突变酶Xyn-E27C的半衰期t1/245℃为24 min,相比原酶XynZF-2(t1/245℃=7 min)提高了14 min。可见,突变酶Xyn-E27C相比原酶XynZF-2热稳定性明显改善。
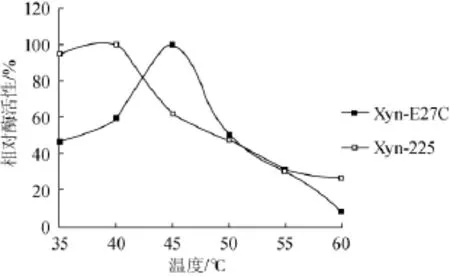
图5 重组木聚糖酶最适温度的比较Fig.5 Comparison of the optimum temperature of recombinant xylanase
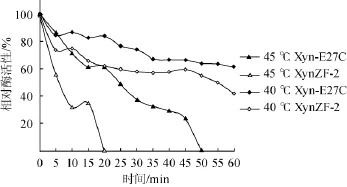
图6 重组木聚糖酶热稳定性比较Fig.6 Comparison of thermal stability of recombinant xylanase
2.4.2重组木聚糖酶与原酶最适pH及pH稳定性比较
分析pH对XynZF-2和Xyn-E27C酶活性的影响发现,突变酶Xyn-E27C的最适pH值为5.5(原酶XynZF-2,pH 5.0)(图7),最适pH有明显改变,而在pH 5.0~9.0,两种酶的残余酶活性都在80%以上,pH稳定性基本不变(图8)。
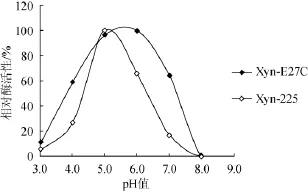
图7 重组木聚糖酶最适pH的比较Fig.7 Comparison of the optimal pH for recombinant xylanase
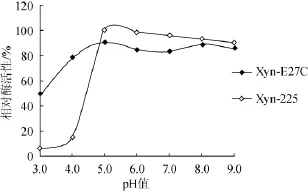
图8 重组木聚糖酶pH的稳定性比较Fig.8 Comparison of the stability of recombinant xylanase pH
2.5讨论
通过生物信息学等方法,在Phyre2上对XynZF-2同源建模,并用DS ViewerPro6.0观察分析建模结果,发现XynZF-2属于GH11家族木聚糖酶,在原酶XynZF-2的B1链上引入中性氨基酸,增加中性氨基酸含量,降低了B1链上的氨基酸在溶液中的溶解度,从而减少了B1链与溶液中水分子的相互作用,有利于维持蛋白分子完整的空间构象,稳定分子内部构象。为了进一步减少B1链与水分子的相互作用,增强分子内部稳定性,以稳定B1链的构象,从而稳定酶分子整体的构象,这可能是突变酶Xyn-E27C热稳定性得到提高的重要因素。
在如今的工业应用中,对耐高温木聚糖酶应用和需求越来越广泛。木聚糖酶作为一种重要的酶制剂在许多工业应用环节之中具有潜力和价值,对木聚糖酶的热稳定性改造已成为广泛关注的热点[9]。随着生物技术的不断发展,按照人类需求把木聚糖酶改造成符合工业要求的酶已经成为可能影响木聚糖酶热稳定性的因素有很多。研究表明,GH11家族木聚糖酶的N-端区域对其热稳定有重要的作用,很多研究已通过对木聚糖酶N-端氨基酸定点突变,改善了其热稳定性[19],如XIONG H R等[20]对里氏木霉来源的木聚糖酶N端和中部β-折叠处引入二硫键,在65℃条件下,突变酶DBl的半衰期比野生酶提高约112倍。运用生物信息学的方法分析比对木聚糖酶的分子结构,可以有效确定与热稳定相关区域,为木聚糖酶分子的改造提供了便利。
3 结论
本研究通过对XynZF-2进行生物信息学分析,将第27个位点的谷氨酸突变为半胱氨酸,使突变酶Xyn-E27C的最适温度相比原酶XynZF-2提高了5℃。突变酶Xyn-E27C的半衰期t1/245℃,相比原酶增加了17 min,酶的热稳定性得到了很大提高。这为木聚糖酶Xyn-E27C后续的研究提供了理论依据。
[1]CHEN X Z,XU S Q,ZHU M S,et al.Site-directed mutagenesis of anAspergillus nigerxylanase B and its expression,purification and enzymatic characterization inPichia pastoris[J].Process Biochem,2010,45(1):75-80.
[2]LI H,KANKAANPÄÄ A,XIONG H R,et al.Thermostabilization of extremophilicDictyoglomus thermophilumGH11 xylanase by an N-terminal disulfide bridge and the effect of ionic liquid[emim]OAc on the enzymatic performance[J].Enzyme Microb Tech,2013,53(6):414-419.
[3]KULKARNI N,SHENDYE A,RAO M.Molecular and biotechnological aspectsofxylanases[J].Fems Microbiology Reviews,1999,23:411-456.
[4]周晨妍,王武,邬敏辰.Arg引入“Ser/Thr”平面对木聚糖酶XynⅡ热稳定性的影响[J].西北农林科技大学学报:自然科学版,2010,38(1):46-51.
[5]李秀婷.微生物木聚糖酶及在食品工业中的应用[J].农业机械学报,2008,39(2):175-179.
[6]XUE H P,ZHOU J G,YOU C,et al.Amino acid substitutions in the N-terminus,cord andα-helix domains improved the thermostability of a family 11 xylanase XynR8[J].J Ind Microbiol Biot,2012,39(9):1279-1288.
[7]VERMA D,SATYANARAYANA T.Molecular approaches for ameliorating microbial xylanases[J].Bioresource Technol,2012,117:360-367.
[8]BEG Q,KAPOOR M,MAHAJAN L,et al.Microbial xylanases and their industrial applications:a review[J].Appl Microbiol Biot,2001,56:326-338.
[9]ZHANG H M,LI J F,WANG J Q,et al.Determinants for the improved thermostability of a mesophilic family 11 xylanase predicted by computational methods[J].Biotechnology for Biofuels,2014,7(3):1-10.
[10]KUMAR S,TSAI C J,NUSSINOV R.Factors enhancing protein thermostability[J].Protein Eng,2000,13(3):179-191.
[11]YIN X,YAO Y,WU M C,et al.A unique disulfide bridge of the thermophilic xylanase SyXyn11 plays a key role in its thermostability[J]. Biochemistry,2014,79(6):675-683.
[12]DUMON C,VARVAK A,WALL M A,et al.Engineering hyperthermostability into a GH11 xylanase is mediated by subtle changes to protein structure[J].J Biol Chem,2008,283:22557-22564.
[13]LEE Y E,LOWE S E,HENRISSAT B,et al.Characterization of the active site and thermostabilityregions of endoxylanase fromThermoanaerobacterium saccharolyticumB6A-RI[J].J Bacteriol,1993,175(18): 5890-5898.
[14]FU G H,WANG Y T,WANG D D,et al.Cloning,expression,and characterization of an GH11 xylanase fromAspergillus nigerXZ-3S[J].Indian J Microbiol,2012,52(4):682-688.
[15]雒丽娜,王盛,王玉炯.利用重叠延伸PCR技术进行定点突变研究[J].安徽农业科学,2012(10):5779-5781.
[16]李同彪,周晨妍,朱新术,等.V1C定点突变木聚糖酶XynZF-2对酶热稳定性的影响[J].食品与发酵工业,2015,41(4):167-171.
[17]付冠华,刘振华,王丹丹,等.黑曲霉木聚糖酶(xynZF-2)基因克隆、表达及酶学性质分析[J].中国酿造,2012,31(11):78-82.
[18]TAN Z B,TANG C D,WU M C,et al.Exploration of disulfide bridge and N-glycosylation contributing to high thermostability of a hybrid xylanase[J].Protein Peptide Lett,2014,21(9):657-662.
[19]SONG L T,DUMON C,SIGUIER B,et al.Impact of an N-terminal extension on the stability and activity of the GH11 xylanase fromThermobacillus xylanilyticus[J].J Biotechnol,2014,174:64-72.
[20]XIONG H R,FENEL F,LEISOLA M,et al.Engineering the thermostability ofTrichoderma reeseiendo-1,4-β-xylanase II by combination of disulfide bridges[J].Extremophiles,2004,8(5):393-400.
Effect of introducing neutral amino acids residues on the thermostability of xylanases XynZF-2
CHEN Yawen,ZHOU Chenyan*,XIE Jingjing,SUO Jingqi,WEI Yangyang,LI Tongbiao
(School of Life Science and Technology,Xinxiang Medical University,Xinxiang 453003,China)
The xylanase XynZF-2 fromAspergillus nigerXZ-3S was analyzed by bioinformatics.Neutral amino acids residues(Cys)were introduced at the N-terminus.The mutated genexyn-E27Cwas amplified by site-directed mutagenesis ofE27Cand expressed inEscherichia coliBL21(DE3). According to the enzyme properties analysis and compared to the recombinant XynZF-2,results showed that the optimum temperature of mutant Xyn-E27C was 45℃,which was increased by 5℃.At 40℃,compared to XynZF-2(t1/245℃=55 min),the t1/245℃of the mutated Xyn-E27C was 100 min,which was increased by 45 min.At 45℃,compared to XynZF-2(t1/245℃=7 min),the half-life of the mutated Xyn-E27C was 24 min,which was increased by 17 min.The optimum pH of mutated Xyn-E27C was increased from 5.0 to 5.5,while the pH stability range was from pH 5.0 to 9.0.Therefore,E27C site-directed mutagenesis had important effect on the thermal stability and pH of xylanase XynZF-2.
xylanase;thermostability;site-directed mutagenesis;neutral amino acids residues
Q55
A
0254-5071(2015)10-0027-05
10.11882/j.issn.0254-5071.2015.10.007
2015-09-22
国家级大学生创新创业训练计划项目(201410472028);河南省教育厅科学技术研究重点项目(13A180861);河南省高等学校青年骨干教师资助计划项目(2011GGJS-125);新乡医学院科研项目培育基金(2013ZD113)
陈亚文(1993-),女,本科生,研究方向为生物工程。
周晨妍(1979-),女,副教授,博士,研究方向为微生物酶工程。
