康氏木霉固体发酵木聚糖酶条件的研究
2015-10-10易旭东林元山
冯 波,尹 翌,2,易旭东,林元山,2*
(1.湖南农业大学生物科学技术学院,湖南长沙410128;2.长沙水地沙生物科技有限公司,湖南长沙410125)
康氏木霉固体发酵木聚糖酶条件的研究
冯波1,尹翌1,2,易旭东1,林元山1,2*
(1.湖南农业大学生物科学技术学院,湖南长沙410128;2.长沙水地沙生物科技有限公司,湖南长沙410125)
通过固体发酵培养,经单因素及正交试验分析,得出康氏木霉发酵产木聚糖酶最优条件组合为:麸皮与玉米芯质量比为2∶8,硫酸铵2.5%,MnSO40.50%,料水比1∶1.5(g∶mL),培养基初始pH自然,培养温度30℃,发酵时间6 d。在此条件下,康氏木霉固体发酵木聚糖酶活力达11.98 IU/g。该木聚糖酶水解产物富含2~5个木糖分子的低聚木糖。
康氏木霉;木聚糖酶;固体发酵;优化
木聚糖(xylan)是自然界中含量非常丰富的一类多糖,仅次于纤维素。木聚糖结构十分复杂,包含有多种不同的侧链基团,需要在一系列具有不同功能和作用方式的水解酶类相互协同作用下才能将其彻底降解[1-2]。木聚糖酶(xylanase)是将木聚糖水解成低聚木糖和木寡糖的一类酶的总称,包含有多种内切酶和外切酶的一个复合酶系,主要分为内切β-1,4-D-木聚糖酶,β-D-木糖苷酶,α-L-呋喃阿拉伯糖苷酶,α-D-葡萄糖醛酸苷酶,乙酰木聚糖酯酶和酚酸酯酶等[3-4]。近年来,木聚糖酶已经在很多行业展露出潜在的优势,可应用于功能性低聚糖的生产、面团改良剂、饲料添加剂,在造纸、医药、纺织等行业也有广泛应用[5-6]。功能性低聚糖是双歧杆菌增殖因子[7],能够调节畜禽肠道益生菌群,减少抗生素的使用,实现环保养殖[8-9]。目前,功能性低聚木糖在饲料行业已成为热点,市场前景良好,李敏康等[10]进行了木霉固态发酵麦麸制备低聚木糖的初步研究。本试验旨在获取康氏木霉内切木聚糖酶,以制备功能性低聚木糖,并通过优化产酶条件提高木聚糖酶活力。
1 材料与方法
1.1材料与试剂
1.1.1试剂
V900513榉木木聚糖:美国Sigma公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、苯酚、无水亚硫酸钠、四水酒石酸钾钠、氢氧化钠、正丁醇、冰醋酸、二苯胺、苯胺、木糖等均为国产分析纯。
1.1.2菌种
康氏木霉(Trichoderma koningiiLys-368):湖南农业大学生科院实验室保存。
1.1.3培养基
麸皮斜面培养基:麸皮汁5.0%,葡萄糖1.0%,琼脂2.0%,水100 mL,自然pH,121℃灭菌25 min。
固体发酵初始培养基:玉米芯粉(过10目筛)10.0 g,(NH4)2SO41.0%,蒸馏水20 mL,pH自然,搅匀于250 mL三角瓶中,121℃灭菌25 min。
1.2仪器与设备
MJX-250BⅢ霉菌培养箱:天津泰斯特仪器有限公司;V-5000紫外可见分光光度计:上海元析仪器有限公司;SX-500立式压力蒸汽灭菌锅:日本TOMY KOGYO公司;CAV812电子天平:日本OHAUS公司。
1.3方法
1.3.1木聚糖酶活力测定方法
酶活力单位定义为:在pH值5.0,温度50℃条件下,每分钟水解木聚糖底物溶液生成1 μmol木糖所需的酶量为一个酶活力单位(IU)。
木糖还原糖的测定:参照GHOSE T K[11]的方法,采用3,5-二硝基水杨酸(DNS)法测定。
酶活力的计算:酶活力按每克固体曲所产生的酶量进行计算,其中木糖含量由木糖标准曲线(Y=1.327 7X-0.033 8,X为OD540nm,R2=0.998)计算所得,酶活力计算公式如下:

式中:Y为通过木糖标准曲线计算出的木糖含量,mg;N为酶液的总稀释倍数;M为木糖相对分子质量150.13;t为反应时间30 min;V为反应体系中加入的酶液体积0.1 mL;m为固体发酵原料的质量10 g。
1.3.2康氏木霉固体发酵产木聚糖酶的条件研究
单因素试验:以固体发酵基础培养基,采用单一变量原则,以酶活力为评价指标,先后确定发酵时间,温度,碳源配比,氮源种类,氮源浓度,培养基料水比,培养基起始pH值,金属离子对康氏木霉固体发酵产木聚糖酶的影响。每组试验分别做3组平行,取平均值。
正交试验:选择单因素试验影响较大的金属离子添加量,氮源,发酵时间,料水比4个因素,进行3水平正交试验,确定最优发酵条件组合。试验数据采用SPSS18.0软件进行分析。
1.3.3木聚糖酶解产物分析
将1.0%木聚糖于50℃水浴中酶解反应12 h,酶解产物薄层色谱定性检测,参照LIN Y S等[12]的方案适当修改进行,薄层色谱检测条件如下:
展开剂为正丁醇∶冰醋酸∶水(4∶1∶1,V/V);标样为1%木糖,上样0.5 μL;酶解产物上样1.5 μL;显色剂:2.0 g苯胺溶于2 mL二苯胺以及10 mL 85%H3PO4中;显色条件:当展开剂上行至距硅胶板顶端0.5 cm处时,取出硅胶板,热风风干,喷雾显色剂,再将硅胶板置于80℃条件下显色10 min,拍照记录。
2 结果与分析
2.1发酵周期的测定
以固体发酵初始培养基为基础,接种后置于30℃霉菌培养箱中进行培养,从第2天开始,每天取样测定木聚糖酶活力,其木聚糖酶活力变化曲线见图1。

图1 发酵时间对康氏木霉产木聚糖酶的影响Fig.1 Effect of fermentation time on xylanase production by Trichoderma koningii
从图1可以看出,康氏木霉在前3 d生长较为缓慢,木聚糖酶活力较低,至第4天时酶活力达到高峰(6.89 IU/g),此后缓慢下降。第4天至第6天木聚糖酶活力无显著差异(P<0.05,下同),因此,选择康氏木霉固体发酵产木聚糖酶的周期为4~6 d。
2.2最适培养温度的测定
以固体发酵初始培养基为基础,接种后分别置于28℃,30℃,32℃,35℃,37℃的恒温培养箱中培养4 d,木聚糖酶活力变化结果见图2。

图2 温度对康氏木霉产木聚糖酶的影响Fig.2 Effect of temperature on xylanase production by Trichoderma koningii
由图2可知,在28℃和30℃条件下所产木聚糖酶活力无显著差异,与其他温度条件差距明显,>30℃后酶活力下降。康氏木霉固体发酵产木聚糖酶的最佳培养温度为30℃,此条件下木聚糖酶活力达7.03 IU/g。
2.3碳源配比的确定
以初始培养基为基础,碳源条件选择不同麸皮和玉米芯粉质量比0∶10,1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1,10∶0进行发酵试验,木聚糖酶活力结果见图3。

图3 碳源配比对康氏木霉产木聚糖酶的影响Fig.3 Effect of carbon sources ratio on xylanase production by Trichoderma koningii
由图3可知,木聚糖酶活力随麸皮含量的增加呈先上升后下降趋势,麸皮与玉米芯的质量比为4∶6时木聚糖酶活力达到最高(7.95 IU/g),随着麸皮含量的增大,培养基易结块,透气性较差,酶活力逐渐下降。从酶解产物薄层色谱分析(图4)来看,麸皮/玉米芯粉质量比为2∶8时,虽然酶活力只有6.89 IU/g,但所含低聚木糖成分较多,木二糖至木五糖的斑点较深,说明低聚木糖浓度较高。因此选择麸皮与玉米芯粉质量比为2∶8作为最佳碳源配比。

图4 木聚糖酶反应样品的薄层层析结果Fig.4 Results of thin layer chromatography of samples by xylanase reaction
2.4氮源条件的确定
2.4.1不同氮源对康氏木霉固体发酵木聚糖酶的影响
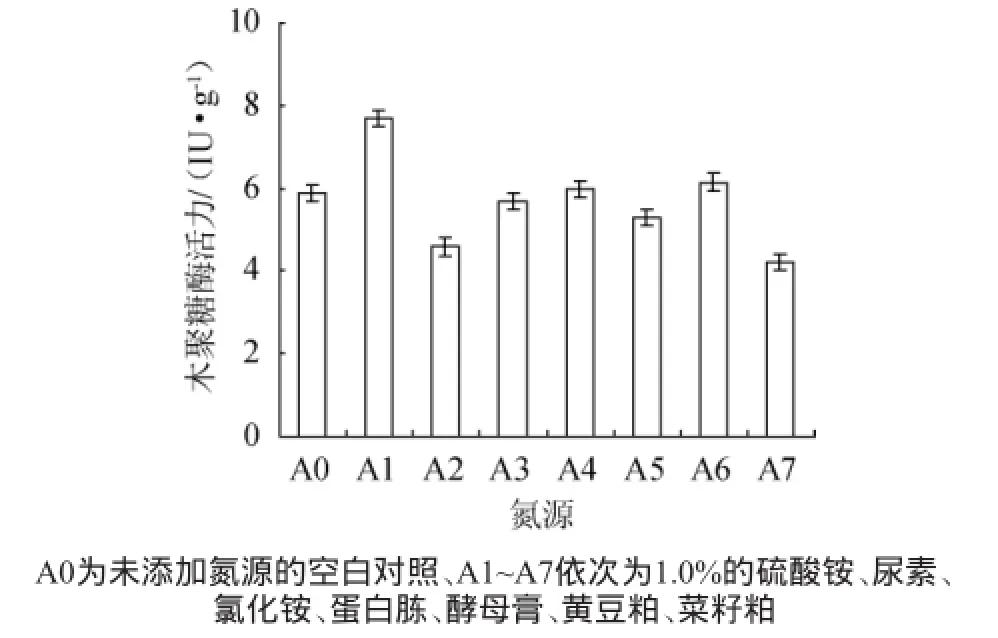
图5 不同氮源对康氏木霉产木聚糖酶的影响Fig.5 Effect of different nitrogen sources on xylanase productionbyTrichoderma koningii
在碳源为麸皮/玉米芯粉比例为2∶8(g∶g)的条件下,分别添加1.0%的硫酸铵、尿素、氯化铵、蛋白胨、酵母膏、黄豆粕、菜籽粕,考察氮源对木聚糖酶的影响,结果见图5。从图5可以看出,康氏木霉以硫酸铵为氮源进行固体发酵时,木聚糖酶活力达到7.68 IU/g,明显高于其他氮源和对照。
2.4.2最适氮源添加量的优化
以麸皮和玉米芯(2∶8)为培养基碳源,考察质量分数为0、0.25%、0.50%、1.00%、1.50%、2.00%、2.50%、3.00%、4.00%、5.00%的硫酸铵对木聚糖酶的影响,结果见图6。从图6可以看出,当硫酸铵添加量达到2.50%时,木聚糖酶活力为9.04 IU/g,之后随着硫酸铵添加量增加,木聚糖酶活力明显下降。因此,选择添加量硫酸铵添加量1.50%~2.50%进行正交试验。
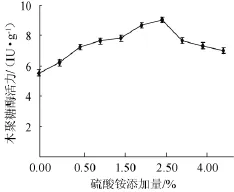
图6 不同硫酸铵添加量对康氏木霉产木聚糖酶的影响Fig.6 Effect of different(NH4)2SO4addition on xylanase production byTrichoderma koningii
2.5培养基料水比的优化
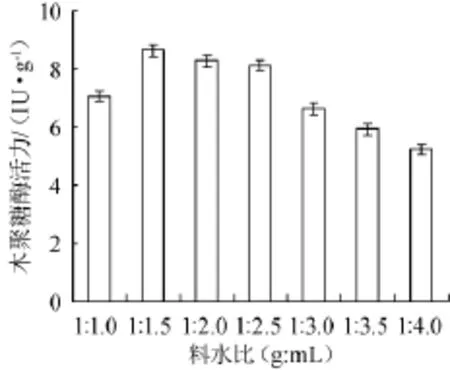
图7 料水比对康氏木霉产木聚糖酶的影响Fig.7 Effect of material to water ratio on xylanase production byTrichoderma koningii
以麸皮和玉米芯(2∶8)为碳源,2.5%硫酸铵为氮源,将培养基固料与水配制成1∶1.0,1∶1.5,1∶2.0,1∶2.5,1∶3.0,1∶3.5,1∶4.0(g∶mL)不同质量比进行固体发酵,结果见图7。从图7可知,料水比为1∶1.0(g∶mL)时,木聚糖酶活力降低,原因可能为含水量过低,无法满足霉菌生长所需的湿度,造成生物量较低,从而影响其产酶量;料水比为1∶1.5,1∶2.0,1∶2.5(g∶mL)这三个比例条件下酶活力较高,结果较为接近,料水比为1∶1.5(g∶mL)时酶活力最高(8.62 IU/g);随着含水量的继续增加,酶活力下降明显。因此选择固料与水质量比1∶1.5(g∶mL)为康氏木霉固体发酵产木聚糖酶的最适料水比,由于在料水比1∶1.0(g∶mL)条件下酶活力较低,因此正交试验选择料水比为1∶1.5~1∶2.5(g∶mL)进行正交试验。
2.6培养基初始pH值的确定
将培养基起始pH值分别调至3.0,4.0,5.0,6.0,7.0,8.0,接种康氏木霉发酵木聚糖酶,结果见图8。从图8可知,培养基起始pH值对康氏木霉固体发酵产木聚糖酶的影响并不显著,木聚糖酶活力处于7.5~8.5 IU/g,发酵曲最终pH值维持在5.0~5.5,说明菌株康氏木霉具有一定的调节pH的能力。由于培养基自然pH值为5.5~6.2,因此,康氏木霉固体发酵产木聚糖酶的最适初始pH值无需调整,选择自然状态。

图8 培养基初始pH值对康氏木霉产木聚糖酶的影响Fig.8 Effect of initial pH on xylanase production by Trichoderma koningii
2.7金属离子及添加量对康氏木霉产木聚糖酶的影响
在上述试验优化后的培养基基础之上,以不添加任何金属离子为空白对照(CK),其他试验组分别添加0.30%的MnSO4、CuSO4、MgSO4、KH2PO4、Fe2(SO4)3、CaCl2,考察不同金属离子对康氏木霉产木聚糖酶的影响,结果见图9。从图9可知,Mn2+具有明显的促进作用,Mg2+,K+,Ca+的促进作用并不明显,而Cu2+则具有明显的抑制作用。

图9 金属离子对康氏木霉产木聚糖酶的影响Fig.9 Effect of metal ions on xylanase production by Trichoderma koningii
根据上述试验结果,以麸皮和玉米芯(2∶8)为培养基干料,添加2.5%硫酸铵,料水比为1∶1.5(g∶mL),再分别添加0,0.10%,0.30%,0.50%,0.70%,0.90%的MnSO4,考察Mn2+添加量对康氏木霉固态发酵产木聚糖酶的影响,结果见图10。从图10结果可知,随着Mn2+添加量的增加,木聚糖酶活力也逐渐升高,添加量为0.50%时酶活力达到最大(11.72 IU/g),继续添加后,酶活力迅速下降。因此,添加0.50%的Mn2+对康氏木霉固体发酵产木聚糖酶的促进作用最强。
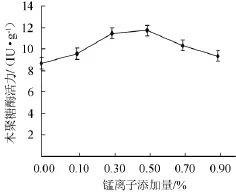
图10 锰离子添加量对康氏木霉产木聚糖酶的影响Fig.10 Effect of different Mn2+concentration on xylanase production byTrichoderma koningii
2.8正交试验分析
根据单因素试验结果,选择对康氏木霉固体发酵产木聚糖酶影响较为显著的4个因素:Mn2+添加量,硫酸铵添加量,发酵时间,料水比为评价因素,以木聚糖酶活力为评价指标进行L9(34)的正交试验,结果见表1,方差分析见表2。

表1 发酵条件正交试验结果与分析Table 1 Results and analysis of orthogonal experiments for fermentation conditions optimization
从表1可知,通过R值的大小(RD>RB>RA>RC)分析,康氏木霉固体发酵产木聚糖酶的影响因素由强到弱依次为Mn2+添加量,硫酸铵添加量,发酵时间,料水比;从k值分析可以得出最佳发酵条件组合为A3B3C1D3,即发酵时间为6 d,硫酸铵添加量为2.5%,料水比为1∶1.5(g∶mL),Mn2+添加量为0.50%。因此,得到最佳固体发酵条件为:麸皮与玉米芯质量比为2∶8,硫酸铵2.5%,MnSO40.50%,料水比1∶1.5(g∶mL),pH自然,培养温度30℃,发酵时间6 d。在此条件下,进行发酵重复验证试验,木聚糖酶活力可达11.98 IU/g。
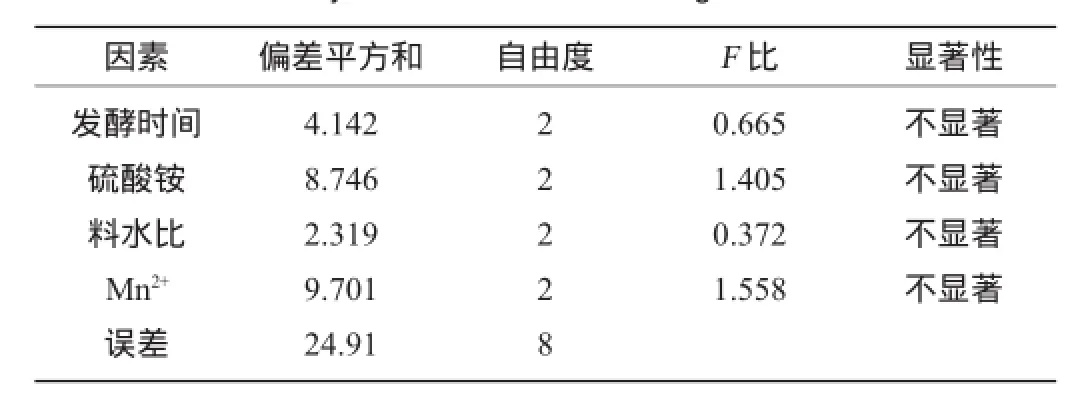
表2 正交试验结果方差分析Table 2 Analysis of variance for orthogonal tests result
由表2可知,各因素对结果影响均不显著。
3 结论
该试验通过优化康氏木霉实验室固体发酵产木聚糖酶的工艺,有效提高了木聚糖酶活力,所产木聚糖酶能够将木聚糖底物水解生成含有2~5个木糖分子的低聚木糖。试验过程中发现,仅有碳源因素对木聚糖酶水解产物种类存在影响,而在其他因素(氮源、培养基初始pH值、料水比、金属离子)变化条件下,薄层色谱图均相似,能够产生5种左右的低聚木糖,原因可能为麸皮和玉米芯中含有木聚糖成分,对木聚糖酶存在一定的诱导作用[13-14]。目前,固态发酵产木聚糖酶的菌种研究多集中在黑曲霉方面,对康氏木霉的研究很少。前期研究发现康氏木霉有复杂的纤维素酶系,可以通过诱导调控获得高产量的纤维素酶[15]。康氏木霉的木聚糖酶酶系及组分发酵有望通过调控获得,但其精细调控和每个组分酶学特性有待深入研究。该实验使用的玉米芯,既是发酵原料,也是潜在的木聚糖水解底物,这对农业秸秆废弃物的深度资源化,发酵渣的肥料化,减少焚烧引起的环境污染,具有很好的现实意义和市场前景。
[1]COLLINS T,GERDAY C,FELLER G.Xylanases,xylanases families and extremophilic xylanases[J].FEMS Microbiol Rev,2005,29(1):3-23.
[2]高艳秀,陈复生,丁长河.微生物木聚糖酶及其应用[J].中国酿造,2012,31(3):10-12.
[3]倪大伟,李瑞云,白爱枝,等.黑曲霉木聚糖酶的同源表达及其高产木聚糖酶发酵条件研究[J].食品与发酵工业,2015,41(4):48-53.
[4]万红贵,武振军,蔡恒,等.微生物发酵产木聚糖酶研究进展[J].中国生物工程杂志,2010,30(2):141-146.
[5]叶世超,薛婷,何文锦,等.木聚糖酶的应用及其研究进展[J].中国酿造,2013,32(7):8-10.
[6]BEG Q K,KAPOOR M,MAHAJAN L.Microbial xylanases and their industrial applications:a review[J].Appl Microbiol Biot,2001,56(3): 326-338.
[7]YUAN X,WANG J,YAO H.Feruloyl oligosaccharides stimulate the growth of bifidobacterium[J].Bifidum Anaerobe,2005,11:225-229.
[8]丁强.饲用木聚糖酶的研究进展及应用[J].制浆造纸工艺,2010,41(4):18-21.
[9]KIM J C,SIMMINS P H,MULLAN B P,et al.The digestible energy value of wheat for pigs,with special reference to the post-weaned animal[J]. Anim Feed Sci Tech,2005,122(3-4):257-287.
[10]李敏康,张帆,宋宏新.木霉固态发酵麦麸制备低聚木糖的初步研究[J].中国酿造,2012,31(12):60-63.
[11]GHOSE T K.Measurement of cellulase activities[J].Pure Appl Chem,1987,59(2):257-268.
[12]LIN Y S,CHEN G G,LING M,et al.A method of purification,identification and characterization of β-glucosidase fromTrichoderma koningii AS3.2774[J].J Microbiol Method,2010,83(1):74-81.
[13]SINGH S,MADLALA A M,PRIOR B A.Thermomyces lanuginosus: properties of strains and their hemicellulases[J].FEMS Microbiol Rev,2003,27(1):3-16.
[14]张姝倩.黑曲霉产木聚糖酶固体发酵条件研究[J].农产品加工·学刊,2013(8):5-7,11.
[15]林元山.康氏木霉AS3.2774纤维素酶系的诱导、阻遏、纯化及鉴定方法研究[D].南宁:广西大学博士论文,2010.
Solid-state fermentation conditions for xylanase production byTrichoderma koningii
FENG Bo1,YIN Yi1,2,YI Xudong1,LIN Yuanshan1,2*
(1.College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha 410128,China;2.Changsha Shuidisha Biotechnology Co.,Ltd.,Changsha 410125,China)
By solid-state fermentation,the optimal fermentation process for xylanase production byTrichoderma koningiiwas investigated by single factor experiments and orthogonal experiments as follows∶bran to corncob mass ratio 2∶8 as carbon sources,(NH4)2SO42.5%as nitrogen source,Mn-SO40.25%,solid to liquid ratio 1∶1.5(g∶ml),initial pH in natural state,temperature 30℃and time 6 d.Under this condition,the activity of xylanase byT.koningiireached 11.98 IU/g.The products of xylanase hydrolysis were rich in functional polymeric xylose bonded with 2-5 xylose molecular.
Trichoderma koningii;xylanase;solid-state fermentation;optimization
Q939.9
A
0254-5071(2015)10-0073-05
10.11882/j.issn.0254-5071.2015.10.016
2015-09-07
长沙市科技成果转化资金项目资助(K1501194-31)
冯波(1990-),女,硕士研究生,研究方向为生物技术与工程。
林元山(1969-),男,副教授,博士,研究方向为发酵工程。
