高碑店湖表层水中雌激素的分布及其光降解影响因素
2015-10-09张帅王京刚马晶晶齐维晓
张帅,王京刚,马晶晶,齐维晓, #
1. 北京化工大学化学工程学院,北京 100029 2. 中国科学院生态环境研究中心,北京 100085
高碑店湖表层水中雌激素的分布及其光降解影响因素
张帅1, 2,王京刚1,,马晶晶2,齐维晓2, #
1. 北京化工大学化学工程学院,北京 100029 2. 中国科学院生态环境研究中心,北京 100085
雌激素等内分泌干扰物在水体中普遍存在,其在再生水中的存在以及在水体中的迁移转化会产生潜在的健康和生态风险。光降解是水体中雌激素消除的主要途径之一,水体中共存的无机离子及有机质等对雌激素的光解存在不同的影响。对高碑店湖再生水体中雌激素的污染状况进行了调查,结果显示表层水中天然雌激素雌酮(E1)和人工合成雌激素17α-乙炔基雌二醇(EE2)的浓度最高。在模拟太阳光照射条件下对E1在水溶液中的降解规律及影响因素进行了研究,发现在模拟1 SUN的光密度条件下,15 min时E1降解率可达85%(C0=5 μg·L-1),而氨氮对E1的光降解存在一定的抑制作用,并且抑制作用随着氨氮的升高而变大。与纯水系统相比,高碑店湖表层水基质中E1的光降解速率较低,说明整体上氨氮、HCO-3、浊度等因素对E1光降解产生的抑制作用占主导。对雌酮及其降解产物进行了红外光谱分析,结果显示1 720 cm-1对应的C=O键特征峰在光照时间为0、10和20 min样品中的强度逐渐减弱,而2 854 cm-1和2 925 cm-1对应的脂肪碳的C-H键特征峰先增强后减弱,可能是因为E1结构中的C-C=O发生了反应生成了C=C-OH,而随着反应的继续,C=C也被进一步氧化,但降解产物的结构需要进一步研究推断。随着E1的光降解,E1水溶液的内分泌干扰活性逐渐下降,氨氮虽然对E1的光降解有一定的抑制作用,但随着降解反应的进行E1水溶液的内分泌干扰活性依然呈下降趋势。
雌酮;再生水;内分泌干扰活性;光降解;可见光
近二十年来,大量学者报道了世界范围内水体中内分泌干扰物的普遍存在[1-4]。即使在低浓度的内分泌干扰物存在条件下,生物体的长期暴露也会导致生殖生育能力降低、雌性化、幼体的变态发育等多方面的危害[1,5]。水体中的内分泌干扰物主要来源于污水的排放,尤其是天然雌激素类物质,其在水体中的主要来源是污水的直接排放。污水处理厂并不能彻底去除这些微量有机污染物,而且去除率受很多因素影响而变异较大[6]。此外,再生水处理工艺中的氯消毒过程中,含氯消毒剂会还会与内分泌干扰物的衍生物发生反应生成具有比母体更强内分泌活性的产物[7]。
光降解是水中雌激素消除的主要途径之一,水中雌激素的紫外光降解已有很多研究[8-9],而在太阳光照下的光降解的研究近几年来才有报道[10]。雌激素的光降解包括直接光解和间接光降解,雌激素因为能吸收290~360 nm波段之内的光,因此直接光解在水体中可能发挥了较大的作用。对于非直接光解,水中普遍存在的硝酸盐氮、Fe3+和腐植酸等都会影响雌激素等有机物的光降解[11]。Zuo等[12]发现,尽管EE2(17α-乙炔雌二醇)很难被水体中的微生物降解,在入海口处自然光照下却可以发生光降解反应,在春季光照条件下半衰期小于1.5 d。溶解性有机质会加速水中雌激素的光降解,因为溶解性有机碳可以吸收太阳光,其在降解过程中产生的自由基促进了雌激素的光降解[13]。目前关于雌激素在水中的光降解研究多是在纯水系统中,在天然水体和再生水体中的研究较少。
本文研究了高碑店湖再生水体中雌激素的污染状况,并以天然雌激素为代表,研究模拟太阳光照射条件下其在水溶液中的降解规律及影响因素,重点研究了京津水体中普遍存在的氨氮对雌激素光降解的影响,同时对降解过程中雌激素的内分泌干扰活性进行了测定,以评价雌激素在可见光光降解过程中的内分泌干扰活性的变化。
1 材料与方法(Materials and methods)
1.1样品的采集
高碑店湖位于北京东郊,是通惠河从高碑店闸到四惠铁路桥之间的部分。高碑店湖接纳了北京市最大污水处理厂-高碑店污水处理厂的出水,日来水量约200 000 t。湖水还作为中电国华电力股份有限公司北京热电分公司的直流冷却用水。
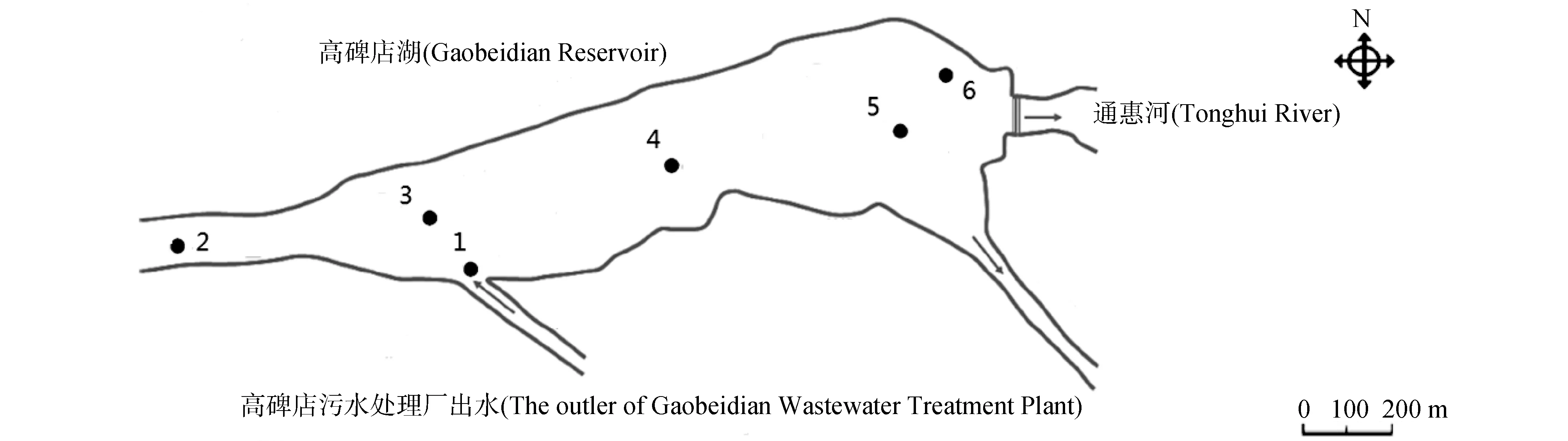
图1 采样点分布图Fig. 1 The sampling sites in the Gaobeidian Reservoir (1 to 6 in the figure represented the sampling sites)
2012年4月于高碑店湖采集了6个表层水样品,采样点分布如图1所示。采集的表层水储存于4 L的棕色玻璃瓶中用于雌激素含量的测定,另外采集表层水储存于聚乙烯塑料瓶中用于氮、磷、阴离子、金属离子等的测定。
为了测定雌激素的含量,采样当天返回实验室之后用直径142 mm的玻璃纤维膜 (Millipore, 0.7 μm孔径, 450 ℃烘4 h)过滤,获得滤后水样品。在调节水样pH至2~3之后,滤后水(4 L)利用HLB小柱(Waters,500 mg,6 mL)富集其中的溶解态的有机物。
2015年1月于1#、4#和6#采样点采集了表层水样品以进行实验室模拟实验,样品过滤后放于4 ℃的冷库中保存。
1.2样品的预处理与分析检测
将富集了有机物的HLB柱抽干后,分别用甲醇(HPLC,Fisher Chemicals,美国)/水(1:3,v/v)、超纯水、甲醇/氨水/水(10:2:88,v/v)、超纯水各5 mL依次进行清洗,目的是去除杂质干扰。之后用10 mL叔丁基甲醚(HPLC,J.T. Baker,美国)/甲醇(9:1,v/v)分3次(4 mL、3 mL、3 mL)淋洗,淋洗液被收集在K-D浓缩瓶中。氮气吹至近干后加入衍生化试剂(硅甲基衍生化试剂BSTFA(含1%TMCS)和TMSI(购自AccuStandard,美国)进行衍生化,加入内标氘代芘(AccuStandard,美国)和正己烷(Fisher Chemicals,美国)并定容到0.5 mL后待仪器检测。
雌酮、雌三醇和己烯雌酚的标准物质购自Dr. Ehrenstorfer(德国),雌二醇、乙炔基雌二醇购自东京化成公司(TCI,日本)。样品中雌激素用安捷伦GC-MS (7890A-5975C)进行定量分析,测定分析条件参考文献[14]。水中雌酮(E1)、17β-雌二醇(E2)、雌三醇(E3)、己烯雌酚(DES)和17α-乙炔基雌二醇(EE2)的检出限分别为0.1、0.1、0.23、0.03和0.2 ng·L-1。
pH、DO、电导率用便携式水质参数测定仪(Sension156,HACH,美国)在采样现场测定。水样经过硫酸钾消解和氧化后,分别利用钼锑抗分光光度法和紫外分光光度法测定水中总磷(TP)和总氮(TN)的含量。水中NH4-N的含量利用纳氏试剂光度法测定,硝酸盐氮、F-、Cl-等阴离子利用离子色谱仪(Dionex-4500 i,美国)进行测定。悬浮物含量(SS)利用称重过滤一定体积表层水前后0.45 μm孔径膜的质量来计算。有机碳含量(NPOC)利用有机碳分析仪(TOC-VCPH,Shimadzu,日本)进行测定。Fe和Mn等元素含量利用ICP-MS (Plasma Quad 3,英国)测定。
1.3雌酮的光照实验
雌酮储备液配制方法如下:在盛有超纯水的烧杯中溶于过量的E1,放入搅拌子在黑暗中搅拌。2 d后用0.45 μm的玻璃纤维滤膜将未溶解的E1过滤掉,并检测其浓度。
在配有循环冷却水的反应器中配制初始浓度约为5 μg·L-1的E1溶液,用500 W氙灯光源模拟1 SUN的辐照度(100 mWcm-2)进行垂直照射,反应过程进行避光处理,分别在光照0、5、10、15、20、30、60 min后采集水样进行富集,分析其中E1含量。所有光照实验重复2次以上。
1.4雌酮光解产物的红外光谱分析
1.5内分泌干扰活性测定
反应前及光照一定时间时含雌酮水溶液的内分泌干扰活性采用β-半乳糖酵母法,具体参考文献[15-16]。
2 结果与讨论 (Results and discussion)
2.1高碑店湖表层水中雌激素的分布
2012年4月高碑店湖表层水常规水质指标(pH、溶解氧、电导率、氮、磷、无机阴离子)及Fe和Mn元素等含量如表1所示。表层水中氮主要以硝态氮形式存在,氨氮含量相对较低(0.9~3.0 mg·L-1)。另外非挥发性有机碳的含量也较低,约为2.0 mg·L-1,普遍低于河流水体,而金属元素Fe和Mn的含量皆为几十μg·L-1的水平。
5种雌激素在高碑店湖表层水中普遍存在,E1、E2、E3、DES和EE2的平均浓度分别为30、15、19、9和27 ng·L-1,略低于京津河流表层水中雌激素浓度水平[4]。5种雌激素中以天然雌激素E1和人工合成雌激素EE2的浓度最高。E2较容易转化为E1[17],这可能是大部分样品中E1浓度高于E2的原因;EE2为多种避孕药物的活性成分,普通的污水处理工艺很难将之去除[18],能够对其进行降解的微生物菌种也十分有限[19-21];DES辛醇水系数较高,易被颗粒物吸附,在水中含量因此较低。
2.2雌酮纯水溶液的光降解
E1水溶液的吸收光谱如图3所示,E1在紫外区有较强吸收,在大于300 nm波长区域内吸收较弱,可以推断E1在纯水溶液中的光降解主要取决决于光源中紫外区的能量。在以氙灯光源模拟的太阳光照射条件下(100 mW·cm-2),E1在超纯水配置水溶液中的光降解规律如图4所示,结果显示光照时间15 min内E1迅速降解,15 min时降解率为85%,之后降解速率缓慢,60 min时降解率为96%。

表1 高碑店湖表层水水质指标 (2012-04)
注:ND,未测出。
Note: ND, not detected.

图2 高碑店湖表层水中雌激素的分布 (2012-04)注:E1为雌酮,E2为17β-雌二醇,E3为雌三醇,DES为己烯雌酚,EE2为17α-乙炔基雌二醇。Fig. 2 Distribution of estrogens in surface water from Gaobeidian Reservoir (2012-04)Note: E1 stands for estrone, E2 stands for 17β estradiol, E3 stands for estriol, DES stands for diethylstilbestrol, EE2 stands for 17α-ethynylestradiol.

图3 E1水溶液的紫外可见吸收光谱图Fig. 3 Absorption spectrum of E1 over 250~400 nm

图4 太阳光模拟条件下E1光降解的浓度变化趋势Fig. 4 Concentration profiles of E1 solutions irradiated with simulated sunlight

图5 太阳光模拟条件下纯水系统中E1光降解准一级动力学模拟Fig. 5 Solar photodegradation of E1 and pseudo-first order simulation
将所得数据分段进行准一级动力学模拟,结果如图5所示,Ln(C/C0)与时间之间的线性相关性较高,相关系数大于0.98。0~20 min和20~60 min时间段内反应常数分别为0.1123和0.0282,说明水溶液中E1的光降解与浓度有很大关系,在一定范围内浓度越高降解速率越大。本文后期主要研究在光照20 min前氨氮对反应规律的影响。
2.3氨氮对雌酮光降解的影响
通过已有研究可知,天然水体中存在的无机离子例如NO3-N、HCO-3、Fe3+等对E1的光降解皆有一定的影响[11]。在290~330 nm波段紫外光激发下,NO3-N能够生成羟基自由基从而促进雌激素等的光降解,而HCO-3因为能猝灭羟基自由基从而减缓雌激素等有机物的降解。然而水体中氨氮对雌酮等有机物光降解的影响尚无报道。在中国尤其是北方缺水地区,由于污水处理厂出水占水体水量的50%以上[22],水体中氨氮普遍存在,其对雌酮等有机物的光降解可能产生一定的影响。在纯水系统中,氨氮和硝酸根单独存在条件下对E1的光降解的影响如图6所示。当E1与氨氮同时存在时,E1的光降解速率常数为0.0907,低于无氨氮存在时的常数0.1123,即氨氮的存在减缓了E1的光降解。NO3-N对E1的光降解具有明显的促进作用,与已有文献报道结果一致。
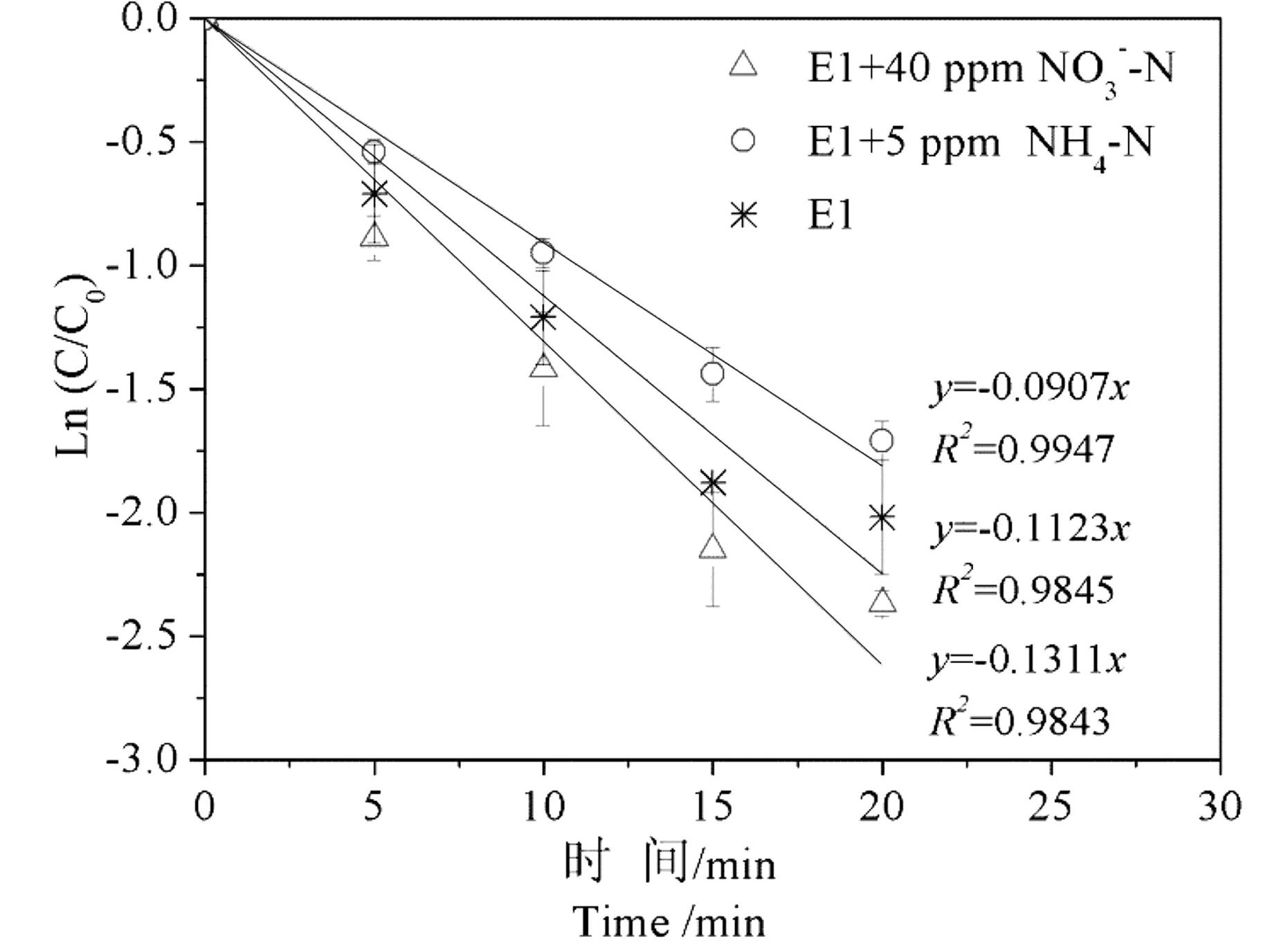
图6 硝酸盐氮和氨氮存在下E1光降解准一级动力学模拟Fig. 6 Solar photodegradation of E1 and pseudo-first order simulation at presence of NO3-N and NH4-N
在氨氮浓度较低时(低于10 mg·L-1),其对E1光降解的抑制作用随着氨氮的浓度的升高并没有显著增强,而当氨氮浓度提高到20 mg·L-1时,其对E1光降解的抑制作用明显增强,降解动力学常数为0.0793,显著低于氨氮浓度为10 mg·L-1时的0.0991。实际水体中,例如高碑店湖中氨氮浓度较低(低于5 mg·L-1),其对E1光降解的抑制作用可能相对较弱。
2.4高碑店湖表层水基质中雌酮的光降解
实际水体中共存污染物组成复杂,有机物的光降解规律的影响因素也极其复杂。本研究采集了高碑店水库表层水(1#、4#和6#样品),以其为基质研究了E1光降解规律。3个样品的常规理化指标如表2所示。1#样品因为靠近高碑店污水处理厂出口,其水质主要受污水处理厂排水影响,该样品中的pH值低于4#和6#样品,而ORP和电导率高于4#和6#样品,6#样品中的溶解氧略低于1#和4#样品。氨氮的浓度大小关系是:1#<4#<6#,1#样品中的NO3-N的浓度略高于其他2个样品。

图7 不同氨氮浓度存在时E1光降解准一级动力学模拟Fig. 7 Photodegradation of E1 and pseudo-first order simulation at presence of different concentrations of NH4-N

表2 高碑店湖表层水常规理化指标 (2015-01)

图8 高碑店湖表层水基质中E1光降解准一级动力学模拟Fig. 8 Photodegradation of E1 and pseudo-first order simulation in the matrix of Gaobeidian surface water

图9 E1光照前(0 min)和光照10 min和20 min后样品的红外光谱图Fig. 9 Fourier transform infrared spectra of E1 and its photodegradation product

图10 不同光照时间E1水溶液的β-半乳糖苷酶活性注:(a)诱导率;(b)雌二醇当量。Fig. 10 Endocrine disrupting activity of E1 solution with different irradiation timeNote: (a) Inductivity; (b) Estradiol equivalent.
高碑店湖表层水基质中E1的光降解规律如图8所示,不同样品基质中E1的光降解速率常数存在明显的差异。其中氨氮浓度最低而NO3-N最高的1#样品基质中E1的光降解速率常数最大,为0.0915,氨氮浓度高而硝酸根离子低的6#样品基质中E1的光降解速率常数最小,为0.0711。与纯水系统相比(k=0.1123),高碑店水库表层水基质中E1的光降解速率都有所减缓,说明整体上氨氮、HCO-3、浊度等因素对E1光降解产生的抑制作用占主导。
2.5雌酮光降解过程中结构和内分泌干扰活性的变化
为了进一步研究E1的光降解机理,对雌酮及其降解产物进行了红外光谱分析,结果如图9所示。E1及其光降解产物的红外光谱在1 499 cm-1和1 580 cm-1对应的苯环特征吸收峰在0、10和20 min样品中的强度逐渐减弱,说明在光照反应过程中,E1的苯环遭到破坏。同时,1 720cm-1对应的C=O键特征峰在0、10和20 min样品中的强度逐渐减弱,而2 854 cm-1和2 925cm-1对应的脂肪碳的C-H键特征峰先增强后减弱,可能是因为E1结构中的C-C=O发生了反应生成了C=C-OH,而随着反应的继续,C=C也被进一步氧化。Caupos等[23]报道了模拟太阳光条件下E1在水溶液中的降解可能产生一种烯醇产物,但是其结构需要进一步研究推断。
为了研究光降解反应过程中E1水溶液内分泌干扰活性的变化,本文测定了不同光照时间E1水溶液的β-半乳糖苷酶的酶活性,不同光照时间E1水溶液的β-半乳糖苷酶活性诱导率和雌二醇当量如图10所示。随着光照时间的延长,E1水溶液的内分泌干扰活性逐渐下降。NO3-N由于能促进E1的光解,NO3-N与E1共存时溶液的内分泌干扰活性下降的比E1单独存在时更快。当氨氮与E1共存时,在0~15 min的光照时间内,溶液的内分泌干扰毒性逐渐下降,光照20 min的溶液的内分泌干扰活性比15 min时的略有上升。此外,虽然氨氮对E1的光降解速率有抑制作用,但光照10 min及15 min时氨氮存在下E1水溶液的内分泌干扰活性并没有高于E1单独存在时的活性,可能是由于低浓度氨氮(2 mg·L-1)对E1光降解的抑制作用较弱,也有可能是内分泌干扰活性实验误差导致。氨氮对E1光降解的影响机制及降解过程中内分泌干扰活性变化的具体原因有待进一步的研究。
综上所述,雌激素在高碑店湖表层水中普遍存在,E1和EE2浓度普遍高于E2、DES和E3。在模拟1 SUN的光密度条件下,E1初始浓度为5 μg·L-1时,光照时间15 min时E1降解率可达85%,氨氮对E1的光降解存在一定的抑制作用,并且随着氨氮浓度的升高抑制作用变强。与纯水系统相比,高碑店湖表层水基质中E1的光降解速率较低。对雌酮及其降解产物进行了红外光谱分析,结果显示光解过程中E1结构中的C-C=O可能发生了反应生成了C=C-OH,但降解产物的结构需要进一步研究推断。随着光照时间的增长,水中E1浓度逐渐下降,E1水溶液的内分泌干扰活性也随之逐渐下降,氨氮虽然对E1的光降解有一定的抑制作用,但随着降解反应的进行E1水溶液的内分泌干扰活性依然呈下降趋势。
致谢:感谢国家自然科学基金重点项目(No. 51138006)对本研究的大力支持。
通讯作者简介:王京刚(1962-),男,材料科学与工程博士后,副教授,主要研究方向为大气污染控制方向,发表学术论文70余篇。
共同通信作者简介:齐维晓(1982-),女,环境工程博士,副研究员,主要研究方向为水体中有机物的迁移转化。
[1]Baronti C, Curini R, D'Ascenzo G, et al. Monitoring natural and synthetic estrogens at activated sludge sewage treatment plants and in a receiving river water [J]. Environmental Science & Technology, 2000, 34(24): 5059-5066
[2]Isobe T, Serizawa S, Horiguchi T, et al. Horizontal distribution of steroid estrogens in surface sediments in Tokyo Bay [J]. Environmental Pollution, 2006, 144(2): 632-638
[3]Thompson M L, Casey F X M, Khan E, et al. Occurrence and pathways of manure-borne 17β-estradiol in vadose zone water [J]. Chemosphere, 2009, 76(4): 472-479
[4]Lei B, Huang S, Zhou Y, et al. Levels of six estrogens in water and sediment from three rivers in Tianjin area, China [J]. Chemosphere, 2009, 76(1): 36-42
[5]Zha J, Sun L, Zhou Y, et al. Assessment of 17α-ethinylestradiol effects and underlying mechanisms in a continuous, multigeneration exposure of the Chinese rare minnow (Gobiocypris rarus) [J]. Toxicology and Applied Pharmacology, 2008, 226(3): 298-308
[6]Johnson A C, Aerni H R, Gerritsen A, et al. Comparing steroid estrogen, and nonylphenol content across a range of European sewage plants with different treatment and management practices [J]. Water Research, 2005, 39(1): 47-58
[7]Hu J, Aizawa T, Ookubo S, et al. Products of aqueous chlorination of bisphenol A and their estrogenic activity [J]. Environmental Science & Technology, 2002, 36(9): 1980-1987
[8]Liu X L, Wu F, Deng N S, et al. Photodegradation of 17α-ethynylestradiol in aqueous solution exposed to a high-pressure mercury lamp (250 W) [J]. Environmental Pollution, 2003, 126(3): 393-398
[9]Liu B, Liu X. Direct photolysis of estrogens in aqueous solutions [J]. Science of the Total Environment, 2004, 320(2): 269-274
[10]Chowdhury R R, Charpentier P, Ray M B, et al. Photodegradation of estrone in solar irradiation [J]. Industrial & Engineering Chemistry Research, 2010, 49(15): 6923-6930
[11]Chowdhury R R, Charpentier P A, Ray M B, et al. Photodegradation of 17β-estradiol in aquatic solution under solar irradiation: Kinetics and influencing water parameters [J]. Journal of Photochemistry and Photobiology A: Chemistry, 2011, 219(1): 67-75
[12]Zuo Y, Zhang K, Deng Y, et al. Occurrence and photochemical degradation of 17α-ethinylestradiol in Acushnet River Estuary [J]. Chemosphere, 2006, 63(9): 1583-1590
[13]Leech D M, Snyder M T, Wetzel R G, et al. Natural organic matter and sunlight accelerate the degradation of 17ß-estradiol in water [J]. Science of the Total Environment, 2009, 407(6): 2087-2092
[14]Nie Y F, Qiang Z M, Zhang H, et al. Determination of endocrine-disrupting chemicals in the liquid and solid phases of activated sludge by solid phase extraction and gas chromatography-mass spectrometry [J]. Journal of Chromatography A, 2009, 1216(42): 7071-7080
[15]李剑, 崔青, 马梅, 等. 基于 H4IIE细胞株测试间接雌激素效应物质的代谢活化方法[J]. 环境科学学报, 2006, 26(8): 1320-1325
Li J, Cui Q, Ma M, et al. A metabolic activation method for screening indirect estrogen pollutants based on H4IIE cell line [J]. Acta Scientiae Circumstantiae,2006, 26(8): 1320-1325 (in Chinese)
[16]李剑, 马梅, 饶凯锋, 等. 酵母双杂交技术构建重组人雌激素受体基因酵母[J]. 生态毒理学报, 2008, 3(1): 21-26
Li J, Ma M, Rao K F, et al. Construction of the recombinant human estrogen receptor (hER) gene yeast using two-hybrid yeast technique [J]. Asian Journal of Ecotoxicology, 2008, 3(1): 21-26 (in Chinese)
[17]Servos M R, Bennie D T, Burnison B K, et al. Distribution of estrogens, 17β-estradiol and estrone, in Canadian municipal wastewater treatment plants [J]. Science of the Total Environment, 2005, 336(1): 155-170
[18]De Rudder J, Van de Wiele T, Dhooge W, et al. Advanced water treatment with manganese oxide for the removal of 17α-ethynylestradiol (EE2) [J]. Water Research, 2004, 38(1): 184-192
[19]Shi J, Fujisawa S, Nakai S, et al. Biodegradation of natural and synthetic estrogens by nitrifying activated sludge and ammonia-oxidizing bacterium Nitrosomonas europaea [J]. Water Research, 2004, 38(9): 2323-2330
[20]Haiyan R, Shulan J, ud din Ahmad N, et al. Degradation characteristics and metabolic pathway of 17α-ethynylestradiol by Sphingobacterium sp. JCR5 [J]. Chemosphere, 2007, 66(2): 340-346
[21]Khunjar W O, Mackintosh S A, Skotnicka-Pitak J, et al. Elucidating the relative roles of ammonia oxidizing and heterotrophic bacteria during the biotransformation of 17α-ethinylestradiol and trimethoprim [J]. Environmental Science & Technology, 2011, 45(8): 3605-3612
[22]Pernet-Coudrier B, Qi W X, Liu H J, et al. Sources and pathways of nutrients in the simi-aird region of Beijing-Tianjin region, China [J]. Environmental Science & Technology, 2012, 46: 5294-5301
[23]Caupos E, Mazellier P, Croue J P, et al. Photodegradation of estrone enhanced by dissolved organic matter under simulated sunlight [J]. Water Research, 2011, 45(11): 3341-3350
◆
Occurrence and Photodegradation of Estrogens in Surface Water of Gaobeidian Reservoir
Zhang Shuai1, 2, Wang Jinggang1, *, Ma Jingjing2, Qi Weixiao2, #
1. College of Chemical Engineering, Beijing University of Chemical Engineering, Beijing 100029, China 2. Research Center for Eco-Environmental Sciences, Chinese Academy of Science, Beijing 100085, China
15 April 2015accepted 18 May 2015
The presence of estrogenic compounds in aquatic environment is ubiquitous and has attracted increasing concern due to their endocrine disruption potential. Photodegradation is one of the main elimination pathways of estrogens in surface water and is influenced differently by different ions and organic matters in the water. In this study, surface water was collected from Gaobeidian Reservoir and analyzed for estrogens and the photodegradation of estrone (E1) in the solution under simulated sunlight irradiation was investigated. The results showed that E1 and 17α-ethynylestradiol (EE2) were the most abundant and that the elimination rate of E1 could be 85% after 15 min of 1SUN irradiance. Ammonium, HCO-3and turbidity inhibited the photodegradation of E1. Although ammonium ion showed inhibition on the photodegradation of E1, the endocrine disrupting activity of the E1 solution decreased on the presence of ammonium ion. Fourier transformed infrared (FTIR) analysis showed C=O bonds peak decreased in samples irradiated with longer time, while peak of C-H in aliphatic carbon increased. This is possibly caused by the elimination of C-C=O and formation of C=C-OH during the reaction. Endocrine disrupting activity of the E1 solution decreased along with the photodegradation.
estrone; reclaimed water; endocrine disrupting activity; photodegradation; simulated sunlight
国家自然科学基金重点项目(No. 51138006)
张帅(1990-),男,硕士研究生,研究方向为水体中有机物的化学转化,E-mail: 775220944@qq.com
Corresponding author), E-mail: wangjg@mail.buct.edu.cn
#共同通讯作者(Co-corresponding author), E-mail: wxqi@rcees.ac.cn
10.7524/AJE.1673-5897.20150415009
2015-04-15 录用日期:2015-05-18
1673-5897(2015)6-173-08
X171.5
A
张帅, 王京刚, 马晶晶, 等. 高碑店湖表层水中雌激素的分布及其光降解影响因素[J]. 生态毒理学报,2015, 10(6): 173-180
Zhang S, Wang J G, Ma J J, et al. Occurrence and photodegradation of estrogens in surface water of Gaobeidian Reservoir [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 173-180 (in Chinese)
