蚕豆对铯的吸收蓄积及亚细胞分布研究
2015-10-09付倩杨垒滟赖金龙陶宗娅吴国罗学刚
付倩,杨垒滟,赖金龙,陶宗娅,*,吴国,罗学刚
1. 四川师范大学生命科学学院,成都 610101 2. 西南科技大学 生物质材料教育部工程研究中心,绵阳 621010
蚕豆对铯的吸收蓄积及亚细胞分布研究
付倩1,杨垒滟1,赖金龙1,陶宗娅1,*,吴国1,罗学刚2
1. 四川师范大学生命科学学院,成都 610101 2. 西南科技大学 生物质材料教育部工程研究中心,绵阳 621010
采用改良水培法培养蚕豆幼苗至2片真叶,置于含铯(ρ(Cs+) 8.24(CK)~200 mg·L-1)的营养液中处理7 d、14 d、21 d后取样。采用差速离心法分离亚细胞组分,采用原子吸收分光光度法测定根、茎、叶及各亚细胞组分的Cs+含量,分析蚕豆幼苗对Cs+的吸收蓄积及亚细胞分布特点,研究蚕豆对Cs+的富集转运特征及耐受机理。结果显示:蚕豆3种器官对Cs+的蓄积量为根>叶>茎,根对Cs+的蓄积量占总量的65.13%~83.17%,最高(ρ(Cs+) 200 mg·L-1时)达到518.40 mg·kg-1FW (7 d)、1 949.74 mg·kg-1FW (14 d)和3 614.03 mg·kg-1FW (21 d);蚕豆根、茎、叶中Cs+的亚细胞分布主要集中在细胞壁和可溶性组分中,Cs+相对含量分别达到75.84%~99.06% (根)、79.06%~100% (茎)、82.95%~100% (叶);细胞核、前质体、叶绿体和线粒体等细胞器仅含少量的Cs+(<25%)。结果表明,蚕豆根、茎、叶细胞主要通过阻滞作用,将Cs+结合固定在细胞壁,并将进入细胞质基质的一部分Cs+转运到液泡内,暂时或“永久性”存贮,有效降低了细胞器、胞质溶胶(cytosol)及内含物中的Cs+含量,极大地减缓了Cs+对细胞器的功能性损伤,这是短期内蚕豆未表现出明显中毒症状的原因,也是蚕豆耐受Cs+胁迫的重要机理之一。
铯;蚕豆;蓄积;亚细胞分布;耐受性
随着核工业的发展、核设施的运行及突发性核事故,大量核废弃物进入土壤和水体,其中铯(cesium, Cs)的放射性同位素134Cs和137Cs为铀的核裂变废弃物,裂变量大、易扩散、半衰期长[1],对生态系统造成严重污染。植物生长过程中可通过根系吸收并向地上部分转移,将134Cs和137Cs从土壤转移到植物体内,进一步通过食物链转移到人体内,形成内辐射,对人类健康构成威胁[2]。
已有研究表明,Cs+的环境生物学效应具有双重性,少量的Cs+可维持植物(如杜鹃花)细胞内电解质平衡,过量的Cs+进入细胞后可取代钾(K+),导致代谢过程中需要K+起作用的关键组分失去活性,严重影响植物的生长代谢[3-4]。张晓雪等[5]的研究结果显示,用ρ(Cs+) 10 mmol·L-1的水溶液培养蚕豆苗7 d,蚕豆苗对133Cs的富集量达到了14 340 mg·kg-1DW,根部Cs+蓄积量占总量的60.25%,表明蚕豆苗对Cs+的富集能力和耐受性强,但转移能力较弱。因此,推测蚕豆对Cs+具有独特的富集特性和解毒机理。目前认为,植物进行重金属解毒的主要方式之一是细胞的区域化作用,即通过细胞壁的阻滞作用和液泡内暂时或“永久性”的存贮,将重金属(如Cd2+)累积在细胞壁和液泡中,形成沉淀,从而阻滞重金属在敏感的细胞代谢位点蓄积[6-7],但关于Cs+在植物体内的亚细胞分布及耐受机理鲜有报道。
已有研究表明,向日葵[8]、紫狼尾草[9]和苋菜[10]等植物的叶是Cs+的主要蓄积器官,蓄积量大,转移能力强,具有超富集植物的3个特征[11]:植物地上部重金属含量是同一条件下普通植物的100倍;转移系数(translocation factor)大于1;生物富集系数(bioaccumulation factor)大于1,转移系数和富集系数越大,越有利于植物的提取修复。蚕豆为豆科野豌豆属一年生或越年生草本,是粮食、蔬菜、饲料和绿肥兼用作物。蚕豆根部对Cs+的蓄积量大,转移系数低[5],暂未列入超富集植物名录[12],但可作为研究植物对Cs+污染的响应及其解毒机理的模式材料。依据植物、微生物等对放射性核素134Cs、137Cs的吸收和富集与其稳定同位素133Cs无显著性差异的文献报道[13-14],本文以稳定同位素133Cs为外源处理因素,模拟放射性核素134Cs和137Cs对土壤的污染,采用差速离心法和原子吸收分光光度法,研究蚕豆幼苗对Cs+的富集转运特征及亚细胞分布,为阐明蚕豆对Cs+的富集特征和解毒机理提供实验支持。
1 材料与方法 (Materials and methods)
1.1试材及处理
蚕豆(Vicia faba L.)品种“成胡一号”,购自成都种子市场。种子经消毒、浸种、萌发至胚根1 cm左右[15]。采用改良水培法培养蚕豆幼苗至两片真叶,具体方法是:将萌发的蚕豆种子移栽至打孔的纸杯中,每杯6株,纸杯置于一次性塑料杯上,加入适量1/6改良霍格兰营养液,使根尖接触到营养液,每2 天更换1次处理液(培养条件:25 ℃,光/暗比为12 h/12 h)。挑选长势一致的幼苗进行处理,每组重复3次。
目前我国土壤中Cs+的背景值为8.24 mg·kg-1[16],土壤Cs+污染水平约为50 mg·kg-1[17]。据此,本研究外源Cs+的溶液浓度(ρ(Cs+))设计为25 mg·L-1、50 mg·L-1、100 mg·L-1和200 mg·L-1,以ρ(Cs+) 8.24 mg·L-1为对照(CK),均采用1/6改良霍格兰营养液配制处理液。用上述Cs+处理液在相同条件下培养已长出2片真叶的幼苗7 d、14 d和21 d后,取出幼苗,其根系依次用自来水冲洗、20 mmol·L-1Na2-EDTA浸泡清洗20 min(可有效除去根系表面的可交换Cs+)和去离子水冲洗,再将幼苗分为根、茎和叶3部分,液氮冷冻后,-80 ℃保存,备用。
1.2实验方法
亚细胞组分的分离采用差速离心法,略作改进[18-19]。称取冷冻保存的样品1.000 g,加入10 mL STM提取液(0.25 mol·L-1蔗糖,50 mmol·L-1Tris-HCl缓冲液(pH 7.5)和1 mmol·L-1巯基乙醇),冰浴上研磨成匀浆后,4 ℃下采用不同转速依次离心:①研磨匀浆置300 r·min-1离心30 s,沉淀为细胞壁组分(F1);②将①的上清液置2 000 r·min-1离心15 min,沉淀为细胞核与叶绿体组分(F2);③将②的上清液置10 000 r·min-1下离心20 min,沉淀为线粒体组分(F3),上清液为含核糖体、液泡的细胞液(cellsap)、胞质溶胶(cytosol)及内含物的可溶性组分(F4)。
采用湿法消解法(V(HNO3):V(HClO4)=3:1),将组分F1、F2、F3及植物根、茎、叶进行消解至澄清,消解液用去离子水定容至50 mL;组分F4中加入等量消解液后(为避免消解液造成检测结果的偏离),直接定容至50 mL。以STM提取液进行空白校零,用火焰原子吸收分光光度计(北京普析,TAS-990型)测定Cs+含量。实验用试剂均为分析纯,购自成都市科龙化工有限公司。
1.3数据分析与处理
转移系数(translocation factor, TF)和生物富集系数(bioaccumulation factor, BCF)计算公式分别为:TF=C地上/C地下,BCF=C总/C0,其中C地上、C地下和C总分别表示蚕豆幼苗地上部分、地下部分和全株的Cs+含量(mg·kg-1FW),C0表示ρ(Cs+) 8.24~200 mg·L-1处理液原始浓度(mg·L-1)。
采用SPSS 18.0软件对数据进行方差分析,LSD多重比较,Origin 9.0作图。
2 结果 (Results)
2.1蚕豆根、茎和叶对Cs+的富集特征
用ρ(Cs+) 8.24~200 mg·L-1溶液培养蚕豆幼苗一段时间(7 d, 14 d, 21 d)后,Cs+吸附在根系表面,用螯合剂(Na2-EDTA)浸泡清洗和蒸馏水淋洗,可除去根系表面的可交换Cs+,排出其在分步提取时对各器官Cs+定量分析的干扰。结果显示,蚕豆根、茎、叶对Cs+的富集量随处理时间延长而增加,其生物富集系数(BCF)最高达到CK的30.99倍,蚕豆生物富集系数(Y1)与处理时间(T)、处理浓度(C)之间存在极显著的线性关系(R2为0.933,P<0.01),对Cs+的转移系数(Y2)仅为0.20~0.54,各参数间相关性分析不显著(R2为0.085,P>0.05) (表1)。随ρ(Cs+)增加,各器官对Cs+的蓄积量均显著增加(P<0.05),且根>叶>茎(图1~3),根中Cs+含量最高达到518.40 mg·kg-1FW(7 d)、1 949.74 mg·kg-1FW(14 d)和3 614.03 mg·kg-1FW(21 d) (图1);相关性分析结果显示(表2),蚕豆根、茎、叶内Cs+的蓄积量(Y3)与ρ(Cs+)浓度(C)和处理时间(T)也呈现良好的正相关性(R2分别为0.784、0.697和0.769,P<0.01)。结果表明,蚕豆对Cs+具有较强的富集能力,根部是吸收和蓄积Cs+的主要营养器官,并将吸收的绝大部分Cs+(65.13%~83.17%)滞留在根部,向地上部分的转运量相对较低,这可有效缓解Cs+对地上部分营养器官生长代谢的影响甚至损伤,这是蚕豆在短期内生长良好的主要原因,也是蚕豆对Cs+胁迫的一种重要的解毒机理。
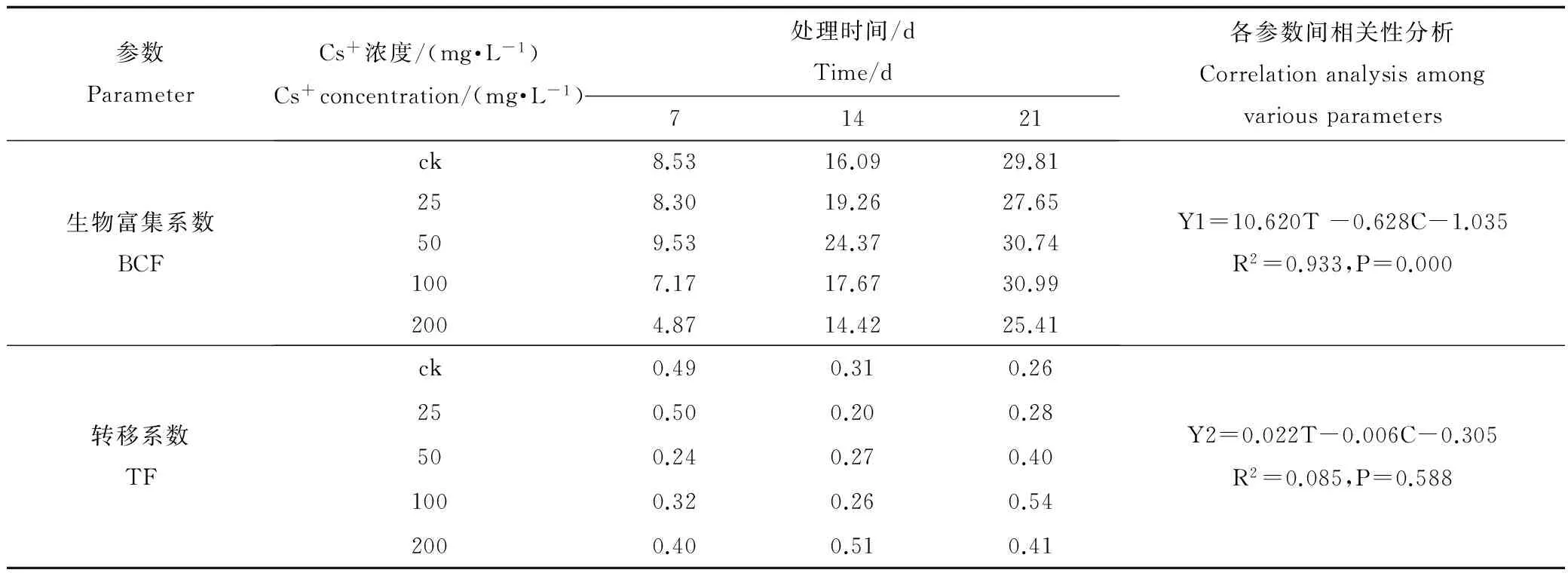
表1 蚕豆幼苗对Cs+的生物富集系数及转移系数
注:Y1表示生物富集系数;Y2表示转移系数;T表示处理时间;C表示Cs+浓度。
Notes:Y1, Y2, T and C indicate BCF, TF, treatment time and Cs+concentration, respectively.

图1 蚕豆根中Cs+的蓄积量注:同一图例不同小写字母表示差异显著(P<0.05),下同。Fig. 1 Accumulation of Cs+ in roots of Vicia fabaNote: Different letters in the same legend indicate a significant difference at the 5% level (P<0.05), the same below.
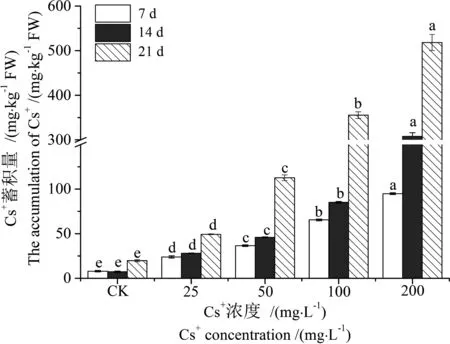
图2 蚕豆茎中Cs+的蓄积量Fig. 2 Accumulation of Cs+ in steams of Vicia faba
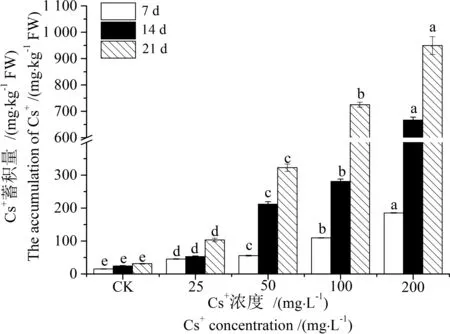
图3 蚕豆叶中Cs+的蓄积量Fig. 3 Accumulation of Cs+ in leaves of Vicia faba

表2 蚕豆营养器官Cs+蓄积量(Y3)与不同
2.2蚕豆根、茎、叶中Cs+的亚细胞分布
2.2.1根中Cs+的亚细胞分布
表3可见,蚕豆根不同亚细胞组分的Cs+含量随ρ(Cs+)递增而显著增加(P<0.05),且细胞壁>可溶性组分细胞核/前质体>线粒体。当ρ(Cs+) 200 mg·L-1时,不同处理时间的细胞壁Cs+含量分别达到577.44 mg·kg-1FW (7 d)、669.78 mg·kg-1FW (14 d)和1 133.79 mg·kg-1FW (21 d),其富集量分别是CK的22.53倍、17.14倍和15.05倍。各亚细胞组分的Cs+含量占总量的比例(即相对含量)呈现相同的变化趋势(图4),细胞壁和可溶组分中Cs+的相对含量为75.84% ~ 99.06%,细胞器(细胞核/前质体和线粒体)中的Cs+仅为0.94%~24.16%。结果表明,根中Cs+的亚细胞分布主要集中在细胞壁和可溶组分,细胞核/前质体和线粒体对Cs+的富集量较低,这种亚细胞区域化分布可极大地降低Cs+对根细胞器和功能性复合物的损伤。

图4 蚕豆根亚细胞组分中Cs+的相对含量注:F1为细胞壁;F2为细胞核/前质体;F3为线粒体;F4为可溶性组分。Fig. 4 Relative contents of Cs+ in subcellular fractions of Vicia faba rootsNotes: F1~ F4 indicate the cell wall, nucleus and proplastid, mitochondrion, ribosome and soluble fraction, respectively.

表3 蚕豆根中Cs+的亚细胞分布
注:同一列中不同小写字母表示均值多重比较的差异显著性(P<0.05);“*”表示低于检出下限,下同。
Note: Different letters in the same column indicate a significant difference at the 5% level. “*” indicate below detection limits of Cs+contents. The same below.
2.2.2茎中Cs+的亚细胞分布
表4可见,蚕豆茎中Cs+的亚细胞分布与根略有不同,为可溶性组分>细胞壁>细胞核/叶绿体>线粒体。当ρ(Cs+)达到200 mg·L-1时,处理7~21 d时可溶性组分Cs+含量分别为55.38 mg·kg-1FW、110.33 mg·kg-1FW和222.15 mg·kg-1FW (表4),Cs+的相对含量41.20%~63.71% (图5),明显高出根部的可溶性组分(11.08%~47.16%,图4);细胞器(细胞核/叶绿体和线粒体)对Cs+的富集量随处理时间延长而递增,Cs+的相对含量最高为20.94%(图5)。结果表明,茎中Cs+主要集中在细胞可溶性组分(F4)。
2.2.3叶中Cs+的亚细胞分布
表5可见,Cs+在蚕豆叶中的亚细胞分布与根中类似,各组分的Cs+含量随ρ(Cs+)递增而显著增加(P<0.05),主要分布在细胞壁,其相对含量为34.65%~70.05%,其次是可溶组分为29.95% ~ 57.39%,细胞器(细胞核/叶绿体和线粒体)Cs+的相对含量最高仅为17.05%(图6)。结果表明,蚕豆叶中大部分Cs+滞留在细胞壁上,细胞质基质和细胞器中Cs+的富集量较低。

图5 蚕豆茎亚细胞组分中Cs+的相对含量注:F1为细胞壁;F2为细胞核/叶绿体;F3为线粒体;F4为可溶性组分。Fig. 5 Relative contents of Cs+ in subcellular fractions of Vicia faba stemsNotes: F1~ F4 indicate the cell wall, nucleus and chloroplast, mitochondrion, ribosome and soluble fraction, respectively.

表4 蚕豆茎中Cs+的亚细胞分布
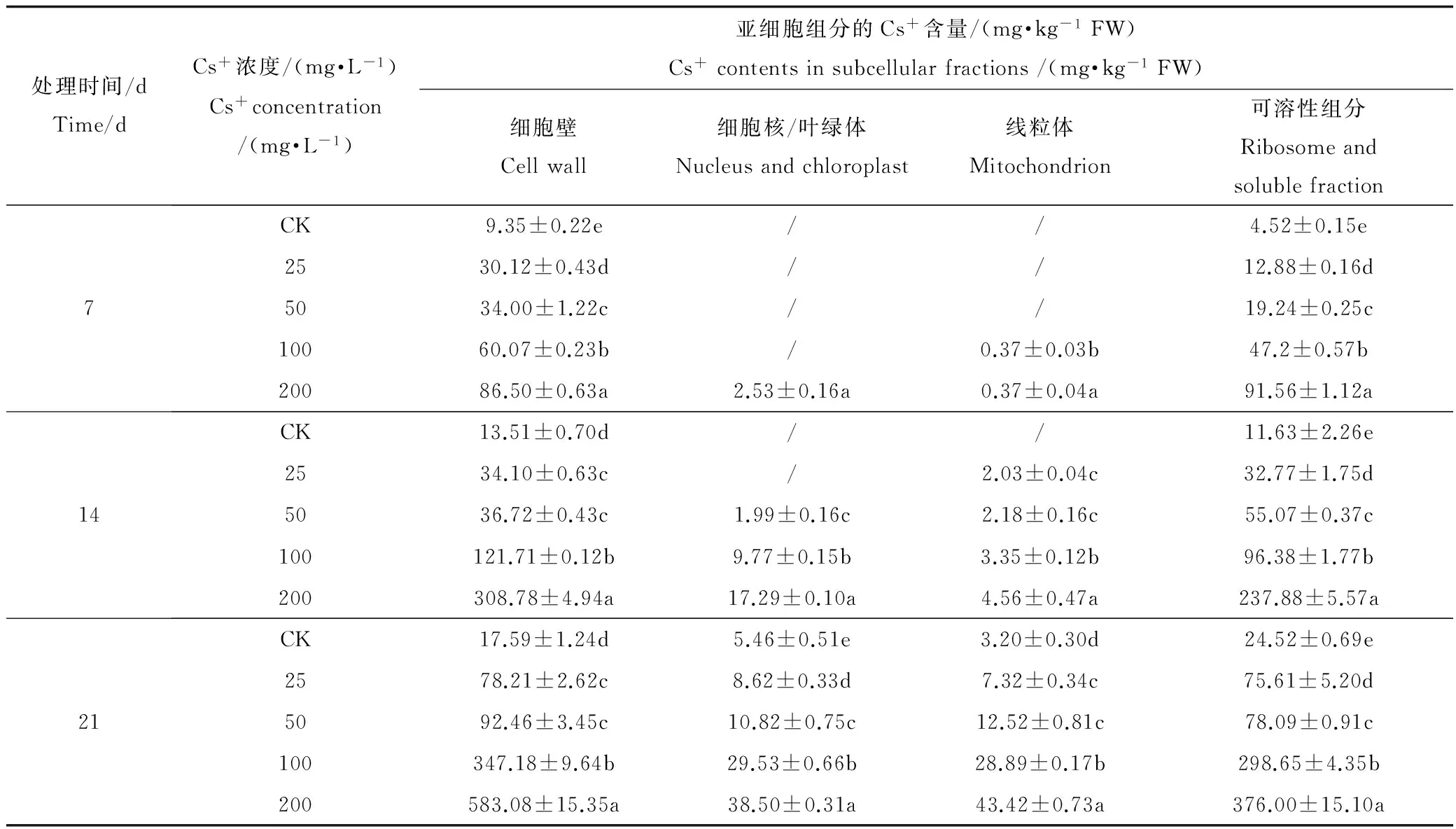
表5 蚕豆叶中Cs+的亚细胞分布

图6 蚕豆叶亚细胞组分中Cs+的相对含量注:F1为细胞壁;F2为细胞核/叶绿体;F3为线粒体;F4为可溶性组分。Fig. 6 Relative contents of Cs+ in subcellular fractions of Vicia faba leavesNotes: F1~ F4 indicate the cell wall, nucleus and chloroplast, mitochondrion, ribosome and soluble fraction, respectively.
3 讨论 (Discussion)
植物对重金属解毒的细胞学机制主要为4个方面:根细胞壁对重金属的滞留作用及外排作用;液泡区域化作用,即把重金属离子或其复合物转运至液泡内存贮,缓解重金属对细胞器和细胞质基质内功能性复合物的损伤;螯合作用,即依赖于细胞中金属螯合蛋白(植物络合素、金属硫蛋白)、还原型谷胱甘肽(GSH)、有机酸、半胱氨酸及低分子量巯基化合物等与重金属螯合,降低细胞内游离态重金属浓度;抗氧化系统清除活性氧[20]。其中,在组织水平上的根部滞留作用可有效阻止根细胞对金属离子的吸收和上行转移,避免了对叶肉细胞的损伤;在细胞水平上金属离子的区域化作用及细胞膜对离子的输出是降低细胞内金属离子水平的重要方式,在植物重金属耐性中具有重要意义[21]。
已有研究表明,镉(Cd2+)[22-23]、铅(Pb2+)[24]和锌(Zn2+)[19]等金属的亚细胞分布特征多为“细胞壁>可溶组分>细胞器”。本文结果显示,Cs+主要分布在根、茎、叶的细胞壁(图4~6,F1),表明蚕豆细胞壁是Cs+的主要富集位点。构成植物细胞壁的结构组分具有多样性,大多含有多糖、蛋白质、羟基、羧基、氨基和醛基等基团[25-26],可与Cs+以配位键的方式结合,有效阻止Cs+进入细胞,体现出细胞壁作为细胞与环境进行物质交换时的第一道屏障的防卫作用。当细胞壁结合位点达饱和后,Cs+可经过低亲和性的离子通道(被动转运)或高亲和性的转运蛋白(主动转运)进入细胞[27]。成熟植物细胞中中央液泡可占据细胞体积的90%以上,经高速离心后,可溶性组分(F4)中主要为液泡的细胞液(cellsap)成分。已有研究表明,细胞液中存在多种蛋白质、有机酸和有机碱[6],其负电荷基团可与Cs+以化学键的方式结合,导致细胞内的Cs+主要被限制在液泡内(图4~6,F4),有效降低了细胞质基质和细胞器中的Cs+含量。本文结果显示,细胞核/前质体或细胞核/叶绿体(F2)及线粒体(F3)等组分仅富集少量的Cs+(图4~6,F2和F3),极大地降低了Cs+对细胞器结构和功能产生损伤的风险,这是短期内(7d~21d)蚕豆未表现出明显中毒症状的原因,也是蚕豆耐受Cs+胁迫(ρ(Cs+)≤200 mg·L-1)的重要机理之一。
综上所述,蚕豆根、茎、叶细胞通过细胞壁的阻滞作用,将31.89%~87.98%的Cs+结合固定在细胞壁,并将进入细胞质基质的一部分Cs+转运到液泡内(11.08%~58.29%),暂时或“永久性”存贮,有效降低了胞质溶胶(cytosol)及内含物中Cs+的水平,极大地减缓了Cs+对细胞器的功能性损伤,这是蚕豆对Cs+具有较强耐受性的主要原因之一。蚕豆根部对Cs+的蓄积量占总量的65.13%~83.17%,地上部分Cs+含量仅占总量的16.83%~34.87%,表明蚕豆对Cs+具有较强的富集能力,但转移能力相对较弱(TF<1.0),与印度芥菜等超富集植物具有超强的转移能力(TF>1.0)有所不同[21],推测蚕豆细胞内膜系统中与Cs+转运相关的金属转运蛋白不足或缺乏,这一差异性的分子机制有待进一步研究。
通讯作者简介:陶宗娅(1957-),女,博士,教授,研究方向为植物逆境生物化学与分子生物学。
[1]Isaure M P, Fraysse A, Devès G, et al. Micro-chemical imaging of cesium distribution in Arabidopsis thaliana plant and its interaction with potassium and essential trace elements [J]. Biochimie, 2006, 88(11): 1583-1590
[2]Zhu Y G, Smolders E. Plant uptake of radiocaesium: A review of mechanisms, regulation and application [J]. Journal of Experimental Botany, 2000, 51(351): 1635-1645
[3]卢靖, 王颖松, 蒋育澄, 等. 金属铯的生物化学研究进展[J]. 稀有金属, 2006, 30(5): 682-687
Lu J, Wang Y S, Jiang Y C, et al. Progress in biochemical studies on metal cesium [J]. Chinese Journal of Rare Matals, 2006, 30(5): 682 - 687 (in Chinese)
[4]Ivshina I B, Peshkur T A, Korobov V P. The efficient accumulation of cesium ions by rhodococcus cells [J]. Mikrobiologiia, 2002, 71(3): 418-423
[5]张晓雪, 王丹, 李卫锋, 等.133Cs和88Sr在蚕豆苗中的蓄积及其辐射损伤效应[J]. 辐射研究与辐射工艺学报, 2010, 28(1): 48-52
Zhang X X, Wang D, Li W F, et al. Studies on accumulation of133Cs and88Sr in Vicia faba L. and irradiation damage effect [J]. Journal of Radiation Research and Radiation Processing, 2010, 28(1): 48-52 (in Chinese)
[6]Zhao Y, Wu J, Shang D, et al. Subcellular distribution and chemical forms of cadmium in the edible seaweed, Porphyra yezoensis [J]. Food Chemistry, 2015, 168: 48-54
[7]Li D, Zhou D. Toxicity and subcellular distribution of cadmium in wheat as affected by dissolved organic acids [J]. Journal of Environmental Sciences, 2012, 24(5): 903-911
[8]Soudek P, Valenová S, Vavríková Z, et al.137Cs and90Sr uptake by sunflower cultivated under hydroponic conditions [J]. Journal of Environmental Radioactivity, 2006, 88(3): 236-250
[9]Kang D J, Seo Y J, Saito T, et al. Uptake and translocation of cesium-133 in napiergrass (Pennisetum purpureum Schum.) under hydroponic conditions [J]. Ecotoxicology and Environmental Safety, 2012, 82(1): 122-126
[10]陈梅, 安冰, 唐运来. 苋菜、小麦和玉米对铯的吸收和积累差异[J]. 作物研究, 2012, 26(5): 512-517
Chen M, An B, Tang Y L. Difference in uptake and accumulation of cesium between amaranth, wheat and maize [J]. Crop Research, 2012, 26(5): 512-517 (in Chinese)
[11]黄运湘, 廖柏寒, 王志坤. 超积累植物的富集特征及耐性机理[J]. 湖南农业大学学报:自然科学版, 2005, 31(6): 693-697
Huang Y X, Liao B H, Wang Z K. The characteristics of bioaccumulation and tolerance mechanism of hyperaccumulator [J]. Journal of Hunan Agricultural University: Natural Sciences, 2005, 31(6): 693-697 (in Chinese)
[12]周琼. 我国超富集·富集植物筛选研究进展[J]. 安徽农业科学, 2005, 33(5): 910-912, 916
Zhou Q. Filtrations for hyperaccumulators and accumulators of heavy metal in contaminated soil [J]. Journal of Anhui Agricultural Sciences, 2005, 33(5): 910-912, 916 (in Chinese)
[13]Tsukad H, Hasegawa H, Hisamatsu S, et al. Transfer of137Cs and stable Cs from paddy soil to polished rice in Aomori, Japan [J]. Journal of Environmental Radioactivity, 2002, 59(3): 351-363
[14]Sahr T, Voigt G, Schimmack W, et al. Low-level radiocaesium exposure alters gene expression in roots of Arabidopsis [J]. New Phytol, 2005, 168(1): 141-148
[15]赖金龙, 陶宗娅, 吴国, 等. 邻苯二甲酸二丁酯对蚕豆胚根细胞微核形成的影响及毒理机制[J]. 生态毒理学报, 2014, 9(1): 107-113
Lai J L, Tao Z Y, Wu G, et al. Effect of di-n-butyl phthalate on cell micronucleus formation and the mechanism of toxicity in vicia faba radicle [J]. Asian Journal of Ecotoxicology, 2014, 9(1): 107-113 (in Chinese)
[16]中国环境监测总站. 中国土壤元素背景值[M]. 北京, 中国科学出版社, 1990: 87
[17]闻方平, 王丹, 徐长合, 等. 苏丹草对133Cs和88Sr胁迫响应及吸收积累特征研究[J]. 辐射研究与辐射工艺学报, 2009, 27(4): 213-217
Wen F P, Wang D, Xu C H, et al. Study on the stress responses and the characteristics of uptake and accumulation of Sorghum sudanense to133Cs and88Sr [J]. Journal of Radiation Research and Radiation Processing, 2009, 27(4): 213-217 (in Chinese)
[18]Hou M, Hu C J, Xiong L, et al. Tissue accumulation and subcellular distribution of vanadium in Brassica juncea and Brassica chinensis [J]. Microchemical Journal, 2013, 110(1): 575-578
[19]周小勇, 仇荣亮, 胡鹏杰, 等. 镉和铅对长柔毛委陵菜体内锌的亚细胞分布和化学形态的影响[J]. 环境科学, 2008, 29(7): 2028-2039
Zhou X Y, Qiu R L, Hu P J, et al. Effects of cadmium and lead on subcellular distribution and chemical form of zinc in Potentilla griffithii var. velutina [J]. Environmental Science, 2008, 29(7): 2028-2039 (in Chinese)
[20]Weng B, Xie X, Weiss D J, et al. Kandelia obovata (S., L.) Yong tolerance mechanisms to cadmium: Subcellular distribution, chemical forms and thiol pools [J]. Marine Pollution Bulletin, 2012, 64(11): 2453-2460
[21]孙涛, 张玉秀, 柴团耀. 印度芥菜(Brassica juncea L.)重金属耐性机理研究进展[J]. 中国生态农业学报, 2011, 19(1): 226-234
Sun T, Zhang Y C, Chai T Y. Research progress on tolerance of Indian mustard (Brassica juncea L.) to heavy metal [J]. Chinese Journal of Eco-Agriculture, 2011, 19(1): 226-234 (in Chinese)
[22]Su Y, Liu J L, Lu Z W, et al. Effects of iron deficiency on subcellular distribution and chemical forms of cadmium in peanut roots in relation to its translocation [J]. Environmental and Experimental Botany, 2014, 97: 40-40
[23]Xu Q S, Min H L, Cai S J, et al. Subcellular distribution and toxicity of cadmium in Potamogeton crispus L. [J]. Chemosphere, 2012, 89(1): 114-120
[24]He S, Wu Q, He Z. Effect of DA-6 and EDTA alone or in combination on uptake, subcellular distribution and chemical form of Pb in Lolium perenne [J]. Chemosphere, 2013, 93(11): 2782-2888
[25]Hernandez-Allica J, Garbisu C, Becerril J M, et al. Synthesis of low molecular weight thiols in response to Cd exposure in Thlaspi caerulescens [J]. Plant Cell Environment, 2006, 29(7): 1422-1429
[26]Kupper H, Lombi E, Zhao F J, et al. Cellular compartmentation of cadmium and zinc in relation to other elements in the hyperaccumulator Arabidopsis halleri [J]. Planta, 2000, 212(1): 75-84
[27]郝艳淑, 姜存仓, 夏颖, 等. 植物钾的吸收及其调控机制研究进展[J]. 中国农学通报, 2011, 27(1): 6-10
Hao Y S, Jiang C C, Xia Y, et al. A review on the mechanism of potassium uptake and regulation in plants [J]. Chinese Agricultural Science Bulletin, 2011, 27(1): 6-10 (in Chinese)
◆
Tissue Accumulation and Subcellular Distribution of Cesium inViciaFaba
Fu Qian1, Yang Leiyan1, Lai Jinlong1, Tao Zongya1,*, Wu Guo1, Luo Xuegang2
1. Life Science College, Sichuan Normal University, Chengdu 610101, China 2. Engineering Research Center of Biomass Materials (SWUST), Ministry of Education, Mianyang 621010, China
7 April 2015accepted 21 May 2015
This study examined the characteristics of Cs+accumulation and transportation, and the tolerance mechanism adopted by Vicia faba L. under Cs+stress. Seedlings at the two leaf stage were subjected to varing doses of Cs+(ρ(Cs+) 8.24(control)~200 mg·L-1) for 7, 14 and 21 days to investigate the effects on uptake, organ accumulation, and subcellular distribution of Cs+by differential centrifugation and atomic absorption spectroscopy. The accumulation of Cs+in plant organs displayed the following sequence: root>leaf>stem, 65.13%~83.17% of the Cs+was in the root. The highest accumulation levels of Cs+in the root were as much as 518.40 mg·kg-1FW (7 d), 1 949.74 mg·kg-1FW (14 d), and 3 614.03 mg·kg-1FW (21 d) when ρ(Cs+) was 200 mg·L-1. Subcellular distribution showed that 75.84%~99.06% of the Cs+was in the roots, 79.06%~100% in the stems, and 82.95%~100% in the leaves, and was localized in the cell walls and soluble fractions. Cs+accumulation was less in organelles (including the nucleus, chloroplast/proplastid and mitochondrion); this content was less than 25%. Most of the Cs+was adsorbed onto the cell wall by the way of retardation, the portion of Cs+in the cytosol was transported into vacuoles for provisional or permanent storage. Thus, the Cs+content in organelles was effectively reduced, while the damage risk from Cs+to organelles was greatly retarded. Thus, the cell walls and vacuoles may contribute jointly to the Cs+accumulation and tolerance in Vicia faba.
cesium; Vicia faba; accumulation; subcellular distribution; tolerance
国家核设施退役及放射性废物治理科研重点项目(14ZG6101); 四川省教育厅理工科重点课题(14ZA0030); 四川省生物质改性材料工程技术研究中心(西南科技大学)开放课题(12zxbk03); 四川省教育厅大学生创新创业训练计划项目(201410636040); 四川师范大学实验技术项目(SYJS2014-07)
付倩(1991-), 女, 四川绵阳, 硕士研究生, 研究方向为植物生态毒理学, E-mail: 821330377@qq.com;
Corresponding author), E-mail: t89807596@163.com
10.7524/AJE.1673-5897.20150407011
2015-04-07 录用日期:2015-05-21
1673-5897(2015)6-297-08
X171.5
A
付倩, 杨垒滟, 赖金龙, 等. 蚕豆对铯的吸收蓄积及亚细胞分布研究[J]. 生态毒理学报,2015, 10(6): 297-304
Fu Q, Yang L Y, Lai J L, et al. Tissue accumulation and subcellular distribution of cesium in Vicia faba [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 297-304 (in Chinese)
