四氯丙烯对稀有鮈鲫的急性毒性及安全浓度评价
2015-10-09胡传禄舒耀皋刘刚严虎汪丹武娟金昊坤姚洪伟
胡传禄,舒耀皋,刘刚,严虎,汪丹,武娟,金昊坤,姚洪伟
上海化工研究院检测中心,上海 200062
四氯丙烯对稀有鮈鲫的急性毒性及安全浓度评价
胡传禄,舒耀皋,刘刚*,严虎,汪丹,武娟,金昊坤,姚洪伟
上海化工研究院检测中心,上海 200062
采用半静态试验方式测试了四氯丙烯对稀有鮈鲫(Gobiocypris rarus)的急性毒性,试验浓度分别设定为0.25 mg·L-1、0.30 mg·L-1、0.36 mg·L-1、0.42 mg·L-1、0.50 mg·L-1和0.60 mg·L-1,同时进行空白对照(试验用水)和分散剂对照(体积分数为0.006%的吐温-80水溶液)试验。采用气相色谱法对试验溶液进行浓度分析,实测浓度分别为0.19 mg·L-1、0.25 mg·L-1、0.34 mg·L-1、0.40 mg·L-1、0.51 mg·L-1和0.64 mg·L-1,试验结果以实测浓度表示和统计。结果表明:四氯丙烯致稀有鮈鲫无死亡发生(EC0)的最高浓度为0.25 mg·L-1,导致稀有鮈鲫100%死亡(EC100)的最低浓度为0.51 mg·L-1。根据实测浓度,用SPSS(17.0)概率单位法求得四氯丙烯对稀有鮈鲫的半数致死浓度96 h-LC50为0.347 mg·L-1,95%置信区间为0.328 mg·L-1~0.361 mg·L-1。
四氯丙烯;稀有鮈鲫;急性毒性;安全浓度
稀有鮈鲫(Gobiocypris rarus)是我国特有的鱼种,由于其个体生长快、性成熟时间短、繁殖季节长而成为我国环保部推荐的化学品测试试验用鱼[1-2]。使用我国特有的供试生物进行生态毒理测试,对于评价化学物质对环境的影响具有更直接的意义。近年来,使用稀有鮈鲫进行急慢性以及胚胎发育毒性研究已有报道[3-4]。
氯代烃化合物是一种被广泛应用于制备制冷剂、聚亚胺脂发泡剂、生物杀虫剂和聚合物的原料。四氯丙烯是制备化学除草剂麦畏乳油和新型环保型制冷剂的主要中间体[5]。以四氯丙烯为原料,可以合成多种具有工业价值的氟氯化合物[6-7]。它具有挥发性,在水中不易降解。在化学品测试导则中属于难处理物[8]。目前有关四氯丙烯的毒性研究很少,多以大鼠为实验对象。Frederick等[9]用大鼠进行了为期4周的经口染毒亚慢性试验,100 mg·kg-1·d-1四氯丙烯及以上浓度组中大鼠出现剂量相关的体重下降与摄食下降,300 mg·kg-1·d-1四氯丙烯还导致大鼠肝脏病变。Joseph等[10]用四氯丙烯体外染毒大鼠小肠片段30 min后,导致谷胱甘肽含量减少约一半。此外,其对眼睛和皮肤有刺激作用。四氯丙烯对水生生物的毒性研究国内外尚未见报道。本文研究了四氯丙烯对稀有鮈鲫的急性毒性,可为评价四氯丙烯对水生生物的影响、制订废水排放浓度标准和渔业水质标准、防治污染和保护渔业资源等提供参考的依据。
1 材料与方法 (Materials and methods)
1.1试验样品
四氯丙烯,分子式C3H2Cl4,纯度≥99.7%,无色液体,密闭、阴凉、干燥保存。
1.2试验仪器
Agilent7890A型气相色谱仪,PB-10型pH计,JPBJ-608型覆膜电极溶解氧测定仪,ALB-224 220 g/0.1 mg Ⅰ型分析电子天平,PL403-IC 410 g/0.001 g Ⅱ型电子天平。
1.3试验用鱼
试验采用稀有鮈鲫(Gobiocypris rarus)为受试鱼种,购自中国科学院水生生物研究所。用于正式试验之前,在本实验室中驯养了112 d,适应期间该批鱼健康,没有发现死亡等异常现象。适应期间正常喂食,试验前24 h停止喂食[11]。驯养期间的条件为水:经过砂滤器、炭滤器、微滤器、紫外灯消毒和曝气后的自来水;光照:每天12 h;水温:(23±2) ℃;溶解氧浓度:高于空气饱和值的80%;试验按照用鱼总量的10%抽样,测其体长为(2.7±0.1) cm,体重为(0.260±0.031) g。参照物重铬酸钾对该批稀有鮈鲫急性毒性96 h-LC50值为233.334 mg·L-1,95%置信区间(192.321 mg·L-1~287.315 mg·L-1)。
1.4试验用水
试验用水用经过砂滤器、炭滤器、微滤器、紫外灯消毒和曝气后的自来水。水硬度为110 mg·L-1(以CaCO3计)。暴露在空气中曝气后,pH值在8.13到8.14范围内,溶解氧(D.O.)为8.48 mg·L-1到8.86 mg·L-1。
1.5暴露条件
试验周期:96 h;试验暴露方式:半静态试验方式(根据稳定性测试结果,每24 h更换试验溶液);负载量:约为0.25 g鱼·L-1;光照:每天12 h(灯光+自然光);水温:(23±2) ℃;溶解氧浓度:6.01 mg·L-1~8.89 mg·L-1;饲喂:无。
1.6试验设计
根据预试验的结果,在96 h鱼类全部存活的最高浓度(0.25 mg·L-1)到全部死亡的最低浓度(0.60 mg·L-1)的范围内以1.2的公比设定6个浓度,浓度分别为0.25 mg·L-1、0.30 mg·L-1、0.36 mg·L-1、0.42 mg·L-1、0.50 mg·L-1和0.60 mg·L-1。采用吐温-80分散溶解的方法配制试验溶液:称取0.5012 g四氯丙烯,用吐温-80溶解定容至50 mL,配制成10 024 mg·L-1的试验溶液贮备液。用移液管分别移取0.249 mL、0.299 mL、0.359 mL、0.419 mL、0.499 mL、0.599 mL试验溶液贮备液添加至10 L经曝气充分的试验用水底部,加盖后静置1 h。同时进行空白对照组和分散剂对照组试验,空白对照组为试验用水,分散剂对照组为0.6 mL吐温-80溶解至10 L试验用水的试验溶液(吐温-80体积分数为0.006%)。对照组和试验组都设3个平行,每个平行10尾鱼。
分别在试验开始和结束时测定对照组和浓度组的溶解氧、pH及温度值,并在96 h暴露期内每天测定1次。试验开始后3 h、6 h、24 h、48 h、72 h及96 h观察并记录试验鱼的死亡及毒性情况。记录任何明显的异常现象(如失去平衡,游泳的行为,呼吸功能,色素沉积等)。
1.7试验溶液浓度测定
1.7.1定量分析方法
Agilent7890A型气相色谱仪分析条件为检测器:ECD;检测器温度:300 ℃;载气:氮气;色谱柱:HP-5MS,30 m×320 μm×0.25 μm;柱流速:6.5 mL·min-1;进样口温度:270 ℃;不分流;进样量:0.5 μL~2 μL;程序升温:80 ℃平衡0.5 min,以10 ℃·min-1的速度升至100 ℃,保持1 min。
1.7.2定量分析方法验证
用正己烷配制四氯丙烯浓度为1.00 mg·L-1、0.50 mg·L-1、0.25 mg·L-1、0.10 mg·L-1、0.05 mg·L-1和0.025 mg·L-1的标准溶液,分析各浓度峰面积与浓度的线性关系,以及仪器精密度。配制0.10 mg·L-1、0.50 mg·L-1和1.00 mg·L-13个浓度梯度的四氯丙烯水溶液,每个浓度重复2次,根据每个浓度的平均峰面积求出浓度,并计算回收率。
1.7.3稳定性分析
配制1.00 mg·L-1的样品水溶液,将该溶液放置在与毒性试验相同的环境下,分别于0 h及每间隔24 h取样测定浓度。
1.7.4试验采样与浓度分析
分析方法根据国标优化而成[12]。采用气相色谱法测定试验开始和结束时、试验过程中每次换液前后的溶液浓度,各个平行中分别取样10 mL进行前处理后进行浓度分析。前处理方法为:准确量取10 mL水溶液于15 mL样品瓶中,加入2 mL正己烷,摇振3 min后静置。待分层完全后,根据各试验浓度组具体情况,直接取上层有机相测定,或者吸取一定量上层有机相用正己烷稀释后测定。
1.8数据处理
用SPSS(17.0版)概率单位法统计24 h、48 h、72 h和96 h-LC50值及95%的置信区间。
2 结果(Results)
2.1四氯丙烯定量分析方法
按外标法以每个浓度的平均峰面积对照样品浓度进行回归,得回归线性方程为:y=850945x-14202,R2=0.9996,线性范围是0.025 mg·L-1~1.00 mg·L-1。精密度和回收率结果分别见表1和表2。

表1 四氯丙烯定量分析的精密度
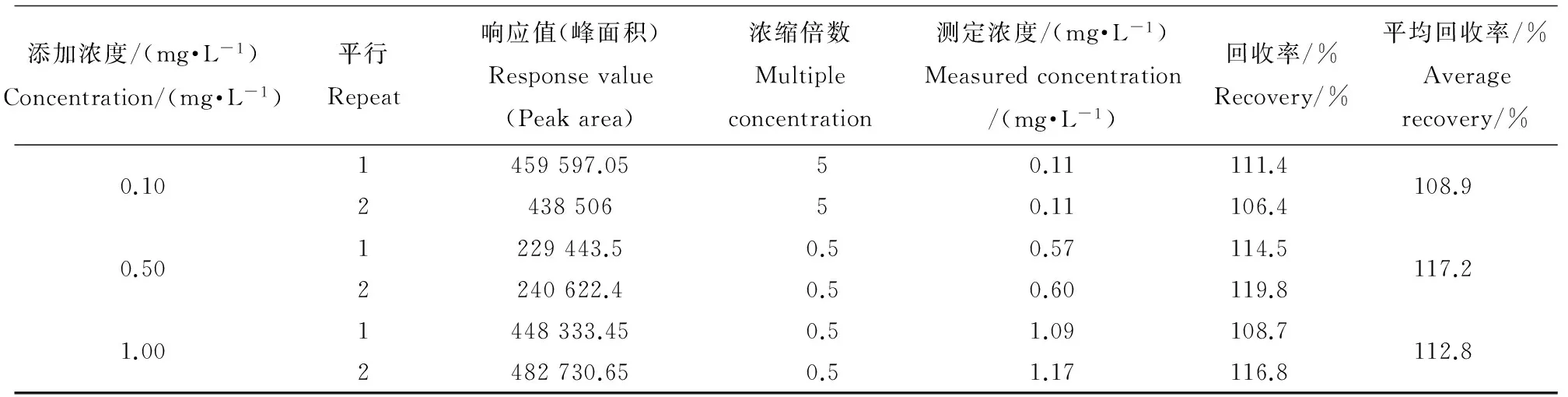
表2 四氯丙烯定量分析的回收率

表3 四氯丙烯在实验中的稳定性
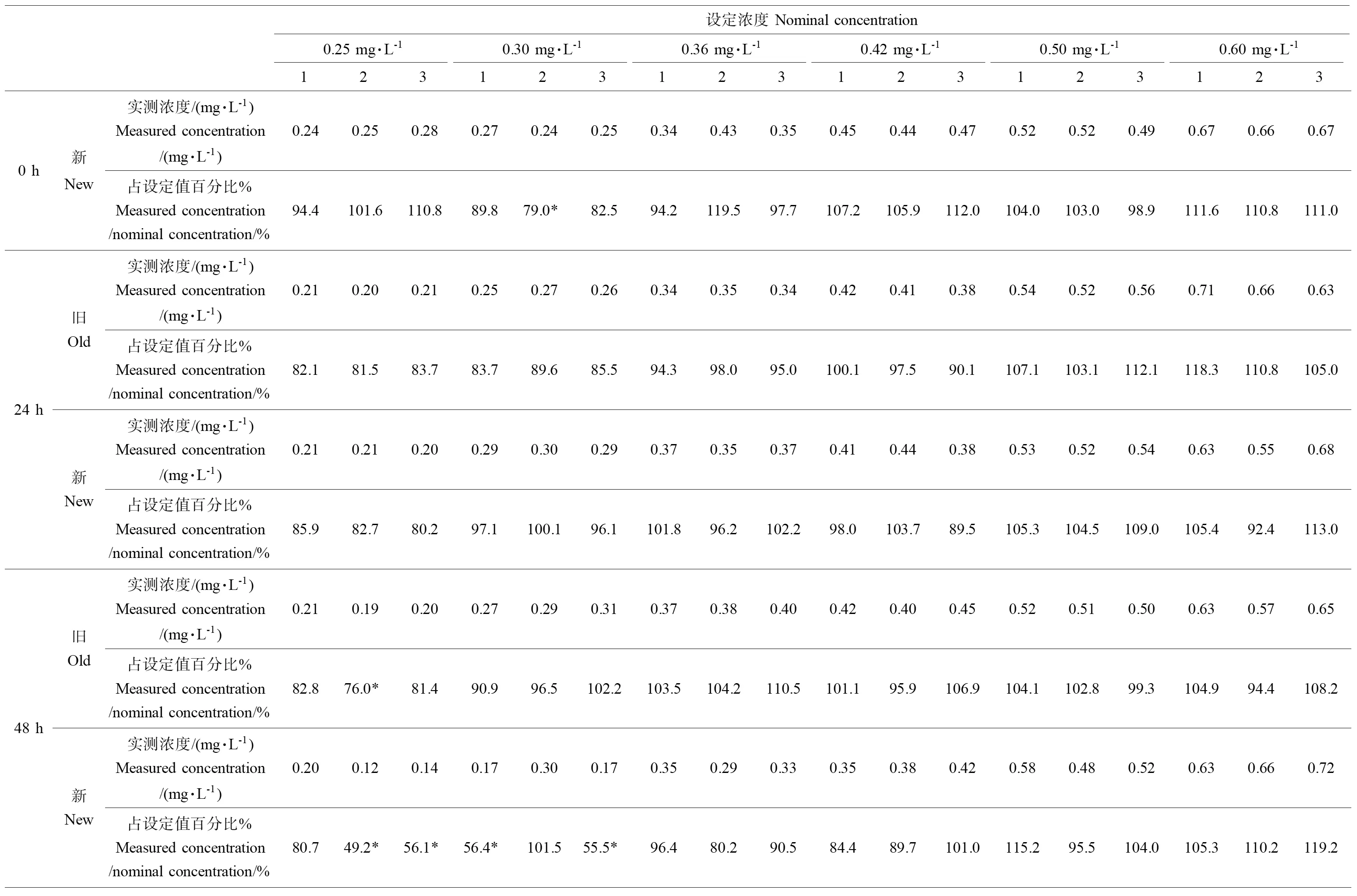
表4 四氯丙烯的试验实测浓度
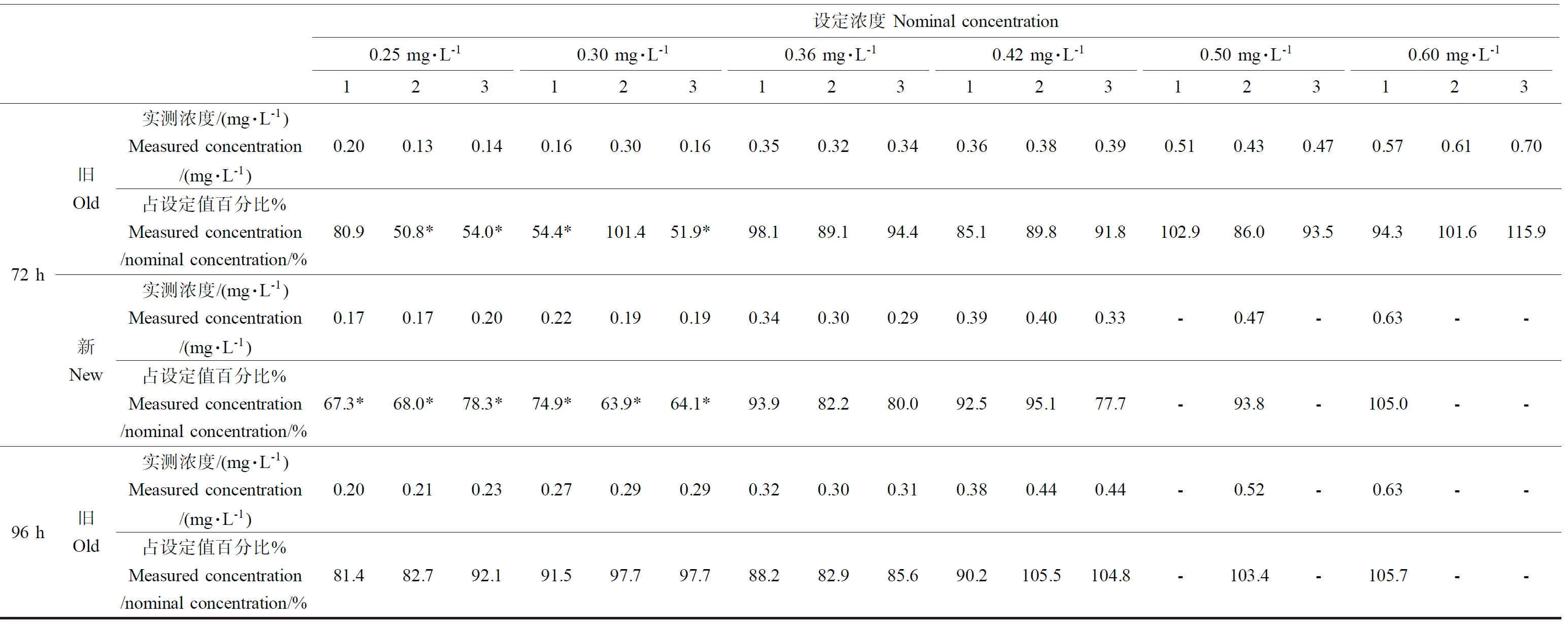
续表4
注:*表明未达到80%~120%的值;新表示新配制的试验溶液,旧表示换液前或试验结束时的试验溶液。
Note: * means the values not in the range of 80%-120%; New means test solution new prepared, Old means test solution before renewal or at the end of test.

表5 各试验组四氯丙烯的实测浓度(mg·L-1)
最低浓度0.025 mg·L-1测出的信号与基线噪音信号高度进行比较S/N=441.5,进样体积为2 μL,以三倍基线噪音得出仪器对该试验样品的最小检出量(LOD)为3.4×10-13g。配制0.001 mg·L-1样品正己烷溶液,分别重复进样6次。计算得到的6次重复进样的相对标准偏差(RSD)为1.16%,达到精密度的要求(一般为<20%)[13]。故最低检测浓度(LOQ)为0.001 mg·L-1。
2.2四氯丙烯稳定性分析
稳定性测试的结果(表3)表明,四氯丙烯的水溶液在48 h内能够维持初始测定浓度的80%~120%。但由于样品具有挥发性,为了尽量保持试验溶液中样品浓度保持在设定浓度,鱼类毒性试验采用半静态试验方法,每隔24 h更换药液。
2.3四氯丙烯浓度测定结果
根据测定结果(表4),在试验第48小时和第72小时时0.25 mg·L-1、0.30 mg·L-1浓度组部分试验溶液浓度没有达到设定浓度的80%~120%,因此试验结果采用实测浓度表示,实测浓度采用4次新配制溶液和换液前实测浓度的几何平均浓度的几何平均值表示,分别为0.19 mg·L-1、0.25 mg·L-1、0.34 mg·L-1、0.40 mg·L-1、0.51 mg·L-1和0.64 mg·L-1,结果见表5。
2.4稀有鮈鲫毒性试验结果
试验期间空白对照组和分散剂对照组均未发生死亡现象,0.19 mg·L-1和0.25 mg·L-1试验浓度组稀有鮈鲫出现侧翻、失衡中毒症状;0.34 mg·L-1和0.40 mg·L-1试验浓度组稀有鮈鲫出现死亡以及侧翻、失衡、麻痹、瘫痪中毒、游动能力减弱症状;0.51 mg·L-1和0.64 mg·L-1试验浓度组稀有鮈鲫全部死亡。各浓度组的累积死亡率见表6。
2.5四氯丙烯对稀有鮈鲫EC0、EC100及LC50
试验期间,无死亡发生的最高浓度为0.25 mg·L-1;导致100%死亡的最低浓度为0.51 mg·L-1;根据实测浓度,用SPSS(17.0)概率单位法求得该样品对稀有鮈鲫的半数致死浓度LC50(24 h、48 h、72 h、96 h)及95%置信区间见表7。
3 讨论(Discussion)
四氯丙烯对稀有鮈鲫的96 h-LC50为0.347 mg·L-1,由此可见,稀有鮈鲫作为我国特有的鱼种,对于评价化合物毒性具有很好的灵敏度。按照国家环保部《环境监测技术规范》生物监测(水环境)部分中化学物质对鱼类毒性等级的划分[14],四氯丙烯属于剧毒物质,在环境中的排放量应加以严格控制。
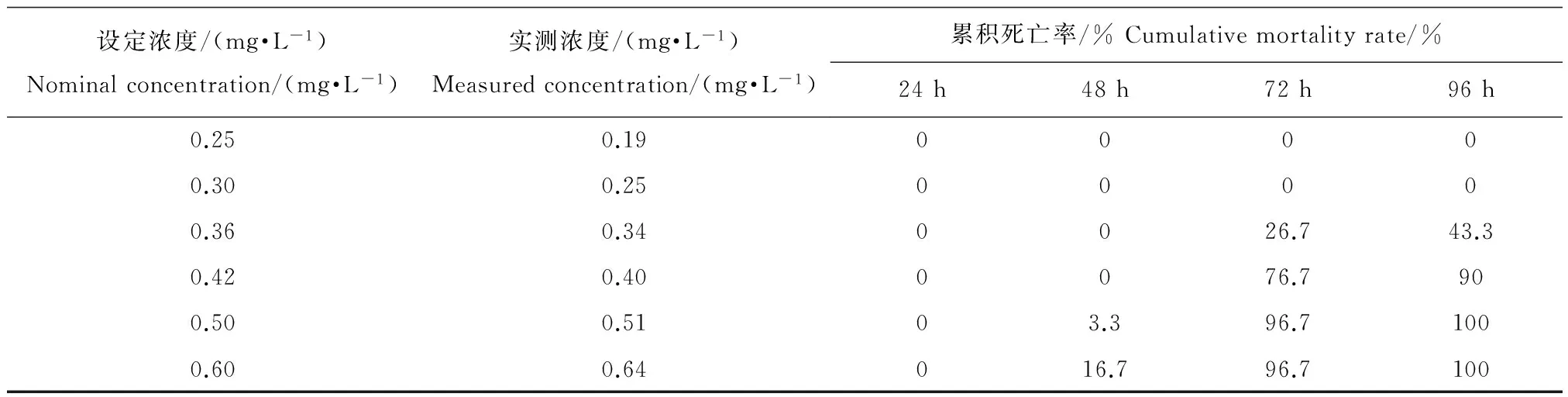
表6 试验期间各浓度组中稀有鮈鲫的累积死亡率
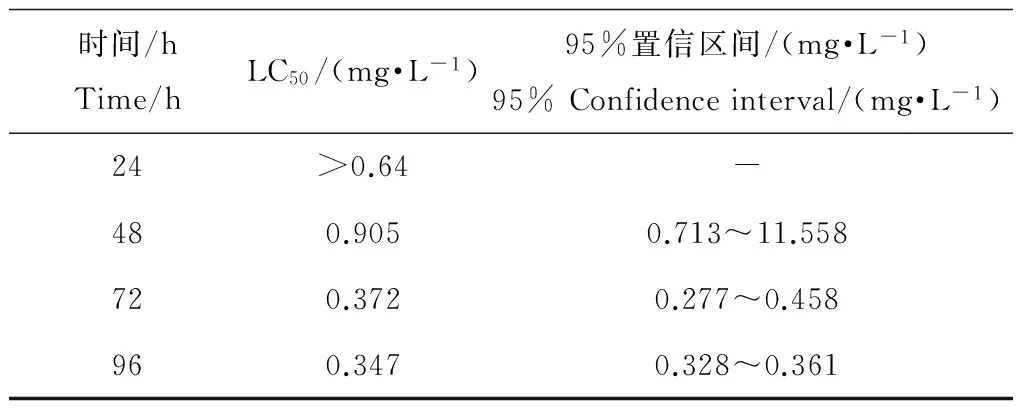
表7 四氯丙烯对稀有鮈鲫的LC50及95%置信区间
环境中有机污染物的毒性按照作用类型分为麻醉型毒性和反应型毒性[15],麻醉型毒性又分为非极性和极性2种类型,其中非极性麻醉型化合物主要表现为污染物对膜的穿透和破坏作用,基本上不与生物大分子结合,而极性麻醉型化合物分子结构中含有强失电子基团,如含羟基、氨基的芳烃化合物。四氯丙烯中的双键与氯代基团使其可能成为典型的极性麻醉型化合物。本研究中稀有鮈鲫出现侧翻、失衡、麻痹、瘫痪的中毒症状,说明四氯丙烯对稀有鮈鲫确实有麻醉作用。此外,郭远明等[16]对另一种氯代烯烃四氯乙烯进行了水生生物毒性研究,推断四氯乙烯也属于极性麻醉型化合物。
汪红军等[17]研究了四氯乙烯对稀有鮈鲫的急性毒性,96 h-LC50为30.36 mg·L-1,毒性小于四氯丙烯。根据美国环保局开发的EPI Suite软件预测,四氯乙烯和四氯丙烯的LogKow值分别为2.97和3.27,由此可见四氯丙烯具有更高的亲脂性,可能其更易与鱼体内的生物大分子结合,导致其更高的毒性。然而,氯代烃的毒性大小可能还与碳链长度、不饱和度、氯代数量有关,目前尚未有其他的氯代烃水生生物毒性研究报道,还需进一步通过试验验证。
对于水溶液浓度降低的不稳定物质,可以通过以下方法判断浓度降低的原因:将新配制的同一样品水溶液取3份放置在不同的条件下:①光照下容器开放,②光照下容器密封,③黑暗中容器密封。在24 h后分析比较3份水样的浓度,若②=③>①,说明挥发是浓度降低的主要因素;若③>②=①,说明光解是浓度降低的主要因素。像四氯丙烯这样的挥发性物质,在做鱼类急性毒性试验时,可以通过采取密封、减少试验溶液顶部空间、增加试验溶液更换频率等方式减少浓度变化带来的影响。
[1]周永欣, 成水平, 胡炜, 等. 稀有鮈鲫——一种新的鱼类毒性试验材料[J]. 动物学研究, 1995, 16(1): 59-63
Zhou Y X, Cheng S P, Hu W, et al. A new toxicity test organism-Gobiocypris rarus [J]. Zoological Research, 1995, 16(1): 59-63 (in Chinese)
[2]环保部化学品登记中心. 化学品测试方法, 生物系统效应卷[M]. 北京: 中国环境出版社, 2013: 30-36
[3]塔娜, 房彦军, 林本成, 等. 磷酸三(2,3-二氯丙基)酯阻燃剂对稀有鮈鲫的毒性效应[J]. 生态毒理学报, 2013, 8(5): 757-762
Tana, Fang Y J, Lin B C, et al. Toxic effect of tri(2,3-dichloroprophyl) phosphate flame retardant on rare minnow (Gobiocypris rarus) [J]. Asian Journal of Ecotoxicology, 2013, 8(5): 757-762 (in Chinese)
[4]熊力, 马永鹏, 毛思予, 等. 五氯酚对稀有鮈鲫胚胎毒性效应研究[J]. 中国环境科学, 2012, 32(2): 337-344
Xiong L, Ma Y P, Mao S Y, et al. Toxic effects of pentachlorophenol on the Chinese rare minnow embryos [J]. China Environmental Science, 2012, 32(2): 337-344 (in Chinese)
[5]赵新堂, 杨会娥, 刘坤峰, 等. 1,1,2,3-四氯丙烯制备技术研究进展[J]. 浙江化工, 2010, 41(8): 8-10
Zhao X T, Yang H E, Liu K F, et al. Research development on preparation technology of 1,1,2,3- tetrachloropropene [J]. Zhejiang Chemical Industry, 2010, 41(8): 8-10 (in Chinese)
[6]Mao W, Kou L G, Wang B, et al. Catalytic gas-phase fluorination of 1,1,2,3-tetrachloropropene to 2-chloro-3,3,3-trifluoropropene over the fluorinated Cr2O3-based catalysts [J]. Applied Catalysis A: General, 2015, 491: 37-44
[7]Wang F, Fan J L, Zhao Y, et al. Effects of yttrium-doping on the performance of Cr2O3catalysts for vapor phase fluorination of 1,1,2,3-tetrachloropropene [J]. Journal of Fluorine Chemistry, 2014, 166: 78-83
[8]OECD. ENV/JM/MONO. Guidance document on aquatic toxicity testing of difficult substances and mixtures [S]. OECD, 2000: 6
[9]Frederick R J, George J L, Edwin I G. Hepatic involvement of two chlorinated propenes following repeated oral exposure in the rat [J]. Toxicology Letters, 1991, 57(3): 347-352
[10]Joseph S, Patrick R D, Michael W N, et al. Antimutagenic effect of rat small intestine in vitro on 1,1,2,3-tetrachloropropene and 1,1,2,3,3-pentachloropropene [J]. Cancer Letters, 1984, 22(3): 305-314
[11]OECD. OECD Guidelines for Testing of Chemicals No. 203 “Fish, Acute Toxicity Test" [S]. OECD, 1992
[12]环境保护部. HJ639—2012 水质 挥发性有机物的测定 吹扫捕集/气相色谱-质谱法[S]. 北京: 中国环境科学出版社, 2012
[13]Chan C C, Lam H, Lee Y C, et al. Analytical Method Validation and Instrument Performance Verification [M]. John Wiley & Sons, Inc, 2004: 139-151
[14]国家环境保护局. 环境监测技术规范, 生物监测(水环境)部分[R]. 北京: 国家环境保护局, 1986: 95
[15]Blum D J W, Speece R E. Determining chemical toxicity to aquatic species [J]. Environmental Science & Technology, 1990, 24(3): 284-293
[16]郭远明, 李铁军, 张玉荣, 等. 四氯乙烯对黄姑鱼幼鱼和三疣梭子蟹的急性毒性[J]. 浙江海洋学院学报: 自然科学版, 2013, 32(6): 513-516
Guo Y M, Li T J, Zhang Y R, et al. Acute toxicity of tetrachloroethylene on larval Nibea albiflora and Portuns trituberculatus [J]. Journal of Zhejiang Ocean University: Natural Science, 2013, 32(6): 513-516 (in Chinese)
[17]汪红军, 李嗣新, 周连凤, 等. 4种有机污染物暴露对稀有鮈鲫呼吸运动的影响[C]. 乌鲁木齐, 第九届中国实验动物科学年会, 2010: 17-21
◆
Acute Toxicity Test of Tetrachloropropene to Rare Gudgeon and Determination of Safe Concentration
Hu Chuanlu, Shu Yaogao, Liu Gang*, Yan Hu, Wang Dan, Wu Juan, Jin Haokun, Yao Hongwei
Shanghai Research Institute of Chemical Industry Testing Centre, Shanghai 200062, China
21 April 2015accepted 18 September 2015
The 96 h acute toxicity of tetrachloropropene to freshwater organism rare gudgeon (Gobiocypris rarus) in semi-static exposure regime was measured in this study. The concentration was set as 0.25, 0.30, 0.36, 0.42, 0.50 and 0.60 mg·L-1, as well as a blank control (test water) and a dispersant control (0.006% V/V tween 80). Gas chromatography was used to analyze the test concentrations. The measured concentrations were 0.19, 0.25, 0.34, 0.40, 0.51 and 0.64 mg·L-1, which were used to express and calculate the test results. The result showed that the EC0was 0.25 mg·L-1, and the EC100was 0.51 mg·L-1. According to the measured concentrations, 96 h-LC50of tetrachloropropene to rare gudgeon was 0.347 mg·L-1, with the 95% confidence interval of 0.328 mg·L-1to 0.361 mg·L-1.
tetrachloropropene; rare gudgeon; acute toxicity; safe concentration
上海化学品公共安全工程技术中心专项(11DZ2282900)
胡传禄(1986-),男,工程师,研究方向为化学物质生态毒理测试,E-mail: huchuanlu500@163.com;
Corresponding author), E-mail: lgsds@vip.163.com
10.7524/AJE.1673-5897.20150421004
2015-04-21 录用日期:2015-09-18
1673-5897(2015)6-313-07
X171.5
A
胡传禄, 舒耀皋, 刘刚, 等. 四氯丙烯对稀有鮈鲫的急性毒性及安全浓度评价[J]. 生态毒理学报,2015, 10(6): 313-319
Hu C L, Shu Y G, Liu G, et al. Acute toxicity test of tetrachloropropene to rare gudgeon and determination of safe concentration [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 313-319 (in Chinese)
