基围虾冻藏过程中的品质变化
2015-10-09赵小余王嫒嫡王际辉
赵小余,肖 珊,张 铎,彭 聪,王嫒嫡,王 晗,王际辉
(大连工业大学食品学院,辽宁大连 116034)
基围虾冻藏过程中的品质变化
赵小余,肖珊,张铎,彭聪,王嫒嫡,王晗,王际辉
(大连工业大学食品学院,辽宁大连116034)
通过测定基围虾不同冻藏时间点(0、1、3、5、7周)质构、多酚氧化酶(PPO)活性、脂肪氧化、脂肪酸组成、风味及鲜度的变化,探究了对虾冻藏过程中品质变化的机理。结果表明,随着冻藏时间的延长,基围虾的黏附性逐渐增加,弹性、硬度、咀嚼性显著下降。PPO活性呈现先升后降的趋势。基围虾冻藏过程中脂肪氧化水平(TBARS)不断增加,饱和脂肪酸显著增加,多不饱和脂肪酸(PUFA)显著降低。基围虾冻藏过程中共检测出50多种挥发性风味物质,其中醇类和芳香族化合物含量降低,醛、酮及含氮化合物的含量增加。由ATP、ADP、AMP和HxR及Hx等鲜度指标的测定结果可知,基围虾冻藏7周后仍比较新鲜。虽然基围虾在冻藏过程中品质和营养价值降低,但仍较新鲜。
基围虾;冻藏;品质
0 引 言
基围虾,学名刀额新对虾(Metapenaeus ensis),新对虾属,对虾科,是重要的海产养殖品种,因其肉质鲜美和具有高蛋白低脂肪的营养特点而深受消费者的青睐。基围虾等虾类水产品具有高蛋白、高水分的特点,在氧化反应、微生物及内源酶的作用下极易发生腐败变质,导致食用品质下降,降低了经济价值。目前基围虾销售形式主要有鲜销和冻销两种方式,活体销售虽然能最大限度保持对虾的品质,但由于受地域等条件限制,鲜销仅限于沿海地区,对于离海较远的地区或出口到国外的产品多采用冻销的方式。
大量的研究表明,对虾冷冻贮藏期间在氧化反应、微生物和酶的作用下品质会发生下降,发生的品质变化主要有汁液流失、弹性的变化、颜色的变化、蛋白质变性、脂质氧化、鲜度的变化等[1-3]。这些变化会导致对虾发生黑变、酸败、产生异味、弹性降低、口感下降等,同时微生物的生长繁殖会造成水产品的腐败和变质[4-6]。因此如何提高水产品在冻藏过程中的品质显得尤为重要。虽然很多学者对对虾冻藏过程中的品质变化进行了研究,但是对基围虾冻藏过程中品质劣变方面的研究较少。
作者通过对基围虾不同冻藏时间点(0、1、3、5、7周)质构、多酚氧化酶活性、脂肪氧化、脂肪酸组成、风味及鲜度的变化情况的研究,揭示基围虾品质变化的机理,以期为对虾冻藏保鲜及品质评价体系的建立提供理论依据。
1 材料和方法
1.1原料处理
基围虾,购于瓦房店水产养殖场,捕捞后放入加冰海水中,在2h内运至实验室。挑选大小均一的鲜活基围虾,加冰猝死,装入密封袋中(20只/袋),于-18℃下冷冻贮藏。
1.2试剂
分析纯:丁基羟基茴香醚(BHA),三氯乙酸(TCA),硫代巴比妥酸(TBA),氯化钠,丙二醛,A-26阴离子交换树脂,氢氧化钠,甲醇,三氯甲烷,丙酮,氯化钾,磷酸二氢钾,磷酸氢二钾,无水硫酸钠,三氟化硼-甲醇(14%),高氯酸,氢氧化钾,乙二胺四乙酸,氯化镁,磷酸二氢钠,磷酸氢二钠;色谱纯:甲醇,正己烷。
1.3器材
电子天平,AL204,瑞士梅特勒;冷冻离心机,Z326K,天美(中国)科学仪器有限公司;质构仪,TA.XTPlus,北京微讯超技仪器技术有限;气相-质谱联用仪,7980GC-5975MS,AgilentTechnologies;旋转蒸发器,RE-524,上海亚荣生化仪器厂;分散机,T10BS25,IKA;高相液相色谱仪,e2695,沃特世科技(上海)有限公司;可调式旋涡混匀仪,MX-S,上海川翔生物科技有限公司;恒温水浴锅,DK-S24,上海森信实验设备有限公司。
1.4方法
1.4.1质构的测定
挑选大小均匀的虾样10只,于室温下解冻半小时,取每只虾胸部前两节,用质构仪测定其弹性、咀嚼性、硬度、内聚性、黏附性。
1.4.2多酚氧化酶活性的测定
称取基围虾头部肝胰腺4.0g(尽量保持其完整性),迅速放入冰浴离心管中,加入Na2HPO4-NaH2PO4缓冲液20mL(0.05mol/L,0℃,pH7.2),匀浆、过滤,将滤液离心(4℃,10000g,30min),上清液即为粗酶液,放入冰盒备用。以Na2HPO4-NaH2PO4缓冲液(0.05mol/L,0℃,pH7.2)配制0.05mol/L邻苯二酚溶液作为底物,配好的邻苯二酚溶液预先置于40℃的恒温水浴锅中,取粗酶液1mL加入邻苯二酚溶液14mL,于40℃下孵育10min,420nm波长处测定吸光度值,以14mL的邻苯二酚溶液添加1mL的缓冲液为对照组。每分钟增加吸光度值0.01所需的活性定义为PPO的一个活性单位(U)。
1.4.3脂肪氧化
取虾肉5.0g,切碎后加入蒸馏水15mL并用分散机最高速度匀浆15s(30000r/min)。将匀浆液3mL移至离心管中并加入BHA150μL(7.2%,溶解液为无水乙醇)和TBA/TCA缓冲液6mL(20mmol/LTBA,15g/L,TCA)。震荡混匀后在90℃水浴锅中孵育15min,孵育完成后冰浴10min,漩涡震荡混匀后离心(3000g,4℃,15min)。取上层样品于532nm下读取吸光值(日立,U-5100)。用蒸馏水3mL与TBA/TCA6mL作为空白对照,用样品中丙二醛(MAD,mg/kg样品)的含量来表示脂肪氧化(TBARS值)的程度。
1.4.4脂肪酸测定方法
样品总脂肪的提取主要参照Folch等[7]的方法并适当改进。具体操作方法如下:
1.4.4.1总脂肪的提取
微冻状态下称取对虾肌肉样品25g,加入氯仿和甲醇混合溶剂200mL(V(氯仿)∶V(甲醇)=2∶1),用分散机匀浆(30000r/min,1min)。砂芯漏斗抽滤除去结缔组织等杂质,在滤液中补入氯仿和甲醇混合溶剂(V(氯仿)∶V(甲醇)=2∶1),使溶液总体积为200mL,并充分混合均匀。加入混合液体总体积20%的氯化钾溶液(0.88%),充分混合均匀后转移至分液漏斗,避光,静置分层5h。将分液漏斗下面的氯仿层缓慢放到有适量无水硫酸钠的漏斗中过滤,并在圆底烧瓶中收集滤液,然后将烧瓶中的溶液在旋转蒸发仪上40℃水浴蒸干,最后用氮气吹干至恒重得到总脂肪质量,用于计算脂肪浓度。
1.4.4.2脂肪酸的皂化
将脂肪样品用氯仿准确稀释至100mg/mL,-20℃避光保存备用。取脂肪样品100mg于具四氟乙烯垫的旋盖样品瓶中,加入50%的KOH溶液2.5mL,95%乙醇溶液5mL,混匀后拧紧瓶盖,60℃水浴加热2h,大约每隔10min摇动1次。皂化完成后,在冰浴中迅速冷却至室温。使用正己烷萃取不可皂化物,每次加入4mL,萃取5次,将上层液体弃掉,下层混合物备用。
1.4.4.3脂肪酸的甲酯化
用6mol/L的盐酸将混合物pH调至1.0左右,用正己烷萃取,每次加入4.0mL,萃取5次;将正己烷层合并后用去离子水洗至中性并转移到试管,25℃下氮吹至恒重,并称重。加入氯仿,使脂肪酸质量浓度为20mg/mL。取2.5mL上述溶液于具塞三角瓶中,氮气吹干后加入丙酮-甲醇溶液15mL(2∶1,体积比),加入A-26树脂200mg(Sigma,USA),水平振摇30min(120r/min),静置后除去溶剂,用上述丙酮-甲醇溶液洗涤树脂5次(共15mL),室温下用氮气吹干树脂。取脂肪20mg于厌氧管中,加入三氟化硼-甲醇2.0mL(14%,Sigma,USA),沸水浴中加热2.0min。甲酯化反应完成的体系放冷后加入正己烷2.0mL,加入饱和NaCl溶液1.0mL使正己烷层上升。取出正己烷层1.5mL放入样品瓶中备用。
1.4.4.4脂肪酸组成的测定
用气相色谱-质谱联用仪进行测定。气相条件:Hp-5石英毛细管柱,He气体积流量1.0mL/min,分流比:10∶1。进样口温度:250℃。柱升温程序:起始温度170℃,保持2.0min,4℃/min升到250℃;30℃/min升到280℃保持3min。质谱条件:离子源温度230℃,传输线温度250℃,70eV扫描范围m/z 50~550。
1.4.5风味物质组成的测定
对虾样品去头去壳后,切碎,取虾肉3.0g于20mL顶空瓶中备用。风味物质用气相色谱-质谱联用仪测定,选用50μmDVB/CAR/PDMS萃取头。气相色谱条件:石英毛细管柱:Hp-5(60m× 0.32mm,液膜厚度1μm),平衡温度50℃,平衡时间10min,萃取时间30min,解吸温度250℃,解吸时间5min,萃取头老化时间30min,老化温度270℃,柱升温程序:起始温度35℃,保持1min,然后以5℃/min升到80℃,再以4℃/min升到150℃,最后以12℃/min升250℃,保持5min。质谱条件:电子轰击离子源(EI),电子能量70eV,离子源温度230℃,传输线温度250℃,扫描范围33~450u。
1.4.6鲜度变化的测定
1.4.6.1样品处理
微冻状态下精确称取虾样5.0g,加入体积分数6%的冷高氯酸15mL,匀浆,离心(4℃,10000g,20min),取上清液,用KOH调节pH至6.5,沉淀重复提取一次,合并上清液并用流动相定容至50mL。置于4℃冰箱静置30min,检测前用0.22μm的微孔滤膜过滤。
1.4.6.2色谱条件
用液相色谱进行测定。流动相:流动相A(pH6.5,0.05mol/LKH2PO4-K2HPO4):流动相B(甲醇)为9∶1,均用0.45μm的微孔滤膜过滤,体积流量0.7mL/min,洗脱时间15min,进样量10μL,检测波长254nm。
1.4.7数据统计与分析
每个实验指标设5个重复,用Excel2003进行数据处理,其值以“平均值±标准差”表示;并用SPSSStatistics20在P<0.05的水平上进行方差分析。
2 结果与讨论
2.1质构的变化
质构是表示水产品质量的一项重要指标,用来表征食品的组织状态、结构、口感等的综合感觉[8]。新鲜的对虾肉质紧实,在贮藏过程中会逐渐变得软绵[9]。本研究采用质构仪的TPA模式,模拟人的手指对不同冻藏时间点的虾肉进行测量,以硬度、弹性、黏附性、凝聚性、咀嚼性为指标,判断虾肉在冻藏期间的质构变化。
由表1可知,新鲜的基围虾肌肉的黏附性较小,随着冻藏时间的延长,黏附性显著性增加(P<0.05)。这可能是因为冻结贮藏期间蛋白质发生变性,二硫键等结合键被破坏,使肌肉细胞之间的结合力下降,从而导致肌肉的黏附性增加。
凝聚性表示对食物咀嚼时的抵抗性,用来模拟样品内部结合力[10]。肌肉咀嚼时的抵抗力大则凝聚性大,表明肌肉细胞间的结合紧密。从表1中可以看出,基围虾的凝聚性在冻藏过程中略微下降,且变化趋势不显著。导致这些变化的原因可能是肌肉在酶和微生物的作用下降解,肌肉组织松散,细胞间的作用力减小。

表1 冻藏过程中基围虾质构的变化Tab.1 Changes of structure during shrimp freezing storage
弹性反映了食物受外力作用时变形及去力后的恢复程度[11]。由表1可知,与新鲜的对虾比较,基围虾的弹性在冻藏的前3周显著下降,而从第5周开始,变化趋势趋于稳定。这可能是由于肌肉蛋白在冻藏期间发生变化,导致其弹性发生变化。Pornrat等[12]对虾肉微观结构的研究结果表明,随着冻藏时间的增加,虾肉肌原纤维的Z线密度逐渐减小并逐渐松散,I带M线也逐渐变宽,一段时间后,Z线、I带大量崩溃降解,肌肉之间的作用力减小。戴志远等[13]在研究贮藏期间大黄鱼(Pseudosciaenacrocea)的弹性时也发现弹性下降,他认为弹性的下降与肌球蛋白的变性导致的肌肉间结合力下降有关。
硬度表现为人体的触觉——柔软或坚硬,是使食品达到一定变形所需要的力,反映了食品保持形状的内部结合力[11]。Chamber等[14]认为肌肉的硬度对消费者来说是最首要的因素,它决定了肉的商品价值。随着冻藏时间的延长,对虾肌肉的硬度显著下降(表1)。这可能是由于冻藏过程中冰结晶的形成会对肌细胞造成机械损伤,促使肌肉蛋白质变性,从而导致肌肉硬度下降。另外,硬度的变化很可能与冻藏过程中酶的作用有关。有研究学者认为钙激活酶和组织蛋白酶可以作用于肌原纤维蛋白并促进肌原纤维蛋白降解[15]。
咀嚼性与硬度、凝聚性和弹性有关,是指将固体食品咀嚼到可吞咽时需做的功[11]。由表1可知,对虾肌肉在冻藏过程中咀嚼性显著降低(P<0.05)。咀嚼性的降低是肌肉硬度降低、肌肉细胞间凝聚力降低、肌肉弹性减小等综合作用的结果。这与其他几个指标测定的结果一致。
2.2多酚氧化酶
黑变病是在甲壳类动物捕获后由多酚氧化酶(PPO)作用而引起的一种常见的生理生化反应。PPO能够诱导酚类底物氧化生成醌类物质和其他中间产品,并发生自氧化和聚合反应,最终形成高分子化合物——黑色素[16-18]。
冻藏期间基围虾PPO活性的变化如图1所示,新鲜的基围虾的PPO活性较低,冻藏1周后,其活性升高,然后又逐渐降低。这可能是由于存储在细胞液及消化腺中的多酚氧化酶原在冻藏初期被释放并激活[19]。在冻藏过程中,对虾肌肉组织和细胞壁破裂,酶原激活物质被释放出来,导致在第1周时PPO的活性增加。有报道指出,蛋白酶就是一种重要的多酚氧化酶酶原激活物[20-21]。由图1可知,从第3周开始,PPO的活性降低,冻藏后期的变化趋势并不显著。这可能是因为低温(-18℃)抑制了PPO的增长。但是冷冻只能在一定程度上抑制PPO的酶活,减缓贮藏过程中对虾的黑变程度,却不能完全抑制黑变病的发生。Nirmal等[22]在研究中也指出,PPO在凡纳滨对虾冷冻、冰藏以及后期解冻过程中仍保持一定的活性。

图1 冻藏过程中基围虾PPO活性的变化Fig.1 The PPO activity changes during shrimp freezing storage
2.3脂肪氧化
TBARS值被广泛应用于脂肪氧化及丙二醛含量的测定中,丙二醛是由多不饱和脂肪酸氧化生成的过氧化物形成的[23]。冻藏过程中基围虾的TBARS值变化情况如图2所示。新鲜的基围虾的TBARS值为0.4μg/g左右,在冻藏过程中其值呈增加趋势,到第7周时达到3.5μg/g左右。这说明虽然基围虾中的脂肪含量较少,但其TBARS值在冻藏过程中不断增加,说明冻藏过程中基围虾内部的脂肪氧化反应仍在进行,从而导致TBARS值升高。Nirmal等[22]在研究中发现凡纳滨对虾的TBARS值在冻藏2~8d的过程中逐渐增加,当到达第10天时开始下降。Sampaio等[24]发现腌制及干制的虾肉的TBARS值为1.3mg/kg左右。Lu等[3]在研究中发现,在0~28d的冻藏过程中,中国毛虾的TBARS值由0.81mg/kg增加到2.19mg/kg。本研究结果与以上研究结果一致。

图2 冻藏过程中基围虾TBARS值的变化Fig.2 The changes of TBARS of the shrimp during the freezing storage
2.4脂肪酸组成
对虾等水产品中含有大量的多不饱和脂肪酸,不同冻藏时期脂肪酸组成的变化可以反映其脂肪酸生化特性及营养性的改变。基围虾总脂肪酸组成的结果如图3所示,实验中共检测到52种脂肪酸,具体组成的变化情况如表2所示。基围虾冻藏期间,饱和脂肪酸(SFA)由30.507%增加到35.913%,多不饱和脂肪酸(PUFA)由47.681%下降到42.075%,单不饱和脂肪酸(MUFA)在整个冻藏过程中的变化并不显著。由于脂肪酶和磷脂酶的作用,部分脂肪酸在冻藏过程中水解,生成游离脂肪酸,游离脂肪酸极易氧化。本实验的结果表明随着贮藏时间的延长,对虾脂肪氧化程度增加,多不饱和脂肪酸含量减少。这种现象很可能是因为脂肪酸在冻藏过程中发生氧化,生成饱和脂肪酸,从而导致了饱和脂肪酸含量的增加。从表2中可以看出,多不饱和脂肪酸主要有EPA(C20:5)和DHA(C22:6),两种脂肪酸的含量在冻藏过程中均略有下降。EPA和DHA具有很高的营养价值,其含量的下降表明基围虾在冻藏过程中营养价值降低。

图3 基围虾脂肪酸组成的GC-MS色谱图Fig.3 The GC-MS total ion chromatogram of the shrimp fatty acids
2.5风味物质组成
GC-MS被广泛应用于风味物质的测定中。本实验共测定出50多种风味物质,主要被分为醇、醛、酸、酮、酯、烷烃类、含氮化合物、芳香族化合物及其他九大类,这些物质含量的变化如表3所示。其中,醇类和芳香族化合物含量下降了,醛、酮及含氮化合物略微增加,而酸、酯、烃类物质在冻藏期间无显著变化。醇类物质的减少,可能是由于在贮藏过程中发生氧化反应而生成醛、酮类物质。有报道指出,不饱和醇具有独特的蘑菇的味道,且由于其阈值较低,对肉品特殊风物的形成具有重要作用[25]。醛、酮类物质的增加,可能是由于醇类氧化造成的;随着冻藏时间的增加,脂肪氧化生成的脂肪族醛含量也会增加。另外,甲基丁醛是Strecker降解反应的重要产物,有报道指出,Strecker醛存在于许多水产品中[26]。酮类的增加可能是由于冻藏过程中发生热分解、脂肪氧化、氨基酸变性以及美拉德反应所引起的[27]。所以醇类物质减少,醛、酮类物质的增加在一定程度上会导致基围虾风味的改变。含氮化合物主要包括吡啶、吡嗪以及挥发性盐基氮,如三甲胺等。吡啶及吡嗪具有较低的阈值,在其含量较低时,对水产品特殊风味的形成具有一定的积极作用,但当它们积累过多时,会造成不良风味[28]。实验中主要是由于三甲胺等挥发性氨氮的增加造成该组分值升高。三甲胺等主要是由蛋白质变性分解产生的,这说明在贮藏过程中,蛋白质发生了变性,产生了一定量的含氮化合物。这一结果与理化指标中TVB-N值增加相一致。芳香族化合物具有独特的气味,随着苯环上的氢被甲基等取代,其气味也会发生不同的变化。实验中测得的芳香族化合物主要有甲苯、间甲苯、邻二甲苯、乙苯以及萘类等,这些芳香族化合物的存在及对对虾等水产品风味的影响还需进一步研究。

表2 冻藏过程中基围虾脂肪酸组成的变化Tab.2 Composition of fatty acid changes during shrimp freezing storage%

表3 冻藏过程中基围虾风味物质组成的变化Tab.3 Changes of flavor composition during shrimp freezing storage%
2.6核苷酸及其关联化合物
ATP及其关联化合物是影响对虾呈味物质的重要因素,在某些甲壳类动物死亡后,如虾蟹类,ATP的分解遵循以下途径:ATP→ADP→AMP→AdR→HxR→Hx。图4为ATP及其关联化合物的标准品液相谱图,基围虾冻藏过程中ATP及其关联化合物含量的变化如表4所示。与新鲜的基围虾比较,冻藏过程中,ATP的含量逐渐下降。这说明在冻藏过程中,ATP降解生成其他关联化合物。而ADP含量则呈现先升高后下降的趋势,这可能是由于在贮藏初期,ATP分解生成ADP导致其含量增加,从第3周开始,ADP继续分解,生成其他化合物,导致含量降低。从表4中可以看出,冻藏过程中AMP的含量呈显著上升趋势,这可能是由于ATP、ADP分解产生大量AMP,由于甲壳类动物肌肉中的AMP脱氢酶活性较弱,因此很容易造成AMP的积累。而在0~7周的冻藏时间中,HxR及Hx的含量极少甚至几乎为0,这说明基围虾冻藏后仍比较新鲜,ATP降解生成的HxR及Hx很少。IMP是一种重要的鲜味物质,从表4中可以看出,与新鲜的基围虾比较,冻藏一周后,其IMP含量由15.39%下降到3.40%,而从第3周开始,其变化趋势并不显著。与刘亚在高效液相色谱法检测水产品中的ATP关联化合物中的研究结果比较,本实验所得的其他化合物中有一定含量的GMP,是很好的鲜味物质。
图4 核苷酸及其关联化合物标准品的液相色谱图Fig.4 The HPLC finger print of nucleotides standards
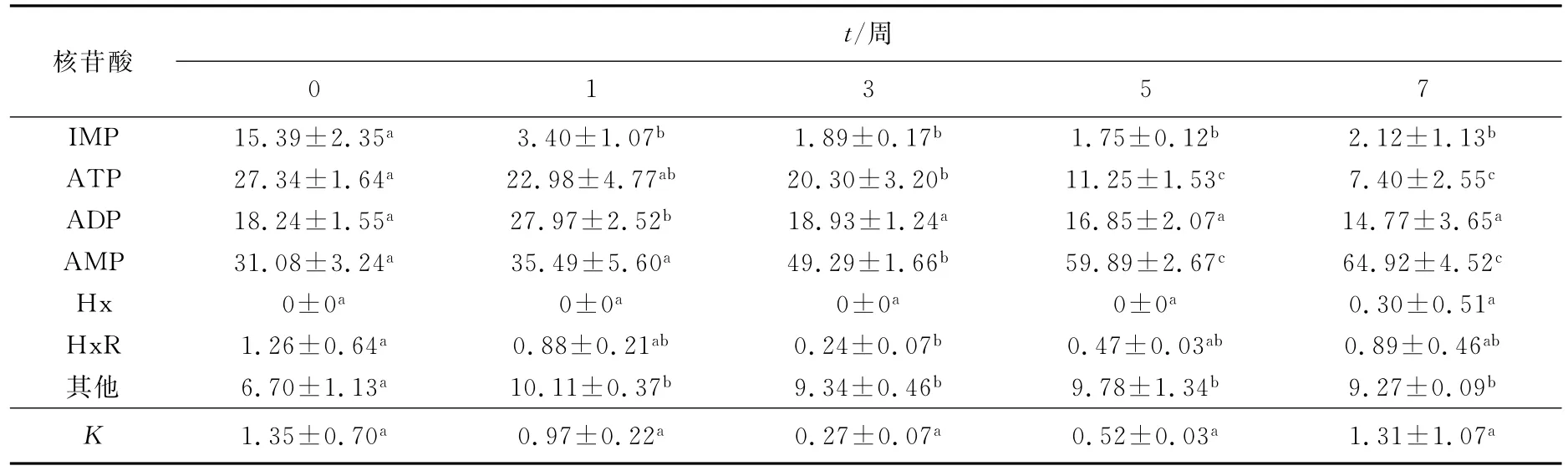
表4 冻藏过程中基围虾核苷酸及其关联化合物组成的变化Tab.4 Changes of nucleotides during shrimp freezing storage%
有报道指出,AMP可以使食物产生愉快的甜味和鲜味,而且能压抑苦味,是一种良好的鲜味剂,而IMP和GMP及其钠盐则是典型的鲜味剂。但ATP降解的最终产物Hx则带有浓厚的苦味会使虾的风味变差[29]。本实验测得基围虾冻藏过程中的AMP的含量不断增加,IMP含量下降,说明冻藏过程中基围虾的滋味及鲜味有一定的变化,但由于HxR及Hx含量很少,不会给食用品质造成较大的影响。薛长湖等[30]对养殖和海捕两类对虾的肌肉的ATP及其关联化合物含量进行鉴定,发现AMP是主要的核苷酸组分。这与本实验结果相似。

式中:K值是评价海产品在贮藏早期品质变化的重要指标,K越大,表明水产品鲜度就越差。一般认为,小于等于20%为一级鲜度上限;说明基围虾冻藏7周后仍具有很高的新鲜度,只是在滋味及口感上有一定的变化。
3 结 论
通过对基围虾不同冻藏时间点(0、1、3、5、7周)质构、多酚氧化酶活性、脂肪氧化、脂肪酸组成、风味及鲜度的变化情况进行研究,主要结果如下:随着冻藏时间的延长,基围虾的黏附性逐渐增加,弹性、硬度、咀嚼性显著下降,而凝聚性在冻藏过程中略微下降。基围虾的PPO活性先升高又逐渐降低;脂肪氧化程度显著增加,EPA和DHA比例降低,表明基围虾在冻藏过程中营养价值降低。基围虾冻藏过程中共检测出50多种风味物质,其中醇类和芳香族化合物含量下降,醛、酮及含氮化合物略微增加,而酸、酯、烃类物质在冻藏期间无显著变化。基围虾核苷酸及关联化合物的组成在冻藏过程中变化显著,但K值较低,说明基围虾在冻藏7周后仍较新鲜。
实验结果表明,基围虾冻藏7周后仍比较新鲜,但在口感、风味及滋味等方面均有不同程度的变化,表明其食用品质发生了一定改变。
[1]陈庆森,闫亚丽,杨晓庆,等.不同温度对刀额新对虾PPO活性、微生物指标及鲜度的影响[J].食品科学,2008,29(10):622-624.
[2]方静,朱金虎,黄卉,等.冰藏中凡纳滨对虾的质构变化研究[J].南方水产科学,2012,8(6):80-84.
[3]LUFei,ZHANGJian-you,LIUShu-lai,etal.Chemical,microbiologicalandsensorychangesof driedAceteschinensisduringacceleratedstorage[J].FoodChemistry,2011,127(1):159-168.
[4]GHALYAE,DAVED,BUDGES,etal.Fish spoilagemechanismsandpreservationtechniques:review[J].AmericanJournalofAppliedSciences,2010,7(7):859-877.
[5]沈月新.水产食品学[M].北京:中国农业出版社,2001:113-115.
[6]BEGUMM,KHALEQUEMA,WAHEDMA,etal.Qualityassessmentofshrimp(Macrobrachium rosenbergii.DeMan)duringstorageinice[J].BangladeshJournalofScientificandIndustrialResearch,2012,47(1):93-98.
[7]FOLCHJ,LEESM,STANLEYGHS.Asimple methodfortheisolationandpurificationoftotallipids fromanimaltissues[J].TheJournalofBiological Chemistry,1957,226(1):497-509.
[8]商连农.虾产品对美出口全攻略[J].农产品市场周刊,2005(46):22-26.
[9]HULTMANNL,RUSTADT.IcedstorageofAtlanticsalmon(Salmosalar):Effectsonendogenous enzymesandtheirimpactonmuscleproteinsandtexture[J].FoodChemistry,2004,87(1):31-41.
[10]李里特.食品物性学[M].北京:中国农业出版社,1998:107-109,113-115.
[11]姜松,王海鸥.TPA质构分析及测试条件对苹果TPA质构分析的影响[J].食品科学,2004,25(12):68-71.
[12]PORNRATS,SUMATET,ROMMANEES,etal.Changesintheultrastructureandtextureof prawnmuscle(Macrobrachuimrosenbergii)during coldstorage[J].LWT-FoodScienceandTechnology,2007,40(10):1747-1754.
[13]戴志远,崔雁娜,王宏海.不同冻藏条件下养殖大黄鱼鱼肉质构变化的研究[J].食品与发酵工业,2008,34(8):188-191.
[14]CHAMBERSEN,BOWERSJR.Consumerperceptionofsensoryqualityinmusclefoods[J].Food Technology,1993,47(11):116-120.
[15]KAURBP,KAUSHIKN,RAOPS,etal.Effect ofhigh-pressureprocessingonphysical,biochemical,andmicrobiologicalcharacteristicsofBlackTigerShrimp(Penaeusmonodon)[J].FoodandBioprocessTechnology,2013,6(6):1390-1400.
[16]HAARDNF,SIMPSONBK.Seafoodenzymeutilizationandinfluenceonpostharvestseafoodquality[M].NewYork:MarcelDekker,2000:135-138.
[17]FAULKNERMB,WATTSBM,HUMMHJ.Enzymaticdarkeningofshrimp[J].JournalofFood Science,1954,19(1/2/3/4/5/6):302-310.
[18]NIRMALNP,BENJAKULS.Effectofferulic acidoninhibitionofpolyphenoloxidaseandquality changesofPacificWhiteShrimp(Litopenaeusvannamei)duringicedstorage[J].FoodChemistry,2009,116(1):323-331.
[19]D AZ-TENORIOLM,GARC A-CARRE OFL,PACHEEO-AGUILARR.Comparisonoffreezing andthawingtreatmentsonmusclepropertiesofWhitelegShrimp(Litopenaeusvannamei)[J].Journalof FoodBiochemistry,2007,31(5):563-576.
[20]WANGZB,TAYLORKDA,YANXJ.Studies ontheproteaseactivitiesinNorwaylobster(Nephropsnorvegicus)andtheirroleinthephenolase activationprocess[J].FoodChemistry,1992,45(2):111-116.
[21]MART NEZ-LVAREZO,LPEZ-CABALLERO ME,MONTEROP,etal.4-Hexylresorcinol-based formulationtopreventmelanosisandmicrobial growthinchilledTigerPrawns(Marsupenaeusjaponicus)fromaquaculture[J].JournalofFoodScience,2005,70(9):M415-M422.
[22]NIRMALNP,BENJAKULS.Effectofgreentea extractincombinationwithascorbicacidontheretardationofmelanosisandqualitychangesofPacific whiteshrimpduringicedstorage[J].FoodandBio-processTechnology,2012,5(8):2941-2951.
[23]FERN NDEZJ,P REZ- LVAREZJA,FERN NDEZ-LPEZJA.Thiobarbituricacidtest formonitoringlipidoxidationinmeat[J].Food Chemistry,1997,59(3):345-353.
[24]SAMPAIOGR,BASTOSDHM,SOARESRA M,etal.Fattyacidsandcholesteroloxidationin saltedanddriedshrimp[J].FoodChemistry,2006,95(2):344-351.
[25]SHAHIDIF.Flavorofmeat,meatproducts,and seafoods[M].London:ChapmanandHall,1998:58-63.
[26]VARLETV,PROSTC,SEROTT.Volatilealdehydesinsmokedfish:Analysismethods,occurence andmechanismsofformation[J].FoodChemistry,2007,105(4):1536-1556.
[27]薛长湖,陈修白.养殖对虾挥发性物质的分离与鉴定[J].食品与发酵工业,1991(1):25-31.
[28]SHIBAMOTOT.VolatileFlavorChemicalsFormed bytheMaillardReaction[M].WashingtonDC:A-mericanChemicalSociety,1989:134-142.
[29]BREMNERHA.Nucleotidecatabolism:Influence onthestoragelifeoftropicalspeciesoffishfromthe northwestshelfofAustralia[J].JournalofFood Science,1988,53(1):6-11.
[30]薛长湖,陈修白.养殖和海捕两类中国对虾尝味成分的分析比较[J].青岛海洋大学学报,1991,21(3):91-100.
ThequalitychangesduringMetapenaeusensisfreezingstorage
ZHAOXiaoyu,XIAOShan,ZHANGDuo,PENGCong,WANGAidi,WANGHan,WANGJihui
(SchoolofFoodScienceandTechnology,DalianPolytechnicUniversity,Dalian116034,China)
Thequalitychanges(texture,PPO,TBARSvalue,compositionoffattyacid,flavor compoundsandnucleotides)ofshrimpMetapenaeusensisweremeasuredafterfreezing0,1,3,5and 7weeks.Theresultsshowedthatwiththestoragetimeincreased,theadhesivenessincreased gradually,springness,hardness,chewinessweresignificantlyreduced.PPOactivityofshrimps increasedfirstandthenreduced.TheTBARSvalueandSFAvalueincreasedwiththestoragetime prolonged.ThePUFAconcentrationdecreasedwhichindicatedthatthenutritionvalueofshrimp decreased.Morethan50volatileswereindentifiedinthisstudy.Amongthem,thealcoholsand aromaticsdecreasedandaldehydes,ketonesandnitrogencompoundsincreasedslightly.Through measuringtheparametersofATP,ADP,AMPandHxRandHx,itwasdemonstratedthatthe shrimpwasstillveryfreshafter7-weekfrozenstorage.Inconclusion,thequalityandnutritionlevel decreasedduringshrimp7-weekfrozenstorage,while,itwasstillfresh.
Metapenaeusensis;frozenstorage;quality
TS254.4
A
1674-1404(2015)02-0088-09
2014-04-09.
国家自然科学基金青年基金资助项目(31201386);辽宁省教育厅科学研究一般项目(L2012196).
赵小余(1989-),女,硕士研究生;通信作者:肖珊(1983-),女,讲师.
