南极磷虾油对小鼠免疫功能的调节作用
2015-10-09周大勇王君妍刘潇阳林竹一阴法文辛丘岩
周大勇,王君妍,刘潇阳,林竹一,郑 琳,阴法文,辛丘岩
(大连工业大学国家海洋食品工程技术研究中心,辽宁大连 116034)
南极磷虾油对小鼠免疫功能的调节作用
周大勇,王君妍,刘潇阳,林竹一,郑琳,阴法文,辛丘岩
(大连工业大学国家海洋食品工程技术研究中心,辽宁大连116034)
为研究南极磷虾油对小鼠免疫功能的影响,分别将高、中、低剂量(400、200、50mg/kg)全脂型虾油组(WKO)和磷脂型虾油组(PKO)每日灌胃1次。4周后测定小鼠免疫器官指数、淋巴细胞增殖能力、巨噬细胞吞噬能力及血浆IL-2、INF-γ水平。与空白组相比,高剂量PKO组小鼠胸腺指数显著升高;低、高剂量WKO组小鼠脾脏指数显著升高;中、高低剂量WKO组和低、中剂量PKO组小鼠淋巴细胞增殖能力显著提高;低、高剂量WKO组和中剂量PKO组小鼠巨噬细胞吞噬能力显著提高;3个剂量WKO组和低剂量PKO组小鼠血浆IL-2水平显著升高;低、高剂量WKO组和中剂量PKO组小鼠INF-γ水平显著升高。
南极磷虾油;小鼠;免疫调节;细胞因子
0 引 言
南极磷虾(Euphausiasuperba)是地球上数量最大的单种生物资源之一。最近的研究数据显示,南极磷虾的总生物量为3.79亿吨,年成虾产量为3.42~5.36亿吨[1]。南极磷虾油脂约占干基重量的10%~20%,主要由甘油酯、磷脂、游离脂肪酸、甾醇及虾青素组成[2],具有抑制肝脂肪化、抗过敏、降血脂、降血糖等作用[3-4]。
研究表明,鱼油能够增强小鼠的单核巨噬细胞吞噬功能[5]。相比之下,甘油三酯型鱼油在改善模型小鼠的血清溶血素水平及抗体生成细胞数,提高脾淋巴细胞转化能力,促进腹腔巨噬细胞的吞噬能力方面优于乙酯型鱼油[6]。虽然近年来南极磷虾油的活性研究较多,但其免疫调节作用尚未见报道。本实验研究了南极磷虾油对小鼠免疫功能的调节作用,为南极磷虾油的深入开发利用提供参考。
1 材料与方法
1.1实验材料
南极磷虾粉,辽宁省大连市海洋渔业集团公司,-20℃储藏备用;健康雄性昆明种小鼠(20± 2)g,大连医科大学实验动物中心。
CCK-8试剂盒,东仁化学科技有限公司;细胞因子(IL-2、TNF-γ)免疫测定试剂盒,上海酶联生物科技有限公司;RPMI-1640培养基、Hank’s平衡盐溶液,赛默飞世尔生物化学制品有限公司;聚乙二醇辛基苯基醚,美国西格玛奥德里奇贸易有限公司;台盼蓝,中科迈晨科技有限公司;其他试剂皆为国产分析纯。
1.2实验方法
1.2.1磷虾油的提取
分别采用正己烷及无水乙醇浸提全脂型南极磷虾油(WKO)及磷脂型南极磷虾油(PKO),浸提方法参照本课题组的前期研究[7]。
1.2.2实验动物分组和处理
昆明种小鼠于(25±2)℃下适应性饲养1周后,将小鼠分为8组,每组6只。第1组为空白对照组,灌胃生理盐水;第2组为阳性对照组,灌胃香菇多糖(10mg/kg),3~5组分别为全脂型虾油低剂量组(L-WKO)、中剂量组(M-WKO)、高剂量组(H-WKO),分别按体重灌胃50、200、400mg/kg;6~8组分别为磷脂型虾油低剂量组(L-PKO)、中剂量组(M-PKO)、高剂量组(HPKO),分别按体重灌胃50、200、400mg/kg。每日灌胃1次,持续4周(虾油溶解于医药级PEG400中)。实验期间动物可自由进食、饮水。4周后,将小鼠禁食12h,期间正常饮水,然后采集血液、脾脏、胸腺、腹腔细胞等标本用于后续实验。
1.2.3小鼠脾脏指数和胸腺指数
实验动物颈椎脱臼致死后,称取体重;小鼠解剖后,取脾脏及胸腺,准确称取质量。根据公式(1)和(2)计算脾脏指数和胸腺指数。

式(1)、(2)中:m1为小鼠脾脏质量,g;m2为小鼠胸腺质量,g;m为小鼠体重,g。
1.2.4小鼠淋巴细胞增殖活性的测定
1.2.4.1淋巴细胞的制备将处死后的小鼠放入75%乙醇中浸泡5min消毒,在无菌条件下,剪开皮肤和腹壁,剥离脾脏并称重,在200目尼龙网上用塑料注射器芯研碎脾脏获取单细胞悬液,用0.83%氯化铵破碎红细胞,用Hank’s液洗3次,1000r/min离心15min弃上清,加入完全培养基。用台盼蓝染色法检测细胞活性,保证活细胞数>95%,并调节细胞浓度为5×106个/mL[8]。
1.2.4.2南极磷虾油对淋巴细胞增殖活性的影响
采用CCK-8比色法测定南极磷虾油对淋巴细胞增殖活性的影响。在96孔细胞培养板内,每孔添加200μL相应实验组脾细胞悬液,细胞数为5×106个/mL,置于37℃、5%CO2饱和湿度的培养箱中培养24h。在培养结束前4h,向每孔中加入10μL的CCK-8。继续孵育4h。用多孔酶标测定仪于450nm处测定吸光度,测定及计算方法参照试剂盒说明书。
1.2.5小鼠腹腔巨噬细胞吞噬功能的测定
腹腔巨噬细胞吞噬功能根据LIU等[9]的方法检测。
在无菌条件下,用注射器向小鼠腹腔注入8mLHank’s平衡盐缓冲液,收集腹腔液,离心,弃上清,调整细胞密度为1×106个/mL,在无菌96孔板中分别每孔加入200μL的细胞培养液,置于37℃、5%CO2饱和湿度的培养箱中培养2h,弃上清,去除非贴壁细胞,每孔加入100μL完全培养基,在37℃下继续培养2h,每孔中加入100μL滤过的1%中性红生理盐水溶液,0.5h后弃上清,Hank’s平衡盐缓冲液洗3次。每孔加入200μL细胞裂解液,10min后于450nm处测定吸光值。巨噬细胞吞噬能力按公式(3)计算。
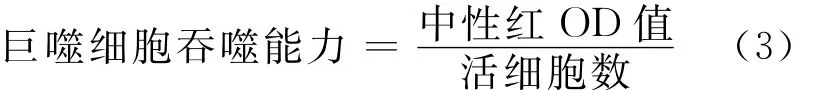
1.2.6细胞因子(IL-2、TNF-γ)的检测
小鼠血浆细胞因子水平检测根据酶联免疫试剂盒上的说明进行操作。
1.2.7统计学方法
数据以“平均值±标准偏差”表示(n=6)。采用SPSS16.0统计学软件对组间数据差异性进行单因素方差分析(One-AVOVA)、LSD法检验。
2 结果与讨论
2.1南极磷虾油对小鼠胸腺及脾脏指数的影响
图1为南极磷虾油对小鼠胸腺指数的影响情况,与空白对照组小鼠相比,阳性对照组及LWKO组、M-WKO组、L-PKO组和H-PKO组小鼠的胸腺指数均有增加,其中H-PKO组与空白组相比显著增加(*P<0.05)。
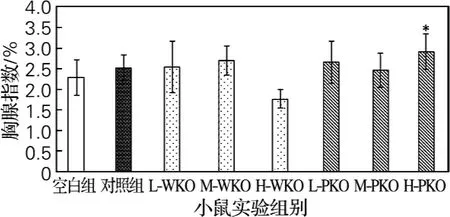
图1 南极磷虾油对小鼠胸腺指数的影响Fig.1 Effect of consumption of krill oils on thymus index of mice
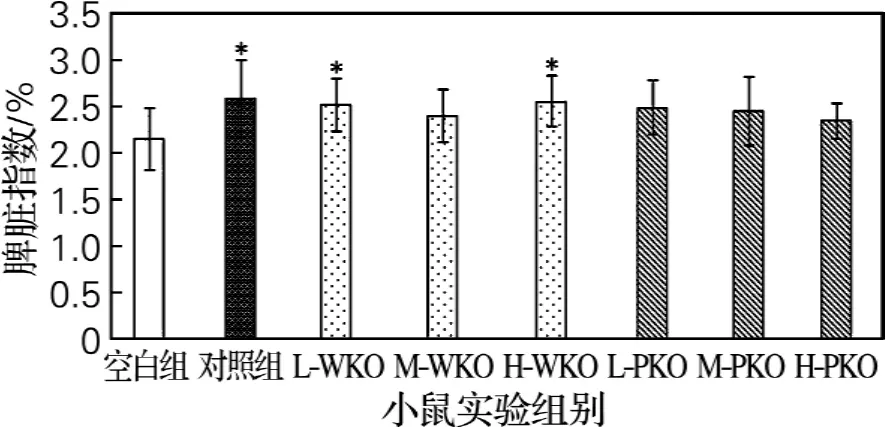
图2 南极磷虾油对小鼠脾脏指数的影响Fig.2 Effect of consumption of krill oils on spleen index of mice
免疫器官指数可反映机体免疫活性细胞的发育、增殖及功能状态。免疫保护剂或增强剂能增加机体脾脏和胸腺指数[10]。据报道,富含不饱和脂肪酸的碱蓬籽油具有增加免疫低下小鼠脾脏指数和胸腺指数的作用[11]。
2.2南极磷虾油对小鼠淋巴细胞增殖的影响
图3为南极磷虾油对小鼠淋巴细胞增殖能力的影响情况,与空白对照组小鼠相比,阳性对照组和所有虾油组小鼠淋巴细胞增殖能力均有所增加,其中阳性对照组、M-WKO组、L-PKO组及M-PKO组显著增加(*P<0.05),H-WKO组极显著增加(**P<0.01)。

图3 南极磷虾油对小鼠淋巴细胞增值的影响Fig.3 Effect of consumption of krill oils on the lymphocyte proliferation of mice
淋巴细胞的增殖和分化是免疫应答的一个重要阶段,能够直接反应免疫应答的能力。研究表明,高含量EPA/DHA甘油三酯型鱼油可显著提高免疫低下小鼠脾淋巴细胞转化能力[6]。
2.3南极磷虾油对小鼠巨噬细胞吞噬功能的影响
图4为南极磷虾油对小鼠巨噬细胞吞噬功能的影响情况,与空白对照组小鼠相比,阳性对照组和所有虾油组小鼠巨噬细胞吞噬能力均有增加,其中L-WKO组、H-WKO组与空白组相比显著增加(*P<0.05),M-PKO组极显著增加(**P<0.01)。
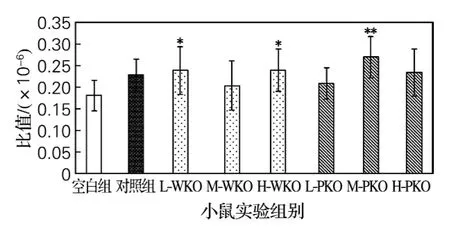
图4 南极磷虾油对小鼠巨噬细胞吞噬功能的影响Fig.4 Effect of consumption of krill oils on phagocytic function of macrophage of mice
吞噬细胞是机体非特异性免疫防御系统的重要组成部分之一,同时在特异性免疫应答的各个阶段也起重要作用。据报道,鱼油可显著改善免疫低下小鼠腹腔巨噬细胞吞噬能力,且高含量EPA/DHA甘油三酯型鱼油效果最优[6]。
2.4南极磷虾油对小鼠细胞因子的影响
2.4.1对小鼠血浆IL-2水平的影响
图5为南极磷虾油对小鼠细胞因子IL-2水平的影响情况,与空白对照组相比,L-PKO组小鼠血浆IL-2水平显著上升(*P<0.05),阳性对照组和3个剂量WKO组极显著上升(**P<0.01)。
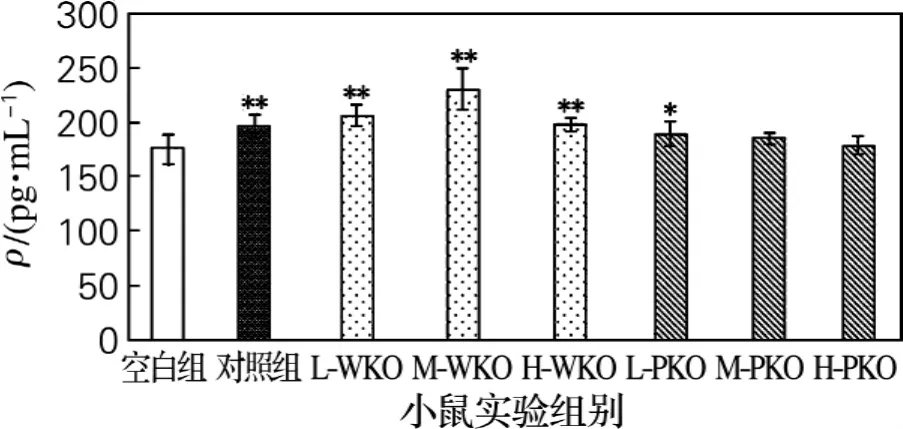
图5 南极磷虾油对小鼠体内IL-2水平的影响Fig.5 Effect of consumption of krill oils on plasma IL-2 level of mice
2.4.2对小鼠血浆IFN-γ水平的影响
图6为南极磷虾油对小鼠细胞因子IFN-γ水平的影响情况,与空白对照组相比,L-WKO组、H-WKO组和M-PKO组小鼠血浆IFN-γ水平极显著上升(**P<0.01)。

图6 南极磷虾油对小鼠体内IFN-γ水平的影响Fig.6 Effect of consumption of krill oils on plasma IFN-γlevel of mice
IL-2和IFN-γ作为反映机体细胞免疫功能的重要细胞因子,其水平上升说明南极磷虾油具有上调细胞免疫功能的能力。研究表明,高含量EPA/DHA甘油三酯型鱼油可提高免疫低下小鼠的细胞免疫功能[6]。
3 结 论
综上所述,南极磷虾油可提高小鼠的脾脏指数、胸腺指数,促进小鼠淋巴细胞增殖能力和腹腔巨噬细胞吞噬能力,并上调小鼠血浆IL-2和 IFN-γ水平,对小鼠免疫功能具有上调作用。
[1]ATKINSONA,SIEGELV,PAKHOMOVEA,etal.Areappraisalofthetotalbiomassandannual productionofAntarctickrill[J].DeepSeaResearch PartI:OceanographicResearchPapers,2009,56(5):727-740.
[2]FRICKEH,GERCKENG,SCHREIBERW,etal.SterolandfattyacidcompositionofAntarctickrill(EuphausiasuperbaDana)[J].Lipids,1984,19(11):821-827.
[3]TANDYS,CHUNGRW,WATE,etal.Dietary krilloilsupplementationreduceshepaticsteatosis,glycemia,andhypercholesterolemiainhigh-fat-fed mouse[J].JournalofAgricultureandFoodChemistry,2009,57(19):9339-9345.
[4]DEUTSCHL.EvaluationoftheeffectofNeptune krilloilonchronicinflammationandarthriticsymptoms[J].JournaloftheAmericanCollegeofNutrition,2007,26(1):39-48.
[5]张明月,李怡岚,郑爱英,等.鱼油对小鼠免疫调节作用的实验研究[J].医学动物防制,2000,16(11):595-597.
[6]贺敏,胡世伟,吴胜强.等.高含量EPA/DHA甘油三酯型鱼油对小鼠的免疫调节作用[J].中国海洋药物,2013,32(4):43-48.
[7]LIDong-mei,ZHOUDa-yong,ZHUBei-wei,etal.Effectsofkrilloilintakeonplasmacholesteroland glucoselevelsinratsfedahigh-cholesteroldiet[J].JournaloftheScienceofFoodandAgriculture,2013,93(11):2669-2675.
[8]SUNLiming,ZHUBeiwei,LIDongmei.Purification andbioactivityofasulphatedpolysaccharideconjugatefromvisceraofabaloneHaliotisdiscushannai Ino[J].FoodandAgriculturalImmunology,2010,21(1):15-26.
[9]LIUChunhui,LINQinxiong,GAOYi,etal.Characterizationandantitumoractivityofapolysaccharide fromStrongylocentrotusnuduseggs[J].CarbohydratePolymers,2007,67(3):313-318.
[10]秦红兵,杨朝晔,刘红旗,等.麋鹿角醇提液对正常小鼠免疫功能的影响[J].中成药,2006,28(12):1812-1813.
[11]张建扬,李明慧,徐连明,等.碱蓬籽油对小鼠血脂及免疫功能的影响[J].职业与健康,2008,15(24):1529-1530.
ImmunomodulatoryeffectsofAntarctic krill(Euphausiasuperba)oilonmouse
ZHOUDayong,WANGJunyan,LIUXiaoyang,LINZhuyi,ZHENGLin,YINFawen,XINQiuyan
(NationalEngineeringResearchCenterofSeafood,DalianPolytechnicUniversity,Dalian116034,China)
Inthisstudy,immunomodulatoryeffectsofAntarctickrill(Euphausiasuperba)oilon mousewerestudied.Low,middleandhigh-doseofwholekrilloil(WKO)andphospholipidstype krilloil(PKO)weregivenbygavageonceaday,respectively.Fourweekslater,theimmuneorgan index,thereproductivecapacityofspleenlymphocytes,thephagocyticfunctionofmacrophageand theplasmalevelsofIL-2andINF-γweretested.Resultsindicatedthatthethymusindexofmicein high-dosePKOgroupwasincreasedsignificantlybycomparedwiththeblankcontrolgroup;the spleenindexofmiceinlowandhigh-doseWKOgroupswereincreasedsignificantly;thereproductive capacityofspleenlymphocytesofmiceinmiddleandhigh-doseWKOgroupsaswellaslowand middle-dosePKOgroupswereenhancedsignificantly;thephagocyticfunctionofmacrophageofmice inlowandhigh-doseWKOgroupsaswellasmiddle-doseofPKOgroupsstrengthenedsignificantly;plasmalevelofIL-2ofmiceinthethree-doseWKOgroupsaswellaslow-dosePKOgroupswere elevatedsignificantly;plasmalevelofINF-γofmiceinlowandhigh-doseWKOgroupsand middle-dosePKOgroupwereelevatedsignificantly.
Antarctickrilloil;mouse;immunomodulation;cytokines
TS254.5
A
1674-1404(2015)02-0097-04
2015-01-09.
国家高技术研究发展计划(863计划)项目(2011AA090801);辽宁省高等学校重大科技平台项目(2011191).
周大勇(1977-),男,教授;通信作者:辛丘岩(1959-),男,高级工程师.
