瘤样炎性脱髓鞘病影像特征及鉴别诊断
2015-09-29李红英
李红英
瘤样炎性脱髓鞘病影像特征及鉴别诊断
李红英*
作者单位:
菏泽市立医院MR室,菏泽 274031
目的 探讨脑内瘤样炎性脱髓鞘病的磁共振成像(magnetic resonance imaging,MRI)表现特征。材料与方法 对8例瘤样炎性脱髓鞘病的MRI影像学表现进行回顾性分析,并总结其MR影像学特点。结果 MRI显示8例局灶性、类似肿块样病灶,片状长T1长T2信号灶。钆喷酸葡甲胺(gadolinium diethylene triamine pentaacetic acid,GD-DTPA)增强病灶不同程度强化。2例表现为完整环形强化,4例不完整环形或开口样增强,2例片状增强。发病早期弥散加权成像(diffusion weighted imaging,DWI) 相呈稍高信号。6例患者经类固醇保守治疗4周后,复查颅脑MR病变缩小,无明显异常强化。2例因术前误诊手术治疗确诊。结论 MRI检查对瘤样炎性脱髓鞘病的诊断有一定的特征性,能监测病变的转归情况。
脱髓鞘疾病;磁共振成像;弥散磁共振成像
瘤样炎性脱髓鞘病(tumor-like inflammatory demyelinating diseases,TIDD) 是中枢神经系统的脱髓鞘病相对少见的类型,确切发病机制及病因尚不明确。临床表现无明显多发性硬化复发-缓解特点。病灶可单发或多发,可表现为病灶周围水肿和轻微占位效应,单发病灶时常常被误诊为脑内肿瘤。影像学表现不典型,目前此病确诊主要依靠病理学检查。近年来,随着磁共振多序列对比技术的发展,使得TIDD检出和诊断的正确性得到了提高,磁共振成像(magnetic resonance imaging,MRI)已成为检测TIDD的最敏感的影像学检查方法,大大减少了此病误诊率和漏诊率。本组研究观察8例瘤样炎性脱髓鞘病患者的MR表现,并结合CT及临床病史加以分析比较,讨论MR影像学表现对TIDD的诊断价值。
1 材料与方法
1.1临床资料
收集我院2010年9月至2014年7月的8例TIDD患者,其中男3例,女5例,年龄16~51岁,平均年龄40.5岁。均为急性和亚急性起病,病程1~5周,临床症状无明显特异性,主要表现为单个或单侧肢体无力或感觉减退、头痛、头晕、恶心、呕吐、语言障碍等,实验室及脑脊液常规检查阴性。
1.2检查方法
采用德国SIEMENS公司MAGNETOM SKYRA 3.0 T磁共振成像仪及颅脑线圈进行扫描,常规轴位T1WI、T2WI、T2-FLAIR、DWI、矢状位T2WI扫描。扫描参数如表1,8例患者按0.1 mmol /kg高压静脉注射钆喷酸葡甲胺(gadolinium diethylene triamine pentaacetic acid,GD-DTPA) 15 ml对比剂行增强扫描。
2 结果
8例TIDD患者中,因术前误诊为胶质瘤而做手术,手术后病理证实TIDD 2例;6例经类固醇激素冲击治疗后4周随访加临床确诊。
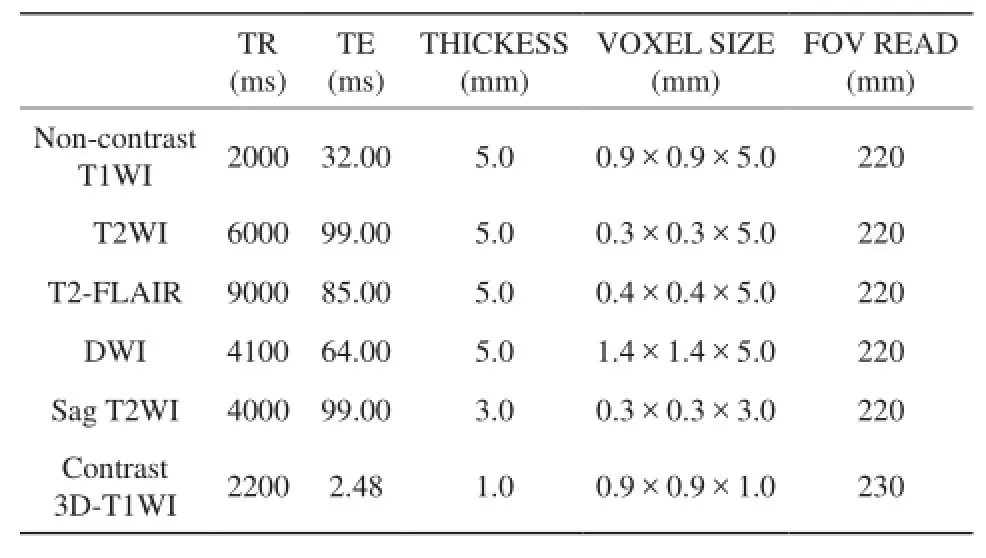
表1 扫描序列及参数Tab. 1 Scan sequences and parameters
病变好发部位:脑干、小脑、脑室周围的大脑白质、视束。同时累及脑干及右侧额叶者1例;同时累及小脑、右侧颞叶、右侧基底节区1例;左侧颞叶单独累及3例;右侧额叶单独累及2例;左侧顶叶单独累及1例。病变形态及边界:表现为肿块样、片样改变,占位效应较轻,边界模糊。
病变区MR信号表现:均呈不均匀长T1长T2信号,弥散加权成像(diffusion weighted imaging,DWI)呈略高信号。GD-DTPA增强扫描:表现为完整环形、不完整开环样或弓状强化、病变内部无强化(图1A~D)。经类固醇激素冲击治疗4周后复查颅脑 MRI,病灶明显变小并且强化幅度明显减低(图1E~H)。
3 讨论
3.1病理特征
TIDD是一种累及中枢神经系统的较为特殊的脱髓鞘疾病,又称为肿胀性脱髓鞘病、脱髓鞘假瘤、瘤块样脱髓鞘病,是指病变直径≥2 cm的脑内脱髓鞘病变[1]。病理改变特点是血管周围炎性细胞(浆细胞、淋巴细胞、巨噬细胞)套袖样浸润,多核星形细胞和反应性单核细胞增生,伴随局部的脱髓鞘改变。髓鞘局部脱失,而轴索相对保留完整。该病由Vander Velden在1979 年首先报道,将其归类为急性播散性脑脊髓炎和多发性硬化之间的中间类型。多发性硬化是一种中枢神经系统的最常见的脱髓鞘病变,包括病理变化是髓鞘破坏与再生,轴索损伤,可见胶质增生、水肿和淋巴细胞浸润[2-3]。瘤样炎性脱髓鞘病临床特点:以急性或者亚急性起病,发病高峰为20~50岁,对激素治疗敏感。
3.2TIDD的MRI信号特点
TIDD病变好发部位:脑干、小脑、脑室周围的大脑白质、视束。大脑半球多发生于脑白质内或灰白质交界区,灰质受累较轻。表现为肿块样、不规则片样长T1长T2信号,其内信号不均匀,边缘显示欠清,水肿占位效应较轻。DWI序列显示,病程小于1个月病灶可见轻、中度高信号,病程大于1个月病灶DWI信号明显减低[4-5]。在T1WI像显示病变中心见更低信号灶,周围略低信号,与病理相对应,是病灶不同时相的水肿、坏死区,与一般脱髓鞘的病理过程明显不同。GDDTPA增强扫描显示为开环形强化,完整环形强化。开环形强化,多发性硬化只有9%的表现,位于白质侧的环的强化部分,往往代表脱髓鞘病变的边界,并且中心未见强化的区域代表一个慢性炎症,认为其强化幅度与邻近累及白质内的血脑屏障的损坏程度及巨噬细胞浸润程度密切相关。笔者认为完整环、开环样、病变内部未见强化,均与急性期、亚急性期病理过程中炎性细胞浸润程度及多少有关。开环缺口区位于白质侧,笔者推测与病灶灰质侧边缘的血供情况相关,即灰质侧白质区的毛细血管细小并比较丰富,其血管通透性增高和血脑屏障破坏较白质侧明显;开环缺口区位于基底核团侧或者灰质侧,环的强化部分代表脱髓鞘的边界。急性起病患者增强扫描多表现为弥漫性斑片或者结节状强化,有学者报道本病强化病灶有垂直于侧脑室体部分布的线样征,这与多发性硬化的“直角脱髓鞘征”机制相似[6-7]。但研究病例较少,需大样本病例量进一步探索并取得病理学依据。文献资料显示,平面回波成像(echo planar imaging,EPI)灌注技术发现病变区多条扩张的静脉血管,可能为脱髓鞘炎症的刺激导致了深部静脉的扩张和充血。磁共振波谱成像(MR Spectroscopy,MRS)显示TIDD在病程早期NAA峰可正常和一过性小幅度降低,病灶中心NAA/Cr的比值降低不明显。
3.3TIDD的鉴别诊断
TIDD皆因MRI和CT的占位效应而误认为肿瘤,因此手术、γ-刀、放射治疗等给病人带来了不可逆向的损伤。TIDD术前应该尽量做出明确诊断,避免过度治疗,既能减少病人精神、身体的创伤,又能减少给病人带来不必要的经济负担。
单发的TIDD需要与脑内胶质瘤、单发转移瘤和脑脓肿以及淋巴瘤等疾病相鉴别。与胶质瘤相鉴别:TIDD的平扫,水肿范围大,但占位效应较轻。增强显示,病灶内没有不成熟的肿瘤血管显示,病灶环样、半环形强化。缺口区常常位于白质侧。随着病程的延长强化越来越不显著。脑胶质瘤单发病灶也常位于脑白质内,周围有指压状水肿,占位效应较重,信号欠均;GD-DTPA增强显示病灶内有不成熟的肿瘤血管显示,病变明显团块状、花环样强化,绝大多数病例呈环状。随着病程的延长强化、水肿、占位效应越来越显著,内外壁结节状突起,不光滑;同时胶质瘤常常可侵犯胼胝体,胼胝体局部显增厚,如累及对侧脑白质则呈“蝴蝶”征,短期复查病灶,变化较快的患者有助于TIDD的诊断[8-9]。李咏梅等采用灌注技术对TIDD的研究显示,TIDD相对脑血容量较肿瘤明显减少,相对血流容量明显低,相对平均通过时间较恶性肿瘤短,二者具有统计学意义。浸润性胶质瘤NAA峰明显降低,且病灶中心NAA/Cs的比值较TIDD明显降低。
颅内多发TIDD应与多发性硬化、颅内多发性转移瘤、急性播散性脑脊髓炎及生殖细胞瘤相鉴别。直角脱髓鞘征是多发性硬化特有的征象。病理学家将这种围绕静脉周围改变的脱髓鞘成为“dawson,s fingers”征,病变垂直于侧脑室分布。急性播散性脑脊髓炎病变,脊髓病变节段范围较广,病程较重[10-11];多发性脑转移瘤数目较多,常常位于灰白质交界范围内,占位效应重,水肿明显,增强扫描显示不规则结节样、小环形强化,而TIDD病灶位于脑白质内。生殖细胞瘤患者结合CT平扫可见到高密度表现,如果CT上见到高密度影可以排除TIDD[12-13]。若不除外为TIDD,用激素类药物冲击治疗后复查颅脑MRI,证实病灶变小再结合临床病史就能明确诊断。
4 小结
总之,TIDD虽与脑内肿瘤相似,但结合临床及MR影像特征,即环样、开环样强化、病灶区扩张的静脉及MRS中NAA峰正常或者略显降低、病灶中心NAA/Cr比值降低不明显等特征,尽可能做出正确诊断。如果分析影像资料怀疑TIDD,应该给予激素实验其疗效,以免因误诊给病人带来不必要的损失。
[References]
[1] Li Y, Li YM. Advances in imaging studies of tumor like lesions of the disease. Chin J Magn Reson Imaging, 2015, 6(3): 225-229.
李瑛, 李咏梅. 瘤样脱髓鞘病变的影像学研究进展.磁共振成像, 2015, 6(3): 225-229.
[2] Liu HJ, Li H, Liang Y, et al. Brain multiple sclerosis: a few MRI signs of review and its significance. Chin J Magn Reson Imaging, 2011, 2(4): 260-263.
刘怀军, 李晖, 梁莹, 等. 脑多发性硬化几个MRI征象的再复习及其意义. 磁共振成像, 2011, 2(4): 260-263.
[3] Nie TT, Shen ZW, Geng K, et al. T2WI and DTI of the C57BL/6 mouse model of Cuprizone induced. Chin J Magn Reson Imaging, 2014, 5(6): 467-472.
聂婷婷, 沈智威, 耿宽, 等. Cuprizone诱导的C57BL/6小鼠脱髓鞘模型的T2WI及DTI研究. 磁共振成像, 2014, 5(6): 467-472.
[4] Tanaka K, Tanaka M, Brain Nerve. Differential diagnosis of neuromyelitis optica spectrum disorders. Brain and nerve, 2010, 62(9): 953-960.
[5] Matsuoka T, Matsushita T, Kawano Y, et al. Heterogeneity of aquaporin-4 autoimmunity and spinal cord lesions in multiple sclerosis in Japanese. Brain, 2007, 130(5): 1206-1223.
[6] Jarius S, Franciotta D, Bergamaschi R. Immunoglobulin M antibodies to aquaporin-4 in neuromyelitis optica and related disorders. Clin Chem Lab Med, 2010, 48(5): 659-663.
[7] Levin MH, Bennett JL, Verkman AS. Optic neuritis in neuromyelitis optica. Prog Retin Eye Res, 2013, 36(2):159-171.
[8] Kang ES, Min JH, Lee KH, et al. Clinical usefulness of cell-based indirect immunofluorescence assay for the detection of aquaporin-4 antibodies in neuromyelitis optica spectrum disorder. Ann Lab Med, 2012, 32(5): 331-338.
[9] Jarius S, Wildemann B. Aquaporin-4 antibodies (NMO-IgG) as a serological marker of neuromyelitis optica: a critical review of the literature. Brain Pathol, 2013, 23(6): 661-683.
[10] Yoshimura S, Isobe N, Matsushita T. Distinct genetic and infectious profiles in Japanese neuromyelitis optica patients according to antiaquaporin 4 antibody status. J Neurol Neurosurg Psychiatry, 2013, 84(1): 29-34.
[11] Yang CS, Zhang DQ, Wang JH. Clinical features and sera antiaquaporin 4 antibody positivity in patients with demyelinating disorders of the central nervous system from Tianjin. CNS Neurosci Ther, 2014, 20(1): 32-39.
[12] Misu T, Fujihara K, Itoyama Y. Neuromyelitis optica and antiaquaporin 4 antibody-an overview. Brain Nerve, 2008, 60(5): 527-537.
[13] Lana-Peixoto MA, Callegaro D. The expanded spectrum of neuromyelitis optica: evidences for a new definition. Arq Neuropsiquiatr, 2012, 70(10): 807-813.
MRI features of tumor like inflammatory demyelinating disease
LI Hong-ying*
Department of MR, Heze Municiple Hospital, Heze 274031, China
*Correspondence to: Li HY, E-mail: lhying666@163.com
5 Oct 2015, Accepted 10 Nov 2015
Objective: To investigate the MRI features of the tumor like inflammatory disease in the brain. Materials and Methods: The MR imaging performances of tumor like inflammatory demyelinating disease in eight eases were retrospectively analyzed and their imaging features were summarized. Results: MRI showed localized mass lesions, and showed long T1, T2 signal lesions in eight cases. Enhancement scanning displayed varying degrees of enhancement, 2 cases showed complete ringlike enhancement, 4 cases showed incomplete opening of the ring-like enhancement,and 2 cases showed patchy enhancement; DWI phase was slightly high in early stage. 6 patients were treated with hormone conservative treatment for 4 weeks, the review of the lesions were reduced and did not have any obvious enhancement. 2 cases were surgical treated by preoperative misdiagnosis. Conclusion: MRI examination of the tumor like inflammatory disease of the diagnosis has a certain characteristic, and MRI can monitor outcomes of lesions.
Demyelinating diseases; Magnetic resonance imaging; Diffusion magnetic resonance imaging
李红英,E-mail:lhying666@163.com
2015-10-05
R445.2;R744.5
A
10.3969/j.issn.1674-8034.2015.12.011
接受日期:2015-11-10
李红英. 瘤样炎性脱髓鞘病影像特征及鉴别诊断. 磁共振成像, 2015, 6(12): 937-940.
