原发性三叉神经痛灰质体积变化的磁共振形态学研究
2015-09-29郭林英朱文珍田甜杨时骐覃媛媛汤翔宇王剑张巨
郭林英,朱文珍,田甜,杨时骐,覃媛媛,汤翔宇,王剑,张巨
原发性三叉神经痛灰质体积变化的磁共振形态学研究
郭林英,朱文珍*,田甜,杨时骐,覃媛媛,汤翔宇,王剑,张巨
目的 应用基于体素的形态学分析方法检测原发性三叉神经痛患者是否存在灰质体积改变,探索中枢神经系统在其疼痛处理中的作用。材料与方法 对19例右侧三叉神经痛患者和22例年龄性别匹配的正常对照进行磁共振三维T1结构像扫描(3D-T1BRAVO),应用基于体素形态学分析(voxel-based morphometry,VBM)检测三叉神经痛患者全脑灰质体积的变化,探索各变化的中枢神经系统脑区在疼痛处理中的作用,并分别分析其体积变化与疼痛程度及病程的相关性。结果 与正常对照组相比,病例组左侧前扣带回灰质体积明显减少;右侧额上回、右侧岛叶、右侧壳核、双侧小脑前叶灰质体积明显增加,左侧前扣带回体积变化与疼痛病程呈负相关性。结论 三叉神经痛患者存在中枢神经系统灰质体积变化,左侧前扣带回体积与疼痛病程呈负相关性,这些存在差异的中枢神经系统脑区在三叉神经痛患者疼痛的形成及慢性状态的维持中可能有重要作用,提示探索三叉神经痛的中枢处理机制有益于新的治疗方法的研发。
三叉神经痛;中枢神经系统;磁共振成像;基于体素形态学分析
三叉神经痛是指发生在面部三叉神经感觉支分布区域内电击样、刀割样、针刺样、撕裂样、烧灼样疼痛,疼痛持续数秒钟或更久,面颊、唇部及牙龈等部位触发点的刺激或是面部表情肌的运动、咀嚼动作等可诱发疼痛。从神经生物学的观点来看,疼痛的机制具有异质性,可发生在外周及中枢神经系统的不同水平。磁共振3D-TOF联合3D-FIESTA显示三叉神经痛患者神经根部可存在血管压迫征象[1],而外科手术也可发现责任血管,血管减压术使部分患者疼痛得以缓解的事实进一步支持外周机制。但必须承认,不少的一部分三叉神经痛患者未见到责任血管,并且三叉神经痛微血管减压术并非对所有患者有效,术后疼痛复发的患者不在少数。因此,三叉神经痛疼痛的产生及维持不能仅仅用外周机制即责任血管的压迫来解释,因此探索中枢神经系统在其疼痛处理过程中的参与甚至主导作用至关重要。
1 材料与方法
1.1研究对象
收集华中科技大学同济医学院附属同济医院自2014年5月至2015年1月临床诊断为右侧三叉神经痛的患者19例(其中男性7例,平均年龄55.00岁;女性12例,平均年龄50.41岁)作为病例组,其病程在2周至10年间,见表1;年龄、性别匹配的正常志愿者22例(其中男性7例,平均年龄53.86岁;女性15例,平均年龄51.93岁)作为对照组。检查前所有研究对象均签署知情同意书。病例组纳入标准:(1)临床诊断为三叉神经痛;(2)右侧三叉神经感觉支分布区典型的三叉神经痛症状;(3)所有研究对象均为右利手;(4)MRI排除桥小脑角区占位、多发性硬化等导致的继发性三叉神经痛;(5)MRI检查前均未进行神经血管减压术;(6)临床体征提示无感觉迟钝或过敏。
1.2临床资料
采用0~10分的口述评分法(verbal rating scale,VRS)(0分为无痛,10分为难以忍受的疼痛)记录患者对自身疼痛程度的评分,并记录其疼痛的时间跨度即病程,见表1。
1.3MRI检查
所有病例及对照的扫描均在GE公司3.0 TeslaMR750上进行。采用32通道头线圈。扫描序列为3DBRAVO-T1加权成像,其参数设置如下:TR=8.2 ms,TE=3.2 ms,TI 反转角12。,视野大小=256 mm,166层,体素大小1 mm×1 mm× 1 mm。
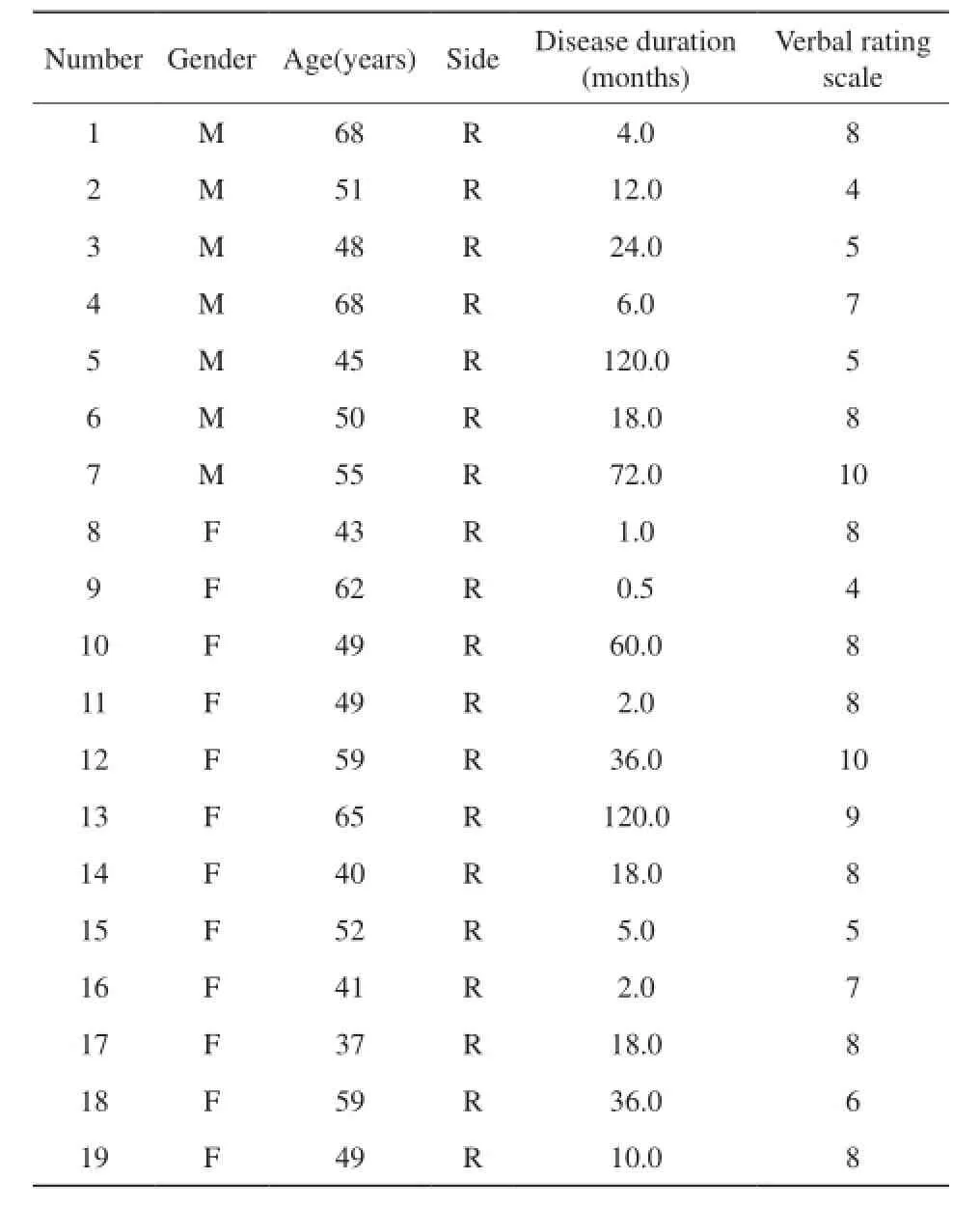
表1 所有患者基本信息、病程及疼痛程度Tab. 1 Demographics disease duration and disease intensity
1.4数据处理
所有数据的预处理均运用统计参数图(SPM8, Wellcome Department of Imaging Neuroscience, London, UK, http://www.fil.ion.ucl.ac.uk/spm)软件包以及它的插件包VBM8来完成。
1.4.1组织分割
按照一定的先验模板从全脑的结构像分别提取出灰质、白质和脑脊液3种组织成分的过程,其中某个成分图(比如灰质)的每个体素的值代表该体素为该成分(灰质)的概率,也称为灰质浓度。该步骤采用SPM8的segment算法实现。
1.4.2空间标准化
把所研究个体的脑结构磁共振图像配准到一个相同的立体空间,标准化数据的每个点理论上对应相同的脑结构。本研究的标准空间为MNI空间。采用VBM8中植入的DARTEL高阶配准方法实现。具体为:(1)分割得到的灰质概率图(灰质浓度图)先仿射变换到MNI空间的SPM默认灰质模板;(2)然后采用VBM8中的DARTEL模板,把仿射变换后的灰质浓度图进行非线性高阶配准(6 阶),得到标准空间的灰质浓度图;(3)把标准化的灰质浓度图转化成灰质体积图,具体方法是用灰质浓度图乘以标准化过程得到变形场参数(Jacobian determinant,雅克比横列式)。如果灰质浓度乘以全部行列式参数(仿射非线性成分)称之为绝对灰质体积。如果灰质浓度只乘以行列式的非线性成分,称之为相对灰质体积,也就是校正了个体脑体积的灰质体积。本研究使用相对灰质体积进行随后的分析;(4)对标准化的图像进行重采样,得到1.5 mm×1.5 mm×1.5 mm的相对灰质体积图。
1.4.3平滑
利用三维高斯核和图像进行离散卷积运算,高斯核选为各向同性的,即3个方向上的平滑度一样。高斯卷积核的定义用半高全宽(full width at half maximum,FWHM)表示,即高斯函数高度的最大值下降为1/2时所对应的横坐标轴的宽度。笔者使用8 mm×8 mm×8 mm 的FWHM高斯核对结构图像进行空间平滑。
1.5统计分析
运用SPM8软件进行双样本t检验。通过分析全脑灰质体积的组间差异,统计阈值设定为P <0.001(体素水平)。将存在组间差异的脑区提取出来,并观察有统计学意义的团块的大小、所在脑区及其坐标(MNI坐标),并记录相关区的信息及相关强度。考虑到年龄、性别可能会影响分析结果,在进行双样本t检验时,将年龄性别作为协变量予以控制。以双样本t检验后差异脑区为感兴趣区(region of interest,ROI),采用Pearson相关分析方法对疼痛评分分数与灰质体积变化、疾病病程与灰质体积变化进行相关性分析。
2 结果
2.1VBM结果
与正常对照组相比,三叉神经痛患者左侧前扣带回体积减小,见图1A;右侧额上回、右侧岛叶、右侧壳核、双侧小脑前叶体积增加,见图1B~F。
2.2相关性分析结果
左侧前扣带回体积变化与疼痛病程呈负相关,Pearson相关系数r=-0.582,P=0.014,见图2。余左侧小脑前叶(r=-0.086,P=0.726)、右侧小脑前叶(r=-0.105,P=0.668)、右侧额上回(r=-0.382,P=0.106)、右侧岛叶(r=0109,P=0.658)、右侧壳核(r=0.045,P=0.085)与疼痛病程无相关性。各ROI灰质体积变化与VRS评分无相关性,具体如下:左侧前扣带回r=-0.383,P=0.106;左侧小脑前叶r=0.095,P=0.700;右侧小脑前叶r=0.058,P=0.812;右侧额上回r=-0.032,P=0.895;右侧岛叶r=-0.152,P=0.534;右侧壳核r=-0.315,P=0.189。
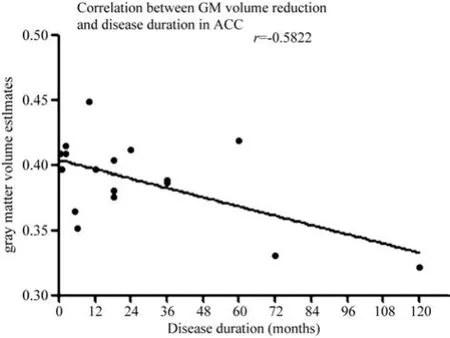
图2 三叉神经痛患者左侧前扣带回体积减少与病程呈负相关性(P=0.014),即病程越长,灰质体积越小Fig. 2 There is a negative correlation(P=0.014)between gray matter volume reduction of left ACC and disease duration. As disease duration extends, gray matter volume decreases.
3 讨论
VBM是一种基于体素对脑结构磁共振成像自动、全面、客观的分析技术,可以在活体脑进行精确的形态学研究,VBM通过分析脑磁共振结构像中每个体素的灰、白质体积的变化来反映相应解剖结构的差异,是评价脑部灰、白质病变的一种较好的方法,可用于脑部的形态学研究[2]。
通过VBM笔者证实了三叉神经痛患者脑区存在灰质体积改变。灰质体积减小的脑区为左侧前扣带回,灰质体积增加的脑区包括右侧前额叶、右侧岛叶、右侧壳核、双侧小脑前叶等;灰质体积变化与疼痛程度及病程的相关性分析显示,左侧前扣带回体积变化与三叉神经痛疼痛病程呈负相关。
3.1中枢神经系统疼痛网络
疼痛是与实存在或潜在的组织损伤或可用这类损伤描述的事件相关的一种不愉快的感觉和情绪体验[3]。作为一种多维度的复合感觉,早期对其研究主要在感觉、情绪及评价方面[4],而近年研究则集中在感觉的辨别(强度、位置、方式)[5]、认知(注意、预期、重新评价)[6]及情绪反应等。
疼痛网络是参与疼痛多维度成分处理的特殊的、广泛分散式的脑神经网络[3,7]。该网络中机体可由两个系统对伤害性刺激进行处理:外部疼痛系统和内部疼痛系统。前者通过丘脑外侧核传入后部躯体感觉皮质区,参与疼痛的感觉识别方面,后者通过丘脑内侧核传入前部扣带回、额叶及岛叶皮质区,参与疼痛的情感动机评估方面[8]。中枢神经系统对疼痛的下行调节有双向作用,即双向中央控制。该下行调节系统一方面可抑制疼痛传入,减轻疼痛,另一方面也会易化疼痛传入,促成外周伤害发生后痛觉高敏状态的维持[9]。
3.2原发性三叉神经痛患者脑内灰质体积的萎缩
笔者研究发现三叉神经痛患者左侧前扣带回体积减少。前扣带回脑区可以促成疼痛不愉快,增加疼痛的显著性,并参与疼痛负面情绪的调节[10],主要针对疼痛处理网络中的注意调节方面,是慢性疼痛进展的最重要脑区[11]。本研究还发现左侧前扣带回灰质体积变化与疼痛病程呈负相关,随病程的延长,左侧前扣带回体积减小的程度越来越明显。前扣带回的萎缩可能揭示了三叉神经痛患者疼痛情感调控能力走向衰弱。
3.3原发性三叉神经痛患脑内灰质体积的重塑
三叉神经痛患者右侧前额叶、右侧岛叶、右侧壳核、双侧小脑前叶体积增加。前额叶有可能与疼痛预期减轻的产生、维持及整合有关[9],通过疼痛认知调节的下行注意控制方面来发挥对于疼痛处理的作用[6]。它还参与疼痛的情绪调节,并在启动镇痛活动中发挥作用[9],岛叶与疼痛的认知、情绪、记忆方面有关[12]。此外,疼痛线索对疼痛有预示作用,个体对疼痛刺激的预期,依赖于自身对这种预示的可靠性的评估[13],这一过程主要由岛叶调节[14]。作为外部疼痛系统中伤害性刺激接收的重要部位,岛叶和前额叶在三叉神经痛情感调控中扮演重要角色,其灰质体积的变化可视为慢性疼痛的一种普遍的信号。
除了感觉识别及情感动机成分,疼痛还有第3种成分,即运动成分,它在疼痛的反映中很重要[15],运动相关脑区如小脑体积的变化可能与疼痛伴发症状,比如运动或急性疼痛本身引起的运动的抑制有关[12]。壳核体积的变化可能反映了伴有疼痛感知减弱的运动相关性逃离的欲望减低[16]。鉴于三叉神经痛患者会限制咀嚼等诱发疼痛的活动,其小脑及壳核体积的变化可能反映其对疼痛运动成分的处理。
Woolf 和Salter 提出了疼痛慢性化过程中的神经可塑性[17],外周及中枢敏感性的增高引起伤害性刺激向大脑传入的增加,可能会导致皮层适应不良性重塑[18]。一项关于原发性髋关节炎引发疼痛的研究显示在全髋关节置换术疼痛完全缓解后,脑灰质体积变化可获得恢复[19]。Obermann认为三叉神经痛患者VBM所得灰质结构的变化可能反映了中枢高敏感性,代表了大脑皮层神经元的可塑性适应[11]。本研究发现三叉神经痛患者脑灰质体积的增加可能反映了慢性疼痛所致中枢神经系统皮层适应性重塑,然而,关于脑灰质体积的增加是否是三叉神经痛的伴发结果还有待进一步研究。
本研究证实了中枢神经系统参与三叉神经痛的形成及慢性状态的维持,启示三叉神经痛的治疗仅仅着眼于外周神经本身是远远不够的,有必要基于疼痛网络,深入研究机体对疼痛的中枢处理机制,研发对外周和中枢均有效的治疗方式。在对本研究对象的追踪调查中,笔者发现19例患者中有3例患者在完成MRI扫描后进行了血管减压术,其中1例在术中发现椎动脉压迫征象,另外2例发现无名小血管压迫三叉神经,未来笔者将继续追踪所有患者的手术情况并随访观察手术对脑区灰质体积变化的影响,以进一步明确三叉神经痛患者机体对疼痛的中枢处理机制。本研究仍存在不足,如患者疼痛病程时间跨度较大,可能会影响灰质体积变化及其与病程和VRS的相关性分析,未来研究需要依据病程长短进一步分组,深入研究三叉神经痛患者急性与慢性中枢机制的不同。
[References]
[1] Jin J, Tang XL, Xiang H, et al. Evaluation of 3D-TOF and 3D-FIESTA combined with MPR in microvascular decompression for trigeminal neuralgia by 3.0 T MRI system. Chin J Magn Reson Imaging, 2015, 6(4): 277-282.
金军, 汤小俐, 香辉, 等. 3.0 T MRI 3D-TOF序列联合3D-FIESTA 序列结合多平面重建在三叉神经微血管减压术术前评估中的应用价值. 磁共振成像, 2015, 6(4): 277-282.
[2] Liu CX, Bao HH, Li WX, et al. Voxel-based morphometry MRI study of gray matter's alteration in patients with chronic mountain sickness. Chin J Magn Reson Imaging, 2014, 5(3): 211-215.
刘彩霞, 鲍海华, 李伟霞, 等. 慢性高原病患者脑灰质变化的VBMMRI研究. 磁共振成像, 2014, 5(3): 211-215.
[3] Tracey I, Mantyh PW. The cerebral signature for pain perception and its modulation. Neuron, 2007, 55(3): 377-391.
[4] Melzack R. The McGill Pain Questionnaire: major properties and scoring methods. Pain, 1975, 1(3): 277-299.
[5] Xie WQ, Li WY. Research advances of brain functional imaging in neuropathic pain. Medical Recapitulate, 2012, 18(8): 1232-1235.
谢文强, 李伟彦. 神经病理性疼痛的脑功能成像研究进展. 医学综述, 2012, 18(8): 1232-1235.
[6] Wiech K, Ploner M, Tracey I. Neurocognitive aspects of pain perception. Trends Cogn Sci, 2008, 12(8): 306-313.
[7] May A. A review of diagnostic and functional imaging in headache. J Headache Pain, 2006, 7(4): 174-184.
[8] Lev R, Granovsky Y, Yarnitsky D. Orbitofrontal disinhibition of pain in migraine with aura: an interictal EEG-mapping study. Cephalalgia, 2010, 30(8): 910-918.
[9] Bingel U, Tracey I. Imaging CNS modulation of pain in humans. Physiology (Bethesda), 2008, 23(6): 371-380.
[10] Desouza DD, Moayedi M, Chen DQ, et al. Sensorimotor and pain modulation brain abnormalities in trigeminal neuralgia: a paroxysmal, sensory-triggered neuropathic pain. PLoS One, 2013, 8(6): e66340.
[11] Obermann M, Rodriguez-Raecke R, Naegel S, et al. Gray matter volume reduction reflects chronic pain in trigeminal neuralgia. Neuroimage, 2013, 74(10): 352-358.
[12] Vania AA, Catherine BM, Rolf-Detlef T, et al. Human brain mechanisms of pain perception and regulation in health and disease. Eur J Pain, 2005, 9(4): 463-484.
[13] Brown CA, Seymour B, El-Deredy W, et al. Confidence in beliefs about pain predicts expectancy effects on pain perception and anticipatory processing in right anterior insula. Pain, 2008, 139(2): 324-332.
[14] Wiech K, Tracey I. The influence of negative emotions on pain: behavioral effects and neural mechanisms. Neuroimage, 2009, 47(3): 987-994.
[15] Davis KD, Moayedi M. Central mechanisms of pain revealed through functional and structural MRI. J Neuroimmune Pharmacol, 2013, 8(3): 518-534.
[16] Bingel U, Schoell E, Herken W, et al. Habituation to painful stimulation involves the antinociceptive system. Pain, 2007, 131(1-2): 21-30.
[17] Woolf CJ, Salter MW. Neuronal plasticity: increasing the gain in pain. Science, 2000, 288(5472): 1765-1769.
[18] Seifert F, Maihofner C. Functional and structural imaging of paininduced neuroplasticity. Curr Opin Anaesthesiol, 2011, 24(5): 515-523.
[19] Rodriguez-Raecke R, Niemeier A, Ihle K, et al. Brain gray matter decrease in chronic pain is the consequence and not the cause of pain. J Neurosci, 2009, 29(44): 13746-13750.
Altered gray matter volume in primary trigeminal neuralgia: a voxel based morphometry MRI study
GUO Lin-ying, ZHU Wen-zhen*, TIAN Tian, YANG Shi-qi, QIN Yuan-yuan, TANG Xiang-yu, WANG Jian, ZHANG Ju
Department of Radiology, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
*Correspondence to: Zhu WZ, E-mail: zhuwenzhen@hotmail.com
8 Oct 2015, Accepted 9 Nov 2015
Objective: To detect whether there is gray matter volume (GMV) alteration and further analyze the involvement of central nervous system in pain processing in trigeminal neuralgia patients. Materials and Methods: Nineteen patients diagnosed with trigeminal neuralgia and twenty-two age-matched, sex-matched normal volunteers as controls were recruited. T1-weighted 3D BRAVO sagittal images were obtained from all subjects. Voxel based morphometry(VBM) was used to identify GMV differences between patients and normal controls. The correlation between altered GMVs and disease duration as well as altered GMVs and pain intensity were also analyzed in trigeminal neuralgia patients. Results: Compared with normal controls, patients with trigeminal neuralgia had decreased GMV in left anterior cingulate as well as increased GMVs in right superior frontal gyrus, right insula, right putamen and bilateral cerebellum. Otherwise, we found a negative correlation between pain duration and altered GMV of the left anterior cingulate which is an important region for the development and maintenance of pain in trigeminal neuralgia. Conclusion: The altered GMV in central nervous system and the negative correlation between disease duration and altered GMV of the anterior cingulate may suggest that these central brain regions are extremely important for the development and maintenance of pain in trigeminal neuralgia, which reveals that exploring the central mechanisms of pain processing in trigeminal neuralgia may benefit new therapeutic methods in the future.
Trigeminal neuralgia; Central nervous system; Magnetic resonance imaging; Voxel based morphometry
国家“十二五”科技支撑计划项目(编号:2011BAI08B10);国家自然科学基金项目(编号:81171308、81401389)
华中科技大学同济医学院附属同济医院放射科, 武汉 430030
朱文珍,E-mail:zhuwenzhen@ hotmail.com
2015-10-08
R445.2;R745.1
A
10.3969/j.issn.1674-8034.2015.12.002
接受日期:2015-11-09
郭林英, 朱文珍, 田甜, 等. 原发性三叉神经痛灰质体积变化的磁共振形态学研究. 磁共振成像, 2015, 6(12): 888-892.
ACKNOWLEDGMENTS This work was part of National Program of the Ministry of Science and Technology of China during the “12th Five-Year Plan” (No. 2011BAI08B10) and National Natural Science Foundation of China (No. 81171308, 81401389).
