拟南芥抗旱相关基因的表达载体构建及转基因植株鉴定
2015-09-28顾进宝阳立波曹树青
顾进宝, 阳立波, 曹树青
(合肥工业大学 生物与食品工程学院,安徽 合肥 230009)
随着地球生态环境的日益恶化,植物要面对多种胁迫条件,因此研究植物抗逆机制以帮助植物度过难关十分必要。拟南芥对干旱胁迫的耐受主要通过减少蒸腾、节约用水、增加水分来源3条途径[1]。拟南芥可通过调节气孔开闭来减少蒸腾失水,也可通过减缓植物生长发育过程,体现为植物生长较小,且会较快进入生殖生长,干旱环境还能促进植物根系向四周生长以吸收更多水[1]。拟南芥调节干旱耐受的分子机制主要通过甲基化(去甲基化)修饰、植物激素(ABA、IAA等)相关代谢途径[2]、相关转录因子家族(DREB、MYB/MYC、NAC等[3-6])、蛋白激酶[7]和某些共激活因子[8]的表达等进行调节,且各调节机制不一定能相互叠加以增强干旱耐受或敏感的效应[9],而是在一个有机整体内通过很多代谢途径共同调控完成[10]。本实验室在前期工作中筛选得到一个具有干旱耐受表型的突变体lwt2-1,通过对该突变体的研究,揭示植物在干旱胁迫耐受过程中某些未知的调控机制。本文通过构建该突变体的互补材料和相应基因的过表达材料,为该突变体的深入研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料
拟南芥(Arabidopsis thaliana)哥伦比亚野生型(Col-0),购于美国拟南芥种质资源中心,由本实验室繁衍保存。
1.1.2 主要试剂
TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒、pEASY-blunt ZERO Cloning Kit购于北京全式金公司,总RNA抽提试剂盒、Taq PCR Master-Mix百泰克、限制性内切酶BamHⅠ、SacⅠ和EcoRⅠ、高保真酶Phusion、T4DNA连接酶购于NEB公司。
1.1.3 宿主菌和载体
平末端载体pEASY-blunt ZERO Cloning Kit和感受态细胞Trans1-T1Chemically Competent Cell(购自全式金公司)。互补载体pCAMBIA 1301,过表达载体pCAMBIA 130135SN。
1.2 方法
1.2.1 拟南芥植株培养
将种子用5%次氯酸钠浸洗7min,用无菌水洗5次以除去残留次氯酸钠液,然后将种子点于1/2MS固体培养基上,于4℃春化3d,最后置于正常培养条件下(光强度为100μmol/(m2·s)、光周期为16/8h、培养温度为23℃)培养14d后移栽至小盆中。
1.2.2 拟南芥LWT2基因克隆
植物总RNA抽提试剂盒抽提组织中总RNA,详细方法见说明书。
以总RNA为模板,用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix反转录试剂盒合成cDNA。植物基因组DNA用CTAB法提取。
根据TAIR中提供的基因gDNA和cDNA序列,利用Primer Premier 5.0软件设计引物,并正向和反向引物的5′端加上所需的酶切位点和相应保护碱基。过表达载体选用BamHⅠ、SacⅠ,互补载体选用BamHⅠ、EcoRⅠ。
分别以gDNA和cDNA为模板,用Pusion高保真扩增酶进行PCR扩增,反应条件如下:95℃预变性5min,95℃变性30s,55℃退火30s,72℃延伸80s,共30个循环,72℃延伸5min,4℃保存。聚合酶链式反应(polymerase chain reaction,PCR)产物用1%琼脂糖凝胶进行电泳检测,并回收纯化目的条带。
将回收纯化的相应片段与pEASY-blunt ZERO Cloning Kit平末端载体连接[11],转入Trans1-T1感受态细胞中,用含有50μg/mL卡那霉素的LB固体培养基筛选阳性克隆。挑取单菌落,进行菌落PCR验证,并选取正确克隆接种于50μg/mL卡那霉素的LB液体培养基37℃培养16h。用百泰克质粒小抽提取质粒并测序。测序正确的质粒用限制性内切酶切下目的条带后用胶回收方法纯化后分别连接至pCAMBIA 1301和pCAMBIA 130135SN。
1.2.3 互补和过表达载体的构建
测序正确的质粒用对应的酶切下目的条带后用胶回收方法纯化。回收片段连接至相应载体,转入Trans T1菌株中,用含有50μg/mL卡那霉素的LB固体培养基筛选阳性克隆,挑取单菌落,进行菌落PCR验证,并选取正确克隆接种于50μg/mL卡那霉素的LB液体培养基37℃培养16h。用百泰克质粒小抽提取质粒并测序。选择正确质粒转化GV3101农杆菌菌株,用含有50μg/mL卡那霉素和50μg/mL利福平的LB固体培养基筛选阳性克隆。挑取单菌落,进行菌落PCR验证,并选取正确克隆接种于50μg/mL卡那霉素和50μg/mL利福平的LB液体培养基28℃培养至OD值为1.6左右,再用浸花法转化拟南芥[12]。
1.2.4 阳性苗及单插入筛选
将转化的拟南芥种子撒到含有30μg/mL潮霉素的1/2MS板上纯化3d后正常培养14d,长出真叶和根的作为T1植株进行移栽。
将筛选的阳性苗种下后收到种子T2,再用潮霉素筛选鉴定分离比,选取潮霉素耐受(HygR)比对潮霉素敏感(HygS)的个数比为3∶1的T2进行后续试验。
2 结果与分析
2.1 PCR扩增拟南芥LWT2基因
提取拟南芥基因组DNA(gDNA)和RNA,RNA用RT Kit反转录成cDNA,分别以gDNA和cDNA为模板扩增LWT2基因片段。电泳结果与目的片段大小一致。LWT2基因全长如图1a所示,长度为2556bp。LWT2CDS全长如图1b所示,长度为459bp。
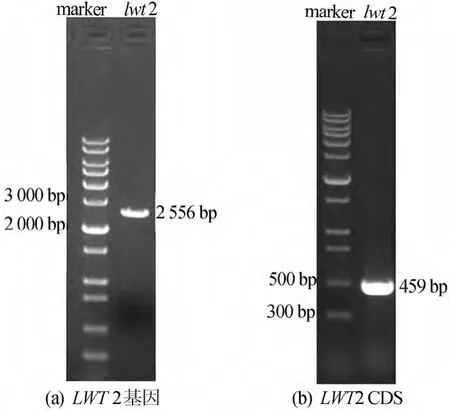
图1 电泳检测PCR扩增目的片段
2.2 LWT2基因连接转化与鉴定
将目的基因与pEasy-blunt载体连接并导入大肠杆菌 Trans1-T1感受态细胞中,用含50μg/mL Kanamycin的LB平板筛选阳性单克隆。挑取单菌落为模板进行菌落PCR,电泳检测分析。扩增出的条带均为阳性结果,如图2所示。用含有50μg/mL Kanamycin的LB液体培养基培养后提质粒测序。
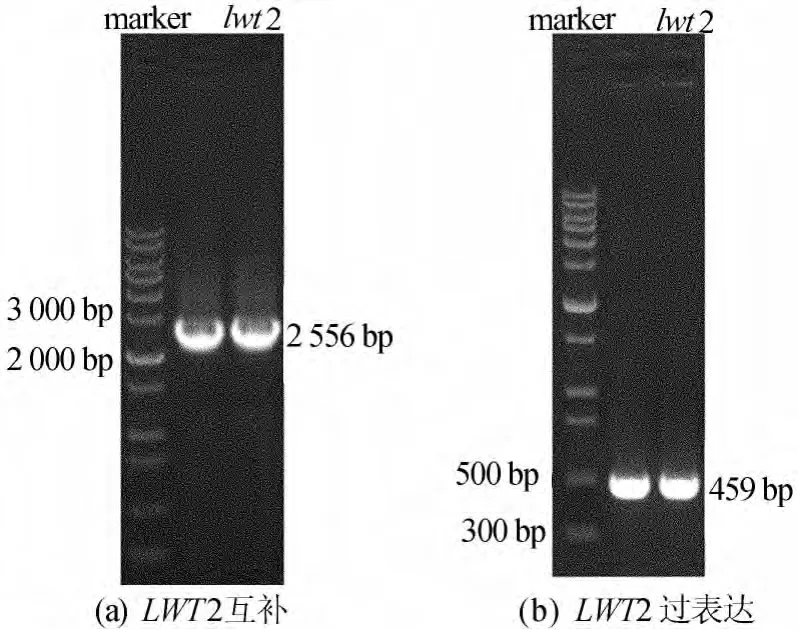
图2 重组质粒菌落PCR结果电泳检测
2.3 最终载体的构建
用限制性内切酶BamHⅠ和SacⅠ互补中间载体和pCambia 1301;用限制性内切酶BamHⅠ和EcoRⅠ过表达中间载体和pCambia 130135SN,回收正确片段后分别与对应载体用T4 DNA连接酶于16℃连接过夜,然后转化DH5α感受态细胞,用含有50μg/mL Kanamycin的LB平板筛选阳性单克隆。菌落PCR鉴定后摇菌提质粒测序。菌落PCR鉴定结果如图3所示。
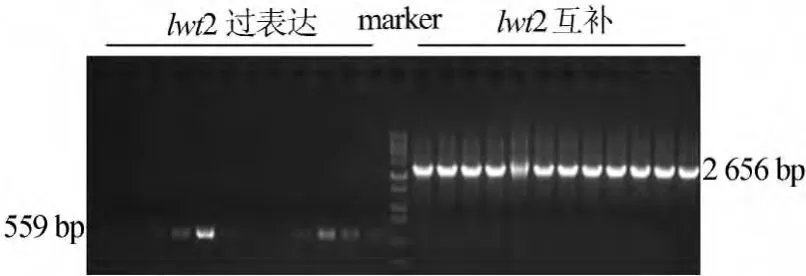
图3 载体酶切回收后电泳检测结果
2.4 纯和转基因植株
将获得测序正确的质粒用热激转化的方法转入农杆菌GV3101菌株的感受态细胞中,用含有50μg/mL卡那霉素和50μg/mL利福平的LB固体培养基筛选阳性克隆。挑取单菌落,进行菌落PCR验证,结果如图4所示。

图4 菌液PCR鉴定阳性菌验证
选取正确克隆接种于50μg/mL卡那霉素和 50μg/mL利福平的LB液体培养基28℃培养至OD值1.6左右,再用浸花转化法转化拟南芥。将转化的拟南芥种子撒到含有30μg/mL潮霉素的1/2MS板上纯化3d后正常培养14d,挑取长出真叶与根的T1代植株进行移栽。剪下部分叶片提取DNA和RNA,分别在基因组水平上和转录水平上检测基因的表达,检测结果如图5所示。

图5 LWT2转基因植株T1代阳性苗转录水平的鉴定
选择正确的阳性苗单株收种子T2,用含有30μg/mL潮霉素的1/2MS板筛选,选择分离比为3∶1(单插入)的T2种子,选择对应单插入的阳性植株进行后续试验。
3 讨 论
对植物来说,环境压力越来越大。研究植物抗逆机制对提高植物适应环境能力起重要作用。虽然不同物种中代谢途径的上下游会有差异,但并不影响对基因功能的研究。通过了解植物不同抗逆途径,可以减少与植物抗逆负相关的因素,提高正相关的因素来提高植物的抗逆能力。本文通过遗传学方法构建转基因材料,研究LWT2基因在干旱胁迫调控过程中的分子机制,为进一步研究该基因的分子机制奠定基础。
[1]Marshall A,Aalen R B,Audenaert D,et al.Tackling drought stress:RECEPTOR-LIKE KINASES present new approaches[J].The Plant Cell Online,2012,24(6):2262-2278.
[2]Sekine M,Ichikawa T,Kuga N,et al.Detection of the IAA biosynthetic pathway from tryptophan via indole-3-acetamide in Bradyrhizobiumspp[J].Plant and Cell Physiology,1988,29(5):867-874.
[3]Nemhauser J L,Hong F X,Chory J.Different plant hormones regulate similar processes through largely nonoverlapping transcriptional responses[J].Cell,2006,126(3):467-475.
[4]Akhtar M,Jaiswal A,Taj G,et al.DREB1/CBF transcription factors:their structure,function and role in abiotic stress tolerance in plants[J].Journal of Genetics,2012,91(3):385-395.
[5]Agarwal M,Hao Y J,Kapoor A,et al.A R2R3type MYB transcription factor is involved in the cold regulation of CBF genes and in acquired freezing tolerance[J].Journal of Biological Chemistry,2006,281(49):37636-37645.
[6]Vlachonasios K E,Kaldis A,Nikoloudi A,et al.The role of transcriptional coactivator ADA2bin Arabidopsis abiotic stress responses [J].Plant Signaling & Behavior,2011,6(10):1475-1478.
[7]Fujii H,Zhu J K.Osmotic stress signaling via protein kinases[J].Cellular and Molecular Life Sciences,2012,69(19):3165-3173.
[8]Nakashima K,Takasaki H,Mizoi J,et al.NAC transcription factors in plant abiotic stress responses[J].Biochimica et Biophysica Acta(BBA)-Gene Regulatory Mechanisms,2012,1819(2):97-103.
[9]Tardieu F.Any trait or trait-related allele can confer drought tolerance:just design the right drought scenario[J].Journal of Experimental Botany,2012,63(1):25-31.
[10]Tran L S P,Nakashima K,Shinozaki K,et al.Plant gene networks in osmotic stress response:from genes to regulatory networks[J].Methods in Enzymology,2007,428:109-128.
[11]吕申超,王海涛,鱼 斌,等.拟南芥HIS1-3基因克隆及表达载体构建[J].合肥工业大学学报:自然科学版,2012,35(1):120-123.
[12]Hua D P,Wang C,He J N,et al.A plasma membrane receptor kinase,GHR1,mediates abscisic acid-and hydrogen peroxideregulated stomatal movement in Arabidopsis[J].The Plant Cell Online,2012,24(6):2546-2561.
