碳酸酐酶Ⅱ基因克隆及在毕赤酵母中的异源表达*
2015-09-26卫玲赵莹徐晓晶
卫玲赵莹 徐晓晶*
(上海生物芯片有限公司/生物芯片上海国家工程研究中心 上海 201203)
碳酸酐酶Ⅱ基因克隆及在毕赤酵母中的异源表达*
卫玲**赵莹 徐晓晶***
(上海生物芯片有限公司/生物芯片上海国家工程研究中心 上海 201203)
碳酸酐酶Ⅱ(carbonic anhydrase Ⅱ, CA Ⅱ)是参与机体多种代谢活动和病理活动的一种重要催化酶。通过基因重组、电转化等方式,得到能异源高表达人CA Ⅱ的毕赤酵母(Pichia. pastoris)GS115工程菌。对工程菌进行培养及甲醇诱导后,经离子交换层析柱分离纯化后得到较纯的重组CA Ⅱ。通过Western blotting、酶活力及圆二色谱检测发现重组和商品化CA Ⅱ具有相似的酶活力和构象,为CA Ⅱ今后进一步在临床的研究和工业应用打下了基础。
碳酸酐酶Ⅱ 毕赤氏酵母 异源表达 甲醇诱导
碳酸酐酶(carbonic anhydrases, CAs,EC 4.2.1.1)是一类含锌金属酶[1],由Meldrum和Roughton于1933年首次从红细胞中分离纯化得到[2],现已证实其广泛存在于生物体内,包括动物、植物、水藻、细菌以及古细菌。根据其氨基酸序列的不同,碳酸酐酶至少有α、β、γ、δ、ε、ζ等六种不同类型[3-4]。多年来人们对碳酸酐酶的研究主要集中在与人类关系密切的α-CAs和β-CAs上[2]。人体中的α-CAs至少存在14种同工酶(HCA I-XIV),因CA Ⅱ在红血球中的大量分布,使其成为研究最广泛的同工酶[5-6]。CA Ⅱ分子量约为30 kDa,它的活性中心主要由两部分组成:一是在配基His-94,His-96,His-119,Thr-199,Glu-106,His-64参与下Zn2+与H2O或OH-形成的多面体;二是在上述多面体的临近处有一个由Leu-198,Val-143,Val-121,Trp-209组成的结合有CO2的疏水袋。
由于该酶在体内分布广泛,虽然其催化的只是一个简单的生理反应,但是其催化的底物CO2及产物HCO3-、H+却与人体多种生理及病理活动关系密切,如呼吸过程中代谢组织与肺之间CO2/HCO3-的转运,pH与CO2浓度之间的平衡,组织器官中电解质的分泌,青光眼、骨质疏松症、癫痫、肿瘤等疾病的形成等。若该酶表达异常或活性发生改变都会引起机体的病变,纠正该酶异常表达或抑制该酶的过高活性也能对CA Ⅱ引发的疾病起到积极的治疗作用[7]。例如,CA Ⅱ抑制剂能有效降低眼内压,减少HCO3-的生成,进而减少房水的生成,可用于治疗青光眼[8-9]。另外,该酶也与骨质疏松的发生有关,由于CA Ⅱ的表达随着破骨细胞功能状态的不同而发生变化,在骨吸收状态下它呈高表达,所以抑制该酶活性可以降低破骨细胞的骨吸收作用,改善骨吸收的酸性微环境,从而达到防治骨质疏松症的目的。这使得CA Ⅱ成为多种人类疾病研究中的重要靶点,对该酶的研究也逐渐成为热点[10-12]。
1 材料
分泌型表达质粒pPIC9K,Pichia pastoris GS115均由复旦大学宋大新老师惠赠。限制内切酶、Taq DNA聚合酶购自Promega公司;蛋白胨、酵母提取物等培养基均购自上海生工公司,抗CA单克隆抗体(一抗)购自Medix,辣根过氧化物酶标记的羊抗鼠抗体(二抗)购自晶美公司,引物均由上海生工公司合成; 商品化CAⅡ对照购自USCN公司。
2 方法
2.1 caⅡ基因的克隆、表达质粒构建及电转化至毕赤酵母GS115
以人胎盘组织提取的总RNA进行反转录,按反转录试剂盒说明书的方法合成cDNA;设计引物5’-Primer:(GACCCAAT)CTCGAGGCAGTGGTCAAAGTGCCCCTG(下划线为Xho I 位点),3’-Primer:(GT)GCGGCCGCTTA GGCGGCAGTGGCAAAGC(下划线为Not I位点),再以cDNA为模板通过PCR扩增获编码CA Ⅱ的基因片段(PCR条件: 95 ℃,5 min; 94 ℃变性30 s; 54 ℃退火30 s; 72 ℃延伸40 s;循环32 次; 最终70 ℃ 10 min,于16℃保存),扩增的caⅡ基因片段经Xho I和Not I双酶切克隆至P. pastoris的分泌型表达载体pPIC9k,获得表达质粒pPIC9k-CAⅡ(图1)。
所构建的表达质粒pPIC9k-CAⅡ用Bgl II酶切线性化,电转化P. pastoris GS115(His mut+)的感受态细胞,取200 ml涂布MD平板,于30℃培养至单菌落出现,得到1 000余个转化子[13]。
2.2 筛选高表达CA Ⅱ的毕赤酵母重组菌株
将上述1 000余个转化子依次点种到含G418分别为1、2、3和4 mg/L的YPD平板上,30 ℃培养,在含4 mg/L的G418平板上获得35个G418抗性转化子。
从上述35个G418抗性转化子中随机选择22个单菌落分别接入含3 ml BMGY培养基中,30 ℃,220 r/min振荡培养24 h;每份菌液各吸取1.5 ml接入含40 ml BMGY的培养基,同样条件下培养24 h,于室温离心 1 500 g,6 min,收集菌体。将菌体重悬于15 ml BMMY培养基中,同样条件下培养24 h,加入培养基体积1%的甲醇进行诱导表达。分别在诱导12、24和36 h时取样做SDS-PAGE电泳,筛选获得7株具有约30 kDa蛋白条带的高表达工程菌株[14]。
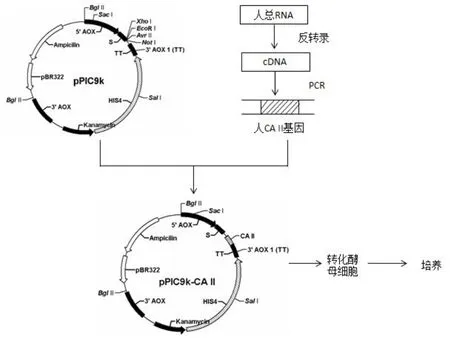
图1 重组pPIC9k-CAⅡ质粒的构建
2.3 重组CA Ⅱ在毕赤酵母中的异源高表达
从YPD斜面培养基挑选单菌落,接入含40 ml BMGY的250 ml 摇瓶,30 ℃,220 r/min振荡培养24 h。收集菌体用200 ml BMMY诱导培养基悬浮,同样条件下培养36 h,培养24 h时补一次甲醇,体积为培养基体积的1%。
2.4 重组CA Ⅱ的Western-blot鉴定
将电泳后的SDS-PAGE凝胶剥离,按照文献的方法进行电转移[15]、脱脂牛奶封闭、一抗及二抗孵育,然后显色、漂洗并终止显色,观察Western-blot实验结果。
2.5 重组CA Ⅱ的分离纯化
发酵上清液边搅拌边缓慢加入硫酸铵至饱和度为60%,冰浴搅拌2 h后1 500 g离心,弃上清,沉淀用50 mmol/L Tris-HCl,pH 8.5缓冲液复溶。复溶液用截留分子量为10 kD的透析袋对50 mmol/L Tris-HCl,pH 8.5透析过夜,然后,进行离子交换层析(Q-Sepharose Fast Flow,CV=1 ml,流速:1mL/min)。离子交换洗脱液A1 为50 mmol/L Tris-HCl,pH 8.5,B1为1 mol/L NaCl,50 mmol/L Tris-HCl,pH 8.5,分3段梯度洗脱,梯度分别为:35%B1、60%B1、100%B1,每段洗脱体积为10×CV、时间10 min。
2.6 重组CA Ⅱ酶活力测定
碳酸酐酶活力的测定参照Brownell等[16]方法略作改进:在一个4 ℃的冷冻反应室中, 加入5 ml巴比妥-KOH缓冲液(20 mmol/L, pH 8.3),并加入0.5 ml煮沸或未煮沸的CA Ⅱ,再注入4.5 ml 冰冷的CO2饱和水,测定pH下降的速度差异。酶活单位数(U)由公式10(T0/Te-1)求得,T0和Te 分别为加入煮沸和未煮沸CA Ⅱ测得的pH下降1所需时间。酶活力以每mg 蛋白含有的酶活单位数(U/ mg)表示[17]。以购买的商品化CA Ⅱ为标准参照(酶活力约为209 U/ml)。
2.7 酶稳定性研究
2.7.1 不同pH对酶稳定性影响
重组与商品化CA Ⅱ(浓度均为0.02 nmol/L)在pH 为 1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0时分别放置10 min,测定酶活力。
2.7.2 不同温度对酶的稳定性影响
重组与商品化CA Ⅱ(浓度均为0.02 nmol/L)在25~65 ℃范围,每隔5 ℃放置10 min,测定酶活力。
2.8 圆二色性比较
重组与商品化CA Ⅱ浓度都为1.0 mg/ml,上海药物所J-810圆二色光谱仪(日本分光 JASCO)在190~320 nm波长范围内检测,研究两者构象的相似程度。
3 结果
3.1 RT-PCR扩增重组caⅡ基因
按照2.1方法扩增了重组caⅡ基因,得到大小为800 bp的片段。电泳检测见图2。
3.2 caⅡ的基因克隆和重组表达质粒的构建
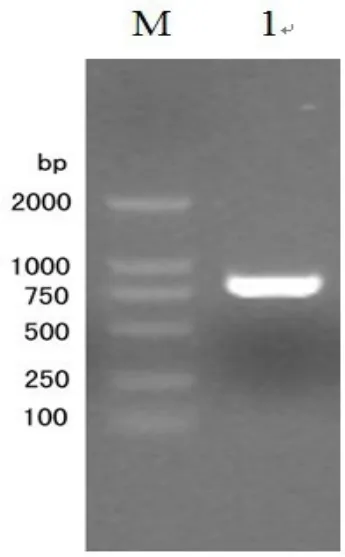
图2 扩增caⅡ基因的电泳图
将克隆得到的caⅡ基因测序,并与GenBank中的人ca Ⅱ基因cDNA序列进行比较。结果表明我们获得的caⅡ(NM000067)基因序列与数据库中的人ca Ⅱ基因序列100%匹配。得到的表达质粒pPIC9K-CAⅡ,导入P. pastoris GS115后进行筛选,经PCR扩增鉴定阳性转化子插入片段大小正确(图3)。

图3 编码人caⅡ基因的PCR扩增电泳图
3.3 表达条件试验
从图4可以看出,随着发酵诱导时间的延长,目的蛋白的表达量无明显升高。通过SDS-PAGE电泳图谱判断,加甲醇诱导表达24 h时蛋白条带最深,表明其蛋白表达量最高。故确定CAⅡ在BMMY培养基中的最佳诱导表达时间为24 h。

图4 不同诱导时间表达的CA Ⅱ的SDS-PAGE电泳
3.4 Western blotting鉴定
SDS-PAGE电泳图谱表明:重组CA Ⅱ的分子质量与对照商品化CA Ⅱ一样,约30 kDa。Western blotting结果表明在与SDS-PAGE电泳的特异蛋白条带相应位置出现一条特异的杂交带(图5)。

图5 SDS-PAGE(左)及Western blotting(右)图谱
3.5 重组CA Ⅱ的分离纯化
经QFF离子交换柱纯化,收集的第8管到第15管样品含有较纯的重组CA Ⅱ。测定合并后的CA Ⅱ的比活力为188 U/mg。

图6 重组CA Ⅱ纯化图谱
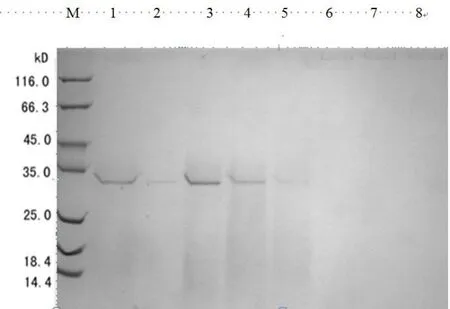
图7 纯化CA Ⅱ的SDS-PAGE电泳图
3.6 重组CA Ⅱ的稳定性
3.6.1 不同pH对酶活力的影响
pH对两种CA Ⅱ酶活力影响的试验表明,pH对两者的酶活力影响基本一致,pH为7.0时活性最高(记为100%),pH为1.0时酶活力最低(图8)。
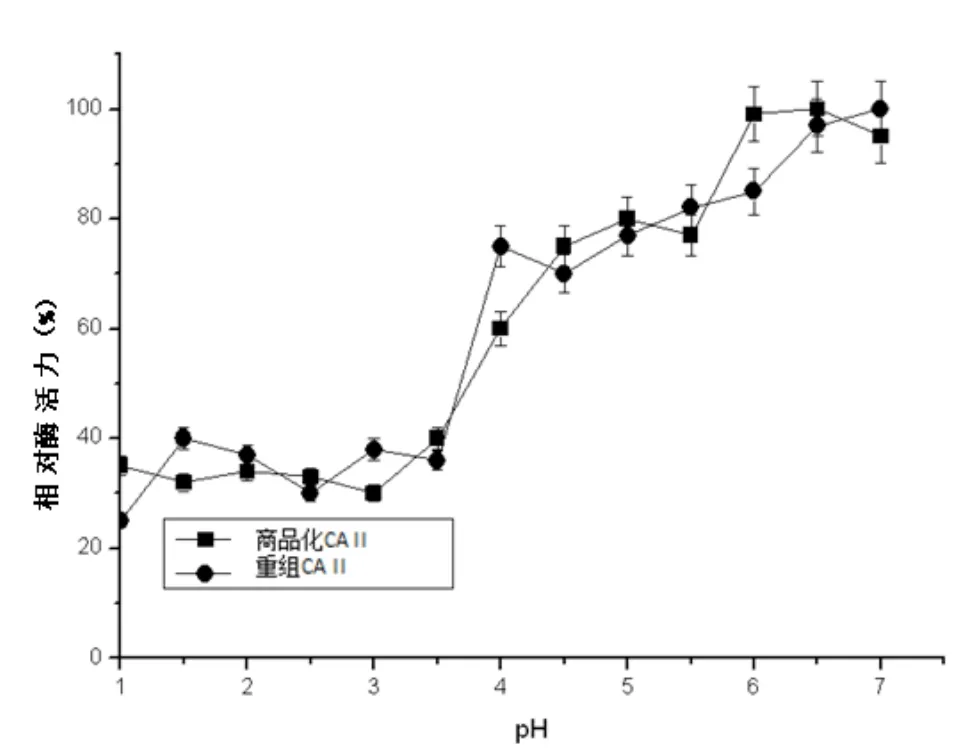
图8 不同pH对酶活力的影响
3.6.2 不同温度对酶活力影响
在温度为35~45 ℃时酶活力最高(记为100%),然后呈现急剧下降的趋势,当温度为65 ℃时,酶活力达到我们试验的最低点(图9)。

图9 不同温度对酶活力的影响
3.7 圆二色性比较结果
圆二色性比较结果显示重组和商品化CA Ⅱ的构象基本一致(图10)。
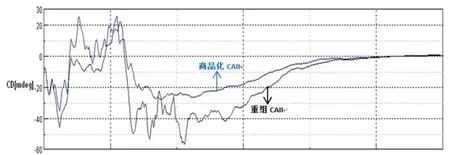
图10 圆二色性比较
4 讨论
本研究构建了重组CA Ⅱ的Pichia. Pastoris异源表达系统,高效表达人重组CA Ⅱ,分离纯化后得到较纯的重组蛋白。经酶活力检测及圆二色谱分析等发现该重组蛋白与商品化CA Ⅱ具有相似的酶活力及构象。该酶在35~45 ℃时活性最高,随着温度的上升,其活性急剧下降。由于该酶在碱性条件下出现了沉淀,故未做碱性条件下的酶活力试验。
本研究克隆的重组CA Ⅱ有助于其在毕赤酵母中的发酵生产及大量制备,将来可作为抗原蛋白开发青光眼、骨质疏松等疾病的诊断试剂,也可以作为药物靶点蛋白研发针对这些疾病治疗的抑制剂,为其进一步在医药开发方面的应用奠定了基础[18]。
[1] 郇丽, 贾兆君, 张宝玉, 等. 坛紫菜碳酸酐酶基因的克隆、表达及酶活性分析[J]. 海洋科学, 2014, 38(8): 8-15.
[2] Tripp BC, Smith K, Ferry JG. Carbonic anhydrase: new insights for an ancient enzyme[J]. J. Biol Chem, 2001, 276(52): 48615-48618.
[3] Sherman TA, Rongali SC, Matthews TA, et al. Identification of a nuclear carbonic anhydrase in Caenorhabditis elegans[J]. Biochim Biophys Acta, 2012, 1823(4): 808-817.
[4] Boone CD, Pinard M, McKenna R, et al. Catalytic mechanism of alpha-class carbonic anhydrases: CO2hydration and proton transfer[J]. Subcell Biochem, 2014, 75: 31-52.
[5] González JM, Fisher SZ. Carbonic anhydrases in industrial applications[J]. Subcell Biochem, 2014, 75: 405-426.
[6] Fisher SZ, Maupin CM, Budayova-Spano M, et al. Atomic crystal and molecular dynamics simulation structures of human carbonic anhydrase II: Insights into the proton transfer mechanism[J]. Biochemistry, 2007, 46(11): 2930-2937.
[7] Supuran CT. Carbonic anhydrase inhibitors[J]. Bioorg Med Chem Lett, 2010, 20(12): 3467-3474.
[8] Swenson ER. Carbonic anhydrase inhibitors and high altitude illnesses[J]. Subcell Biochem, 2014, 75: 361-386.
[9] Masini E, Carta F, Scozzafava A, et al. Antiglaucoma carbonic anhydrase inhibitors: a patent review[J]. Expert Opin Ther Pat, 2013, 23(6): 705-706.
[10] Rousselle AV, Heymann D. Osteoclastic acidification pathways during bone resorption[J]. Bone, 2002, 30(4): 533-540.
[11] Schwarz S, Sommerwerk S, Lucas SD, et al. Sulfamates of methyl triterpenoates are effective and competitive inhibitors of carbonic anhydrase II[J]. Eur J Med Chem, 2014, 86: 95-102.
[12] Frost SC. Physiological functions of the alpha class of carbonic anhydrases[J]. Subcell Biochem, 2014, 75: 9-30.
[13] 程颖, 高卜渝, 宋大新, 等. 转甲状腺素蛋白基因在酵母中的表达[J]. 生物工程学报, 1999, 15(4): 428-433.
[14] 张云华, 朱井玲, 熊安英, 等. 毕赤酵母表达Neuritin蛋白的纯化及鉴定[J]. 石河子大学学报(自然科学版), 2014, 32(1): 47-50.
[15] 汤贤英, 罗军敏. 医学免疫学实验教程[M]. 西安: 第四军医大学出版社, 2009: 116-124.
[16] Brownell PF, Bielig LM, Grof CPL. Increased carbonic anhydrase activity in leaves of sodium-deficient C4 plants[J]. Aust J Plant Physiol, 1991(18): 589–592.
[17] 曾宪东, 余龙江, 李为, 等. 西南岩溶地区黄荆叶片碳酸酐酶的稳定性[J]. 植物学通报, 2005, 22(2): 169-174.
[18] 许丽丽, 马志章, 周双林. 碳酸酐酶与临床医学[J]. 生命的化学, 2003, 23(2): 128-130.
Cloning of a gene encoding carbonic anhydrase Ⅱand heterologous expression in Pichia pastoris*
WEI Ling**, ZHAO Ying, XU Xiaojing***
(Shanghai Biochip Co. Ltd./ National Engineering Center for Biochip at Shanghai, Shanghai 201203, China)
Carbonic anhydraseⅡ(CAⅡ) is an important enzyme involving in various metabolic activities and pathological activity. A gene coding for carbonic anhydraseⅡwas cloned from human placenta and an expression plasmid was constructed with plasmid pPIC9K and introduced into a strain of Pichia. pastoris GS115 by electro-transformation to obtain an engineered strain. The recombinant CAⅡwas heterologously overexpressed in the engineered strain GS115 by induction with methanol and purified by anion-exchange chromatography. The purified recombinant CAⅡwas verified to have very similar characteristics to a commercial CAⅡthrough Western blotting,enzyme activity analysis and circular dichroism spectra. This work can lay a foundation for the clinical research and industrial application of CAⅡ in the future.
carbonic anhydraseⅡ; Pichia. pastoris; heterologous expression; methanol induction
Q78
A
1006-1533(2015)17-0074-05
国家863项目(2006AA02A252);上海市科委创投联动计划 (13CT1900900)
**
卫玲(1977-),女,硕士,工程师,从事蛋白质表达及分离纯化研究。E-mail: sophyling@ mail.sh.cn
***
徐晓晶,博士,副研究员。E-mail: xiaojing_xu@shbiochip.com
2015-05-29)
