盐酸改性海泡石对含Ni2+废水处理效果研究
2015-09-26宋凤敏刘智峰葛红光
李 琛,夏 强,2,曹 阳,宋凤敏,刘智峰,刘 瑾,葛红光
(1.陕西理工学院化学与环境科学学院,陕西汉中 723001;2.北京林业大学 环境科学与工程学院,北京 100083)
引 言
含Ni2+废水是典型的重金属废水,主要产生于镍的生产加工、镍合金工业、电镀镍及城市生活污水。目前,废水中Ni2+的去除方法主要有化学沉淀法、电解法、液膜法及离子交换法等[1-2]。最为广泛应用的化学沉淀法容易产生二次污染;电解法容易造成电极板锈蚀、损耗,处理效果不稳定、耗电量大;液膜法处理成本高;离子交换法对离子交换树脂选择性很高。因此,开发新工艺、新方法和新材料已经成为含镍废水处理的研究热点。吸附法是含镍废水处理的一种新方法,方法的核心环节是寻求高吸附性能、高选择性、廉价及高效的吸附材料[3-5]。
海泡石是一种具有层状和链状结构的镁硅酸盐粘土矿物,两层连续的硅氧四面体间夹了一层不连续的镁氧八面体,使海泡石具有极大的比表面积和孔容积,同时由于海泡石的大量孔隙和吸附活性中心使其内部有较大的负压,具有很强的吸附性[6]。海泡石储量大、吸附效能好、二次污染小、价格低廉且可以重复使用,在重金属废水处理领域逐渐受到关注。但是海泡石原矿品味较低,其晶体结构中的孔道也容易因杂质而堵塞,降低其吸附性能,另外,海泡石容易因吸水和流变性能而发生溶胀,导致固液分离困难,抑制了海泡石作为吸附剂的应用范围。研究发现,可以通过改性方法改善其吸附效果,如通过酸浸可以对海泡石的内部腔孔进行有效疏导,增大其内比表面积,吸附活性增强[7-11]。本课题以天然海泡石为原料,以盐酸为改性剂对海泡石进行酸改性,并研究了盐酸改性海泡石对含Ni2+废水的处理效果。
1 实验试剂及仪器
1.1 实验试剂及材料
实验所用海泡石原样产自河北石家庄,表观颜色呈灰白色,其主要组分如表1所示。海泡石经粉碎后过筛孔径约为0.045mm筛,取筛下组分为实验用海泡石。实验主要试剂有:盐酸、丁二酮肟、柠檬酸铵、碘、碘化钾、乙二胺四乙酸二钠、金属镍、硝酸及氢氧化钠。

表1 海泡石的化学组成
组分依据《非金属矿石物化性能测试和成分分析方法手册》方法测定[12]。
1.2 实验仪器
实验仪器设备有:紫外-可见分光光度计(美国瓦里安技术有限公司);SHZ-88水浴恒温振荡器(常州翔天实验仪器厂);98-1磁力搅拌器(上海司乐仪器有限公司);梅特勒-AL104电子天平(托利多仪器有限公司);PHS-3型pH计(上海精密科学仪器有限公司);101-1电热鼓风干燥箱(北京科伟永兴仪器有限公司);800型离心机(江苏正基仪器有限公司);SHA-C恒温水浴锅(金坛市科析仪器有限公司)。
2 实验方法
2.1 溶液中Ni2+的分析方法
采用丁二酮肟方法测定溶液中Ni2+的含量。1)标准曲线的制作。于25mL标准比色管中分别加入 ρ(Ni2+)为 10mg/L 的标准使用液 0、1、2、3、4 和5mL,加入 2mL 50% 柠檬酸铵、1.0mL 0.05mol/L碘,加水至20mL,摇匀,加入2mL 0.5%丁二酮肟,摇匀,最后加入2mL 5%Na2-EDTA,加水至刻度,待反应5min后,于10mm的比色皿中,在530nm处测量其吸光度,并作空白校正,绘制吸光度曲线,如图1所示。2)将吸附后的溶液稀释25倍,取10mL溶液于25mL比色管中,按照标准曲线的步骤进行显色和测量。由标准曲线求出镍的含量。原溶液中Ni2+的质量浓度为:

式中:ρ为吸附后溶液中 Ni2+的质量浓度,mg/L;m为从标准曲线上查得的Ni2+的质量,μg。
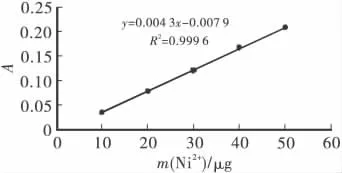
图1 Ni2+标准曲线
2.2 吸附实验方法
在一定温度下,准确取50mL 100mg/L的Ni2+标准溶液于锥形瓶中,用氢氧化钠和硝酸溶液调节溶液pH,再将0.5g干燥的盐酸改性海泡石投加到废水中。摇床震荡吸附(转速100r/min)足够长的时间,使吸附达到平衡。测定时,用高速离心机进行离心取得上清液;将上清液稀释25倍后,用丁二酮肟分光光度法进行测量。盐酸改性海泡石对Ni2+的吸附量的计算公式为:

式中:Q为吸附量,mg/g;ρ0为Ni2+初始质量浓度,mg/L;ρe为测定时刻Ni2+的质量浓度,mg/L;m为吸附剂的投加量,g;V为水样体积,mL。
2.3 盐酸改性海泡石的制备方法
[13]的改性方法,烘干过筛后的海泡石按固液比(10g/100mL)投加至浓度为1mol/L的盐酸溶液中,在65℃的水浴环境中加热搅拌反应600min后,用蒸馏水反复清洗反应产物至上清液的pH为中性,通过抽滤进行固液分离,最后固体产物在烘箱内烘干,研磨粉碎,过孔筛径约为0.15mm备用。
3 实验结果及分析
3.1 反应时间对吸附效果的影响
在θ为25℃,pH为5的条件下进行恒温震荡吸附,投加10g/L盐酸改性海泡石,考察吸附时间在10、20、30、60、120、180、240 和 300min 时的吸附效果,吸附时间对盐酸改性海泡石吸附Ni2+的影响如图2所示。由图2可以看出,盐酸改性海泡石对Ni2+的吸附在初始阶段吸附速率较快,随后逐渐减慢,在吸附2h时达到平衡。造成这一现象的原因,盐酸改性海泡石在改性过程中,不仅疏通了海泡石的孔道,溶液中的H+会代替海泡石晶格中Mg2+,使Si-O-Mg-O-Si基团生成两个Si-OH基团,其表面会产生大量的Si-OH基团[13]。Si-OH基团与 Ni2+可能发生以下配合吸附作用[14],从而将Ni2+从溶液中分离出来。在吸附的开始阶段,主要靠盐酸改性海泡石的表面的吸附位点进行吸附,吸附速度较快,随着吸附的继续,盐酸改性海泡石表面的吸附位点逐渐达到平衡,使得Ni2+开始向吸附剂的内部吸附位点转移,吸附速率变慢。当盐酸改性海泡石内部的吸附位点也达到平衡后,吸附完全达到平衡,随着时间的变化,盐酸改性海泡石对Ni2+的吸附量在一定范围内发生微量的波动。由图2还可以看出,随着吸附时间的延长,盐酸改性海泡石对Ni2+的吸附量呈增加趋势,在10~120min内吸附量增加迅速,在120~300min内吸附量的增加十分有限,因此后续实验中选择吸附t为120min。
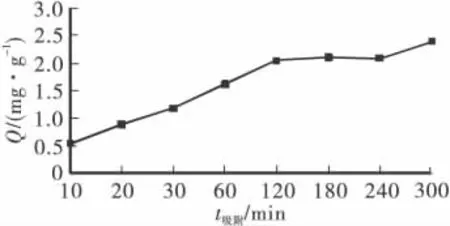
图2 吸附时间对吸附量的影响
3.2 Ni2+初始质量浓度对吸附量的影响
在θ为25℃,pH为5,吸附t为120min的条件下,投加10g/L盐酸改性海泡石恒温震荡吸附,考察盐酸改性海泡石对初始质量浓度为25、50、75、100、125和150mg/L含Ni2+废水的处理效果。结果如图3所示。
由图3可以看出,盐酸改性海泡石对Ni2+的吸附量随着Ni2+初始质量浓度的增加而增加,这一现象符合吸附的基本特征。在吸附剂使用量一定时,增大溶液中Ni2+初始质量浓度可以有效增加溶液中Ni2+与盐酸改性海泡石的接触机会,有利于吸附的进行。随着Ni2+初始质量浓度的增加,盐酸改性海泡石对Ni2+的吸附量的增加幅度逐渐变小,这是由于盐酸改性海泡石对Ni2+吸附趋于饱和所致。在25~50mg/L范围内,盐酸改性海泡石对Ni2+的吸附量增加十分明显,50~125mg/L范围内,盐酸改性海泡石对Ni2+的吸附量增加有限,电镀废水中的Ni2+质量浓度一般不超过100mg/L,后续实验中设定为Ni2+初始质量浓度为100mg/L。

图3 Ni2+初始质量浓度对吸附量的影响
3.3 pH对吸附量的影响
当废水pH大于7时,Ni2+会生成Ni(OH)2沉淀,从而影响吸附效果的测定,因此实验选取pH范围1~6,研究pH对盐酸改性海泡石吸附Ni2+性能的影响。在θ为25℃,吸附t为120min,Ni2+初始质量浓度为100mg/L的条件下,投加10g/L盐酸改性海泡石时恒温震荡吸附,考察 pH 在 1、2、3、4、5和6时的吸附效果。盐酸改性海泡石对Ni2+的吸附量受pH的影响如图4所示。由图4可知,随着pH的增加,盐酸改性海泡石对Ni2+的吸附呈增大趋势,在pH较低时,吸附量随pH增加而增加的幅度较大,当pH大于3时,吸附量随pH增加的比较缓慢。原因可能有两个方面:一方面,在盐酸改性海泡石吸附Ni2+的过程中,Ni2+与H+都存在竞争吸附,随着pH的增加,溶液中H+浓度降低,从而降低H+与Ni2+的竞争吸附作用。另一方面,盐酸改性海泡石 pHZPC为(7.2 ±0.1)[7],当溶液的 pH 大于3时,可以借助盐酸改性海泡石的缓冲能力使溶液的pH上升到7.2左右,有利于Ni2+的吸附。由图4可以看出,合适的pH范围在3~5,可以根据含Ni2+废水的实际pH进行综合考虑,当废水pH在3~5范围时以不调整废水pH为宜。海泡石在强酸性条件下(徐应明等人研究发现,这一现象的发生需要使废水氢离子浓度达到6mol/L[13])会产生部分酸蚀,造成海泡石腔孔结构的破坏,若含镍废水为强酸性条件时,应考虑可能出现的酸蚀及盐污染。

图4 pH对吸附量的影响
3.4 吸附温度对吸附量的影响
在pH为5,吸附t为2h,Ni2+初始质量浓度为100mg/L的条件下,投加10g/L盐酸改性海泡石时恒温震荡吸附,考察 θ在 25、35、45、55、65、75 和85℃时的吸附效果。盐酸改性海泡石的吸附量随温度的变化如图5所示。
盐酸改性海泡石对Ni2+的吸附量随着温度的升高而增加。吸附体系的温度升高,可增加Ni2+的扩散速度,提高海泡石与Ni2+的接触机会,有利于盐酸改性海泡石对Ni2+的吸附。由图5可以看出,θ的45~55℃时吸附效果最好,在废水处理过程中对废水进行加热在经济上不可行,而较高的温度对实验又有利,实验中以25℃(实验用水温度)为吸附温度,该温度并不是最佳吸附温度。因此,在含Ni2+电镀废水实际处理过程中,应该尽量缩短处理流程,适当进行管道保温,减少废水输运处理过程中热量的损耗,以达到更好的处理效果。

图5 温度对吸附量的影响
4 盐酸改性海泡石对Ni2+的吸附机理
4.1 吸附动力学
为了进一步研究盐酸改性海泡石对重金属的吸附过程,在 Ni2+的初始质量浓度为100mg/L,pH=5,25℃条件下,分别用一级速率方程式、二级速率方程式对盐酸改性海泡石吸附Ni2+量随吸附时间变化的实验数据进行拟合,两速率方程式如下:

式中:Qt、Qe分别为t时刻和平衡以后的吸附量,mg/g;K1为一级吸附速率方程的吸附速率常数,h-1;K2为二级吸附速率方程的吸附速率常数,g/(mg·h)。
盐酸改性海泡石对Ni2+的一级吸附速率和二级吸附速率拟合曲线如图6和图7所示,得到的动力学相关参数见表2。

图6 盐酸改性海泡石吸附Ni2+一级吸附速率方程拟合曲线

图7 盐酸改性海泡石吸附Ni2+二级吸附速率方程拟合曲线
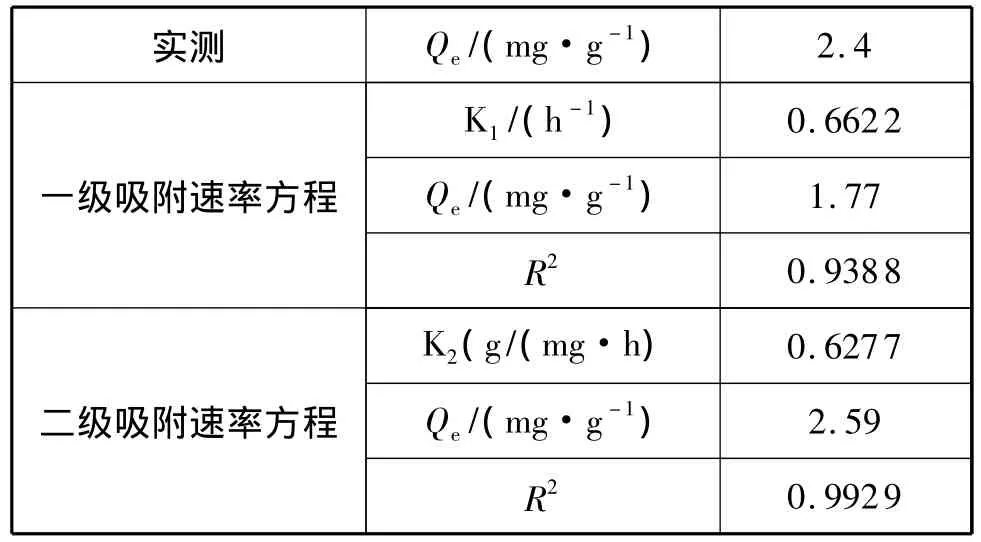
表2 盐酸改性海泡石对Ni2+的吸附动力学参数
由表2数据可知,盐酸改性海泡石对Ni2+的吸附较好的符合二级速率方程式,与一级动力学方程拟合较差,盐酸改性海泡石对Ni2+的吸附主要由化学吸附控制[15]。由二级速率方程计算出的平衡吸附容量为2.59mg/g,与实验结果接近。
4.2 等温吸附模型
Langmuir等温吸附模型和Freundlich等温吸附模型的表达形式公式:
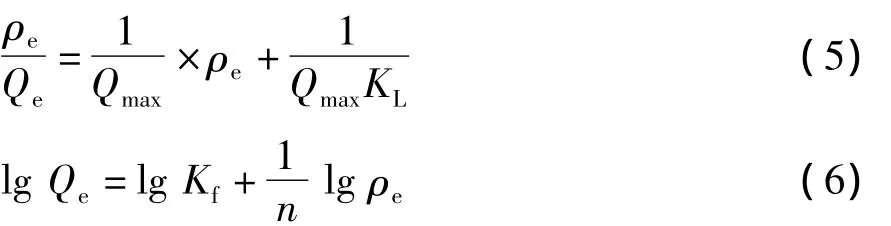
式中:Qmax,Qe为最大吸附量与吸附平衡时的吸附量,mg/g;ρe为吸附平衡时溶液中Ni2+的质量浓度,mg/L;KL是表征吸附材料表面的吸附点位对重金属离子亲和力的大小,L/mg;KL值越大,表明吸附点位对重金属离子的亲和力越大;Kf是吸附能力的量度,反映了吸附量的大小。
盐酸改性海泡石对Ni2+的Langmuir等温吸附模型和Freundlich等温吸附模型拟合曲线如图8和图9所示,模型参数如表3所示。

图8 盐酸改性海泡石对Ni2+的Langmuir等温吸附模型拟合曲线

图9 盐酸改性海泡石对Ni2+的Freundlich等温吸附模型拟合曲线
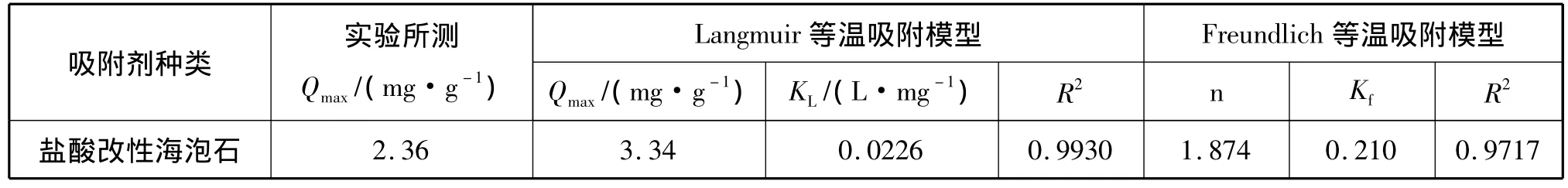
表3 盐酸改性海泡石对Ni2+的等温吸附模型参数
通过表3中的数据可知,Langmuir等温吸附模型与Freundlich等温吸附模型描述盐酸改性海泡石对Ni2+的吸附均合适;通过比较R2可知,盐酸改性海泡石对Ni2+的吸附更符合Langmuir等温吸附模型(R2大于0.99)。
因此可以推断出,盐酸改性海泡石对Ni2+的吸附介于单分子层吸附与多分子层吸附之间,单分子层吸附比重更多。通过从n>1可知,盐酸改性海泡石对Ni2+的吸附易于发生,属于优惠吸附[16]。
5 盐酸改性海泡石处理镀镍废水实例
为了研究所制备盐酸改性海泡石的应用价值,利用所制备的盐酸改性海泡石处理某电镀企业镀镍漂洗废水,废水中 ρ(Ni2+)为68.48mg/L,pH 为4。在一定温度下,向50mL废水中投加一定量的盐酸改性海泡石,并用硝酸或氢氧化钠溶液调节pH。
根据单因素实验,选取吸附时间、吸附剂投加量、pH和温度为正交试验因素,每个因素选择三个水平,由正交试验表L934进行实验设计,实验结果如表4、表5所示。由正交试验价差分析可知,盐酸改性海泡石对镀镍漂洗废水处理效果的影响因素主次顺序为:温度>吸附时间>pH>投加量。最佳实验条件为 A1B3C3D3,即反应 t为 30min,θ为65℃,pH为6,投加30g/L改性海泡石,去除率为98.39%。
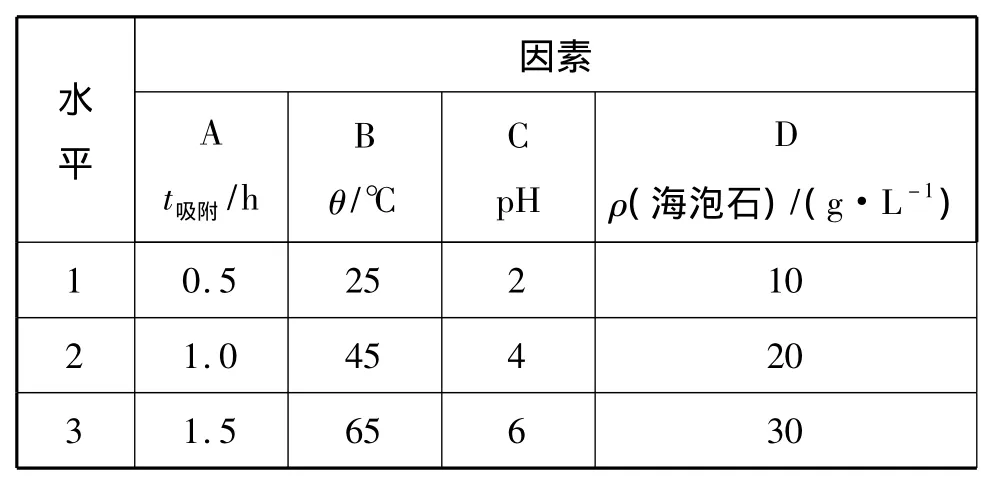
表4 盐酸改性海泡石处理含Ni2+废水正交试验因素水平表

表5 正交试验结果与分析
6 结论
1)对质量浓度为50mg/L的含 Ni2+废水,在25℃,pH为5,10g/L盐酸改性海泡石,吸附 t为120min的条件下,所制备的盐酸改性海泡石对Ni2+的饱和吸附量为2.40mg/g。
2)用动力学吸附方程和等温吸附方程对实验数据进行拟合,盐酸改性海泡石对Ni2+的吸附与二级动力学方程和Langmuir型等温吸附模型能够较好拟合,说明盐酸改性海泡石对Ni2+的吸附以化学吸附为主,主要为单分子层吸附,盐酸改性海泡石对Ni2+的吸附易于发生,属于优惠吸附。
3)盐酸改性海泡石对某电镀企业镀镍漂洗废水处理效果的影响因素主次顺序为:温度>吸附时间>pH>投加量。最佳实验条件反应t为30min,θ为65℃,pH为6,投加30g/L盐酸改性海泡石,Ni2+去除率为98.39%。
参考文献
[1]郭琳,查红平,廖小刚,等.化学沉淀法处理线路板厂含镍废水[J].环境工程,2011,(4):50-53,66.
[2]Rui Jie Jin,Chang Sheng Peng,Ahmed Abou-Shad,et al.Recovery of Precious Metal Material Ni from Nickel Containing Wastewater Using Electrolysis[J].Applied Mechanics and Materials,2012,164:263-267.
[3]罗志勇.焦化废水的物化处理技术研究进展[J].工业水处理,2012,(10):4-9.
[4]张寒冰,胡雪玲,韦藤幼,等.碱性钙基膨润土的制备及其应用研究进展[J].化工进展,2012,(7):1395-1401.
[5]党明岩,郭洪敏,谭艳坤,等.壳聚糖及其衍生物吸附电镀废水中重金属离子的研究进展[J].电镀与精饰,2012,34(7):9-13.
[6]李琛,于俊洋.海泡石改性及其在含铬废水处理中的应用[J].电镀与精饰,2013,35(10):17-22.
[7]徐应明,梁学峰,孙国红,等.海泡石表面化学特性及其对重金属 Pb2+、Cd2+、Cu2+吸附机理研究[J].农业环境科学学报,2009,(10):2057-2063.
[8]郑淑琴,任劭,张建策,等.改性海泡石的特性及其对重金属离子的吸附研究[J].中国非金属矿工业导刊,2013,(2):27-31.
[9]李琛,于俊洋.海泡石的改性及其在铅锌冶炼废水处理中的应用[J].科学技术与工程,2013,(30):1671-1815.
[10]杨胜科,费晓华.海泡石处理含镉废水技术研究[J].化工矿物与加工,2004,(9):16-17,20.
[11]罗伟锋,叶海林,富潇彬,等.水化学条件对海泡石吸附重金属镍离子(Ni2+)的影响及其机制研究[J].能源环境保护,2012,26(4):19-22.
[12]金永铎.非金属矿石物化性能测试和成分分析方法手册[M].北京:科学出版社,2004:67-102.
[13]徐应明,梁学峰,孙国红,等.酸和热处理对海泡石结构及吸附 Pb2+,Cd2+性能的影响[J].环境科学,2010,(6):1560-1567.
[14]黄文飞.复合污染体系中重金属和有机物在沉积物上的吸附行为[D].浙江:浙江大学,2007.
[15]Ramesh A,Hasegawa H,Sugimoto W,et al.Adsorption of Gold(Ⅲ),Platinum(Ⅳ)and Palladium(Ⅱ)on to Glycine ModifieCross linked Chitosan Resin[J].Bioresour Technol,2008,9:3801-3809.
[16]陈一良,潘丙才,孟凡伟,等.苯酚及对硝基酚在大孔树脂上吸附等温线的研究[J].离子交换与吸附,2004,(3):205-213.
