乙肝病毒变异检测中基因芯片技术的临床应用价值分析
2015-09-26曾崇亮
曹 玲,朱 凡,曾崇亮
(成都市公共卫生临床医疗中心 检验科,四川 成都610066)
乙肝是我国重点控制的传染病之一。乙肝病毒常常会因为受到人体免疫力、自然选择压力和抗病毒药物等因素影响而发生变异,这些变异可能会导致乙肝病毒出现致病性发生改变、产生耐药性和免疫逃逸等情况发生,因而给临床诊治造成极大的困扰[1,2]。本文希望通过探讨乙肝病毒变异检测中基因芯片技术的临床应用价值,为临床乙肝疾病诊治提供参考依据。现在报道如下。
1 材料与方法
1.1 研究对象
选择2013年确诊为慢性乙肝疾病的患者200例作为研究对象,患者病情均符合《病毒性肝炎防治方案》(2000年9月西安会议修订)的诊断标准,其中男性109例,女性91例,年龄在26岁至48岁之间,平均年龄(30.15±5.32)岁,研究对象检测时均未服用拉米夫定或干扰素等药物治疗,且没有丙型肝炎疾病和丁型肝炎疾病的重叠感染。研究对象根据病情程度可分为慢性重型肝炎22例、重度慢乙肝38例、中度慢性乙肝81例和轻度慢性乙肝59例。
1.2 标本采集与处理
研究对象均于纳入次日清晨由专业护士采集空腹静脉血2.0ml,经过3 000r/min低速离心分离血清10min,取其中20μl血清和30μl裂解液震荡混匀,将混合液放入沸水浴10min,然后再经过13 000r/min高速离心10min,取上层液体在PCR仪器上进行扩增,循环程序为扩增94℃预变性4min,然后94℃变性30s,然后再72℃延伸扩增30s,72℃再经过4min,循环30次后形成荧光标记的待测物。
1.3 方法
基因芯片由上海瑞芯生物科技有限公司提供,芯片固定了针对前C区、BCP区以及P区YMDD6位点共14条探针,待测基因使用地高辛标记,芯片杂交后在尼龙膜上进行转印并经过光学扫描仪扫描到该公司配套的乙肝动态性分析软件进行分析,芯片杂交、显色和结果判断均严格按照配套说明书执行。另外患者血清采用美国ABI7500型号PCR仪器进行荧光定量检测。
1.4 统计处理
PCR荧光定量检测结果使用对数均值表示,统计采用SPSS19.0统计学软件进行,计数资料使用卡方检验。P<0.05表示差异具有统计学意义。
2 结果
21 乙肝前C区、BCP区变异情况分析,见表1由表1可见,前C区A1896和前C区A1814同时变异13例,占前C区变异总数的10.0%(13/130);BCP区nt1762和BCP区nt1764联合变异98例,占BCP 区总变异数的83.1%(98/118);前 C 区A1896和BCP区nt1762/nt1764联合变异79例,占BCP区nt1762/nt1764联合变异数的80.6%(79/98)。

表1 乙肝前C区、BCP区变异情况分析
2.2 患者病情程度与乙肝前C区、BCP区变异情况分析,见表2。由表2可见,慢性重型肝炎患者变异发生率最高,然后依次是重度慢性乙肝、中度,轻度慢性乙肝变异发生率最低,且与其余三类病情患者两两比较,差异显著,具有统计学意义(P<0.05)。
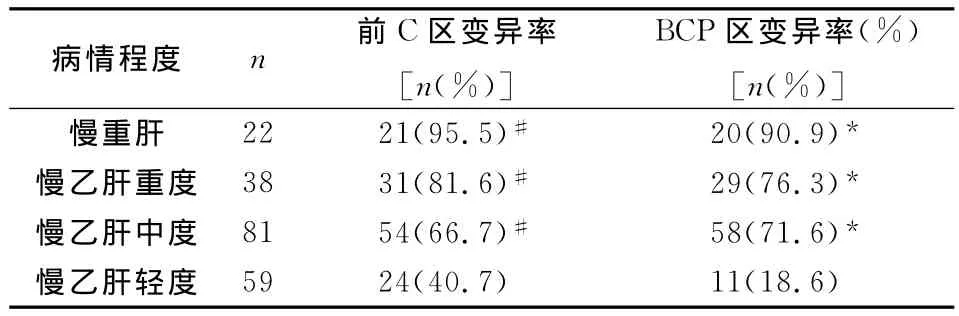
表2 患者病情程度与乙肝前C区、BCP区变异情况分析
2.3 乙肝病毒DNA复制程度与乙肝前C区、BCP区变异情况分析,见表3。由表3可见,患者乙肝病毒DNA定量在<104copy/ml时变异发生率最低,104-106copy/ml时 变 异 发 生 率 最 高,其 次 为 >106copy/ml,且组间差异显著,具有统计学意义(P<0.05)。
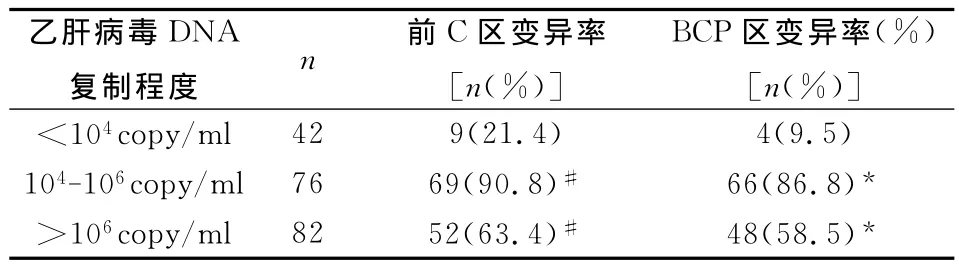
表3 乙肝病毒DNA复制程度与乙肝前C区、BCP区变异情况分析
2.4 血清e系统与乙肝前C区、BCP区变异情况分析,见表4。由表4可见,HBeAg(-)HBeAb(+)患者变异发生率最高,其次为 HBeAg(-)HBeAb(-)患者和 HBeAg(+)HBeAb(-)患者,且组间差异显著,具有统计学意义(P<0.05)。
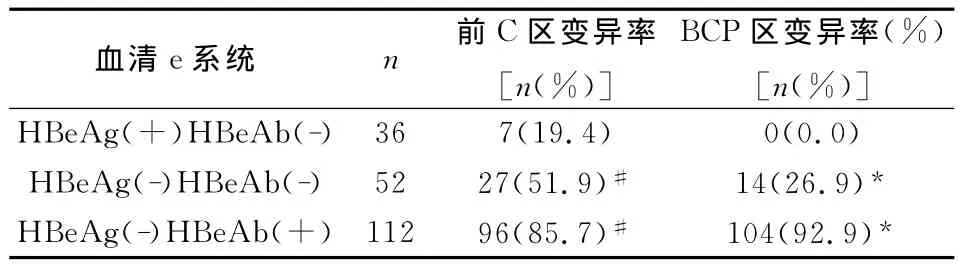
表4 血清e系统与乙肝前C区、BCP区变异情况分析
3 讨论
基因芯片又叫基因微矩阵,是近年来分子生物和医学诊断技术发展的重要产物[3,4]。基因芯片的应用原理是将大量寡核苷片段或特定基因片段作为探针高密度有序地固定排列在硅或玻璃上,然后与待测荧光标记的样本核酸按照碱基配对原则进行杂交,通过激光共聚系统检测杂交信号,经计算机分析处理从而获得样本分子数量和序列信息[5,6]。基因芯片具有高通量、快速并行等优点,能够一次性对大量序列进行检测分析,从而解决了传统核酸印记杂交操作繁杂、自动化程度低、效率低下等缺点,对于病毒学研究尤其是病毒基因表达研究、病毒感染等具有积极的临床价值[7,8]。
乙肝病毒的逆转录复制机理使得乙肝病毒变异较为常见,内源性和外源性选择压力下很容易产生免疫逃避变异株[9,10]。本文结果显示,由表1可见,乙肝病毒前C区A1896、A1814、BCP区nt1762和BCP区nt1764变异阳性率分别为58.5%、13.0%、55.0%、53.0%,前C区A1896和前C区A1814同时变异13例,占前C区变异总数的10.0%(13/130);BCP区nt1762和BCP区nt1764联合变异98例,占BCP区总变异数的83.1%(98/118);前 C区A1896和BCP区nt1762/nt1764联合变异79例,占BCP区nt1762/nt1764联合变异数的80.6%(79/98),说明患者未使用任何抗病毒药物时体内的乙肝病毒容易发生变异。由表2可见,慢性重型肝炎患者变异发生率最高,然后依次是重度慢性乙肝、中度,轻度慢性乙肝变异发生率最低,且与其余三类病情患者两两比较,差异显著,具有统计学意义(P<0.05),表明随着患者病情加重,乙肝病毒的变异情况发生情况逐步增多。由表3可见,患者乙肝病毒DNA定量在<104copy/ml时变异发生率最低,104-106copy/ml时 变 异 发 生 率 最 高,其 次 为 >106copy/ml,且组间差异显著,具有统计学意义(P<0.05),说明乙肝病毒前C区和BCP区变异情况与乙肝病毒DNA复制程度有关,但并不是复制程度越高变异情况发生率越大。HBeAg由前C/C基因表达,受到C基因启动子调控,BCP区是乙肝病毒前C区mRNA转录的重要元件,BCP区nt1762和BCP区nt1764联合变异能通过影响前C区mR-NA转录从而影响HBeAg的表达,乙肝病毒前C区和BCP区变异能够使HBeAg不表达[11];从表4可见,HBeAg(+)患者前C区变异率为19.4%,BCP区为0.0%,但在HBeAg(-)患者中前C区变异率为75.0%(123/164)和72.0%(118/164)就得到充分证实。
综上所述,临床医生应该对于 HBeAg(-)和乙肝病毒DNA复制程度>104copy/ml的患者要充分考虑到乙肝病毒变异,加强监测,预防慢重肝的发生。
[1]纪 冬,刘 妍,许智慧,等.乙肝病毒多聚酶区rtL229突变的演变及其表型分析[J].解放军医学杂志,2012,37(6):544.
[2]陈尚军,金生源,陆金鑫,等.拉米夫定重治疗既往YMDD变异慢性乙型肝炎疗效观察[J].实用肝脏病杂志,2010,13(1):57.
[3]李延武.利用基因芯片技术研究乙肝病毒耐药机制[J].现代中西医结合杂志,2012,21(12):1303.
[4]马丽国,徐兴伟.基因芯片在乙肝病毒检测中的应用[J].伤残医学杂志,2013(5):268.
[5]张惠琴,冯体玉,张灼锦.基因芯片法和测序法检测乙肝病毒基因分型的耐药突变比较[J].热带医学杂志,2014(7):867.
[6]谢 南,李金明,熊德琴,等.基因芯片法检测HBV多位点变异和基因分型的临床价值[J].广东寄生虫学会年报,2010(4):437.
[7]余 蓉,邱少红,李传珩,张 勤,简维国.HBV前S基因芯片检测研究[J].长江大学学报,2012(2):73.
[8]单万水,徐六妹,吴 驰,等.基因芯片技术在乙型肝炎病毒分型和耐药突变检测中的应用[J].国际检验医学杂志,2008,29(12):1069.
[9]吴建锋,侯晓玫,陈立平,等.乙肝病毒变异与肝细胞癌发生发展的相关性[J].北京医学,2013,35(6):464.
[10]刘 伟,刘义华,潘 丽,等.测序法分析乙肝病毒P区耐药突变[J].中国医疗前沿,2012(18):15.
[11]侯远沛,刘成永,高玉金.乙型肝炎病毒前C区和BCP区突变及基因型对HBeAg表达的影响[J].临床肝胆病杂志,2007,23(4):251.
