肿瘤坏死因子Ⅱ型受体基因多态性与特发性间质性肺炎的相关性研究
2015-09-26代华平
李 宁,代华平,朱 敏,辛 萍,肖 白
(1.首都医科大学附属北京朝阳医院-北京呼吸疾病研究所,北京100020;2.首都医科大学附属北京复兴医院 呼吸科,北京100038)
特发性间质性肺炎(idiopathic interstitial pneumonia,IIP)是一组发病原因不明的间质性肺疾病(ILD),以肺实质受到不同形式和程度的炎症和纤维化损害为特点,特发性肺纤维化(IPF)是IIP中最常见的一种。目前认为与炎症损伤及组织修复相关的细胞因子影响了IIP的发病,其中,肿瘤坏死因子及其受体在介导肺的炎症和纤维化的过程中起着重要作用。我们应用多聚酶链反应-限制性片段长度多态性 (PCR-RFLP)技术和测序的方法,对中国汉族人群TNFRⅡ196位点多态性与IIP,特别是与IPF发病的关系做初步探讨。
1 材料与方法
1.1 对象
收集2001.1-2013.12住北京朝阳医院呼吸内科确诊为特发性间质性肺炎(IIP)的患者100例,包括:IPF患者83例,均符合中华结核和呼吸杂志2002年发布《特发性肺纤维化诊断和治疗指南(草案)》IPF临床诊断标准[1],其中6例经外科肺活检确诊为普通型间质性肺炎(usual interstitial pneumonia,UIP);非IPF的IIP患者17例,诊断参考2002年ATS/ERS联合发表的《特发性间质性肺炎分类》的多学科国际共识意见[2],其中包括非特异性间质性肺炎(nonspecific interstitial pneumonia,NSIP)3例,其中1例经外科肺活检证实;隐源性机化性肺炎(cryopgenic organized neumonia,COP)11例,其中1例经外科肺活检证实;呼吸性细支气管炎性间质性肺疾病(respiratory bronchiolites-interstitial lung diseases,RB-ILD)3 例。对照组100例,入选标准:与IIP患者1∶1配对的中国汉族人群;性别相同,年龄±2(岁);吸烟指数±200(年·支);且无IIP病史,与IIP患者无血缘关系;主要来自健康体检者及因急诊外伤、骨折等而住院的无慢性疾病的住院病人。
1.2 方法
1.2.1 标本采集 采集外周静脉血3-5ml,2%EDTA抗凝液抗凝,-20℃低温保存。用常规酚-氯仿-异戊醇抽提法提取基因组DNA。
1.2.2 TNFRⅡ196位点基因多态性分析 按文献[3]报道的序列合成引物,扩增包含有TNFRⅡ196位点的目的基因片段。TNFRⅡ196位点上游引物:5’-ACTCTCCTATCCTGCCTGCT -3’,下 游引 物:5’-TTCTGGAGTTGGCTGCGTGT -3’。PCR反应总体积为25μl,包括10×PCR反应缓冲液(含 Mg2+)2.5μl,dNTP mixture 2.0μl,上游引物0.2μl,下游引物 0.2μl,ExTaq DNA 聚合酶0.2μl,DNA 模板1.0μl,ddH2O 18.9μl。
PCR反应条件为:95℃预变性2min,然后95℃变性30s,62℃退火30s,72℃ 延伸30s,40个循环后,72℃继续延伸7min,降至4℃保存。
用2.5%琼脂糖电泳检测PCR扩增产物。取PCR扩增产物8μl,与限制性核酸内切酶NlaⅢ1 μl,Buffer缓冲液1μl于37℃条件下消化6-8h,酶解产物经8%聚丙烯酰胺凝胶电泳检测。
1.2.3 统计学方法 SPSS19统计软件整理与分析。IIP组和对照组的年龄、吸烟指数及吸烟状态的差异分别采用t检验、秩和检验和卡方检验。基因型分布是否符合 Hardy-Weinberg遗传平衡定律及两组间基因型和等位基因频率的差异比较采用卡方检验。TNFRⅡ196位点突变基因型及突变等位基因与IIP、IPF的相对危险度分析采用Logistic回归计算比值比(OR)和95%可信区间(95%CI)。P<0.05为差异有显著性的标准。
2 结果
2.1 Hardy-Weinberg遗传平衡定律检测
TNFRⅡ196位点的各种基因型在IIP组和对照组人群的分布均符合 Hardy-Weinberg遗传平衡,结果有代表性(P>0.05)。
2.2 IIP组与对照组基本资料的比较
对IIP组和对照组的年龄做t检验,吸烟指数做秩和检验,吸烟状态做卡方检验,结果均无统计学差异(P>0.05)(见表1)。
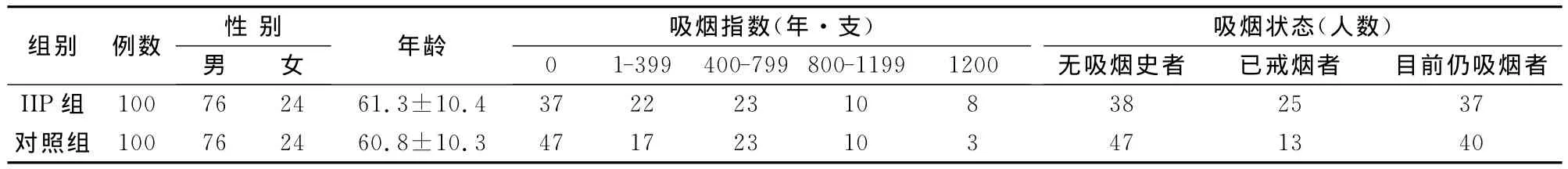
表1 IIP组(包括IPF和非IPF-IIP)与对照组基本资料的比较
2.3 TNFRⅡ196位点PCR扩增产物的限制性酶切结果
TNFRⅡ196位点的PCR扩增片段大小为242 bp。经NlaⅢ酶切后的PCR产物产生3种基因型,见图 1。分别为 196M/M(133bp 和 109bp);196M/R(242bp、133bp、109bp);196R/R(242 bp)。
2.4 TNFRⅡ196位点基因型、等位基因频率分析及与发生IIP、IPF的相对危险度分析(见表2-3)

图1 TNFRⅡ196位点酶切产物电泳
IIP组与对照组中的196R/R+196M/R突变基因型和196M/M野生基因型的差异在统计学上无显著性意义(P=1.000);两组中196R突变型和196M野生型等位基因的差异在统计学上无显著性意义(P=0.898)。IPF组与对照组中的196R/R+196M/R突变基因型和196M/M野生基因型的差异在统计学上无显著性意义(P=0.868);两组中196R和196M等位基因的差异在统计学上无显著性意义(P=1.000)。
TNFRⅡ196位点突变基因型196R/R+196M/R及突变196R等位基因与IIP及IPF的发生无显著相关性。
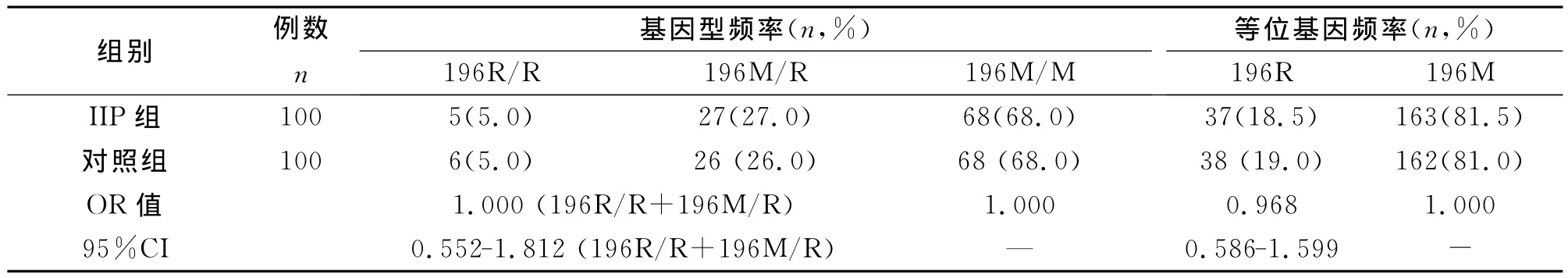
表2 TNFRⅡ196位点基因型和等位基因在IIP组和对照组的分布及相对危险度分析
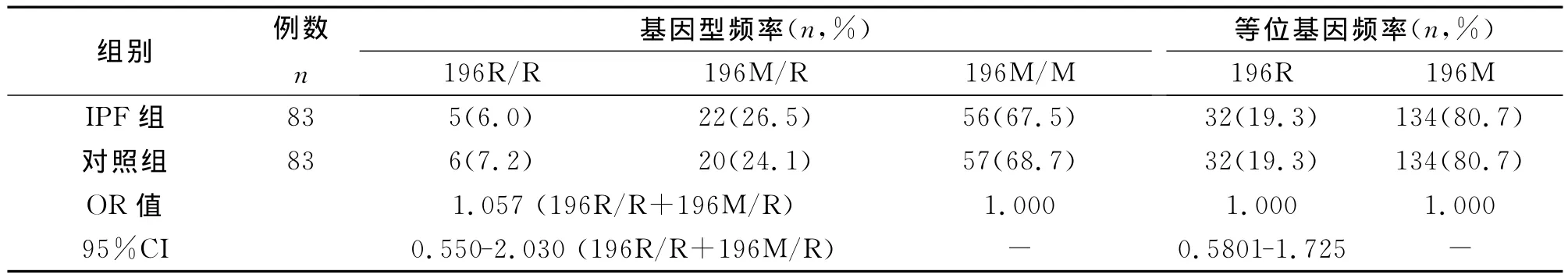
表3 TNFRⅡ196位点基因型和等位基因在IPF组和对照组的分布及相对危险度分析
3 讨论
近年来,在肺纤维化发病机制的研究中,多数学者认为这组疾病是由环境和遗传等多种因素共同作用而导致的一类极其复杂的疾病,遗传因素在其发病中可能起了重要的作用。它们的易感基因可能包括与上皮细胞损伤和异常损伤修复有关的多个基因多态性的联合作用,故各种细胞因子和表面蛋白基因成为候选基因。最近的研究表明,TNF-α,TGF-β1,IL-4受体拮抗剂等的基因多态性可能增加肺纤维化 发 生 的 风 险[4-6]。Pantelidis[5]等 的 研 究 表 明TNFR II和IL-6的基因多态性与IPF的发生有显著相关性。
目前已证实产生于巨噬细胞的细胞因子TNF-α在介导肺的炎症的和纤维化的过程中起着重要作用。TNF-α可以引起以肺泡上皮细胞和内皮细胞坏死为主的弥漫性肺泡损伤。它是一种前炎症细胞因子,可诱导血小板活化因子、IL-1、IL-8等致纤维化因子的释放,抑制肺泡Ⅱ型细胞表面活性物质;并可能间接通过转化生长因子-β或血小板衍化生长因子诱导途径促进成纤维细胞增生、分化和胶原转录;大量的TNF-α还可诱导肺泡上皮细胞凋亡而引起肺纤维化反应。Liu等[7]发现,TNF-α不但直接促进纤维化的发生,而且促进纤维蛋白溶酶原抑制物I的产生,抑制细胞外基质(ECM)降解。研究[8]证实在纤维化的肺部组织中,TNF-α大量增殖,TNF-αmRNA的水平高于正常肺组织。因此认为TNF-α在肺纤维化发病的过程中是一个关键性因子。
在体内,TNF-α的生物学活性必须依赖细胞表面的 TNF受体(TNF receptor,TNFR)来完成。TNF-α/TNFR系统是体内重要的炎症因子,同时对细菌感染,某些自身免疫疾病和退化性疾病有保护功能,因此,TNFR的生物学活性取决于影响TNF-α/TNFR平衡的诸多因素,并且受遗传和环境因素,细胞分化的不同时期以及细胞因子网络间的信息传递等的影响。
TNFR有TNFR I和TNFR II两种受体。TNFR I参与活化NF-κB,介导细胞凋亡,成纤维细胞增殖等;而TNFR II可通过信号转导途径激活NF-κB,传递胸腺细胞和NK等淋巴细胞的增殖信号,使细胞增殖和分化。近年研究认为,当细胞表面TNFR2表达上调或过度表达时,TNFR2可直接与肿瘤坏死因子受体相关因子(TRAF2)结合,竞争TNFR1信号转导通路中的TRAF2分子,TNFR2还通过其适配分子—细胞性凋亡抑制因子-1(CIAP1)引发TRAF2发生泛素化及蛋白降解反应,从而增强TNFR1介导的细胞凋亡作用[9]。Erickson的研究[10]显示TNFRII基因敲除的小鼠对TNF致肺纤维化的敏感性降低,肺泡Ⅱ型上皮细胞的增殖活性明显被抑制,说明TNFRII在肺纤维化的发病中起着重要作用。
TNFR I由TNFRSF1A编码,TNFR II由TNFRSF1B编码。编码TNFR II的基因位于染色体1p36,它有许多多态性位点,其基因多态性可能影响TNFR II的功能和(或)分泌。TNFRII基因第6外显子196位点存在T→G碱基的突变(即ATG→AGG),这一突变导致基因产物多肽链中的一个甲硫氨酸(methionine,M)被精氨酸(methionine,R)取代,目前推测196G是一个失去功能的置换,其多态性影响TNFRII的转录,直接调控TNFRII的表达量,从而使TNFRII功能异常,可能导致该基因的个体表现过度的免疫反应和过强的凋亡作用;同时,与TNFRII 196T相比,196G对IL-6的合成和分泌有明显的促进作用,并增加细胞毒性[11]。Till等[12]对TNFRⅡ196R转染的人类Hela细胞系进行研究,证明TNFRⅡ196位的变异改变了NF-kB信号传导通路,使TNF-α诱导细胞凋亡的作用增强,导致细胞增生及慢性炎症性疾病的发生;从而提示TNFRⅡ196位点的多态性可能在许多不同的慢性疾病的发病中起作用。
目前已有多项实验证实TNFR196位点基因突变与多种慢性病症易感性相关,如自身免疫性疾病、感染性疾病、恶性肿瘤等疾病的进程及严重程度相关。
Cipriano[13]等发现在社区获得性肺炎患者中,携带TNFRSF1B+196TG基因型的患者比携带TT或GG基因型患者死亡率低。近年的研究[14]显示,TNFRII 196位点GG基因型与欧洲人群类风湿性关节炎(RA)患者存在关联。此外,台湾地区的CH Tung等人[15]的研究发现 TNFRSF1B+196T/G的单核苷酸多态性与强直性脊柱炎的发病有相关性。结缔组织病患者多有多脏器累及,据报道,其中发生肺间质病变(CTD-ILD)在临床诊疗中并不少见。目前其发病机理不明,可能与血管炎有关,血管壁的免疫复合物激活补体释放中性粒细胞趋化因子,导致中性粒细胞在局部聚集释放胶原酶及氧自由基,破坏肺实质,造成肺泡炎,而晚期逐渐进展为肺纤维化病变。目前认为,不同结缔组织病所致肺间质病变的机理各有不同,但细胞因子在其纤维化的发生和发展中起着重要作用,如IL-1、IL-8、TGF-β1、TNF-α、胰岛素样生长因子-α(IGF-α)等[16],故它可能与IIP存在着共同的病理特点和致病基因。而国内李霖等[17]的研究认为TNFRⅡ196位点的基因多态性与中国汉族人群矽肺的发病可能无关。
目前TNFRII基因196位点多态性与IIP、IPF相关性的报道较少。本研究结果提示了中国汉族人群中TNFRⅡ196位点基因多态性可能与IIP,特别是与IPF的发生无关联,但尚需做进一步研究证实。
本研究结果表明中国汉族人群中TNFRII 196位点基因多态性可能与IIP、IPF的发生无关联。但是本实验也存在一定的局限性:本研究中非IPF-IIP患者较少,故未能做非IPF组与IPF组的比较,因此今后需要扩大样本量进行研究;另外,还需对IIP的环境危险因素及遗传因素进行交互作用分析等研究工作,以期为IIP疾病的早期预防、早期发现及早期治疗提供科学依据。
[1]中华医学会呼吸病学分会.特发性肺(间质)纤维化诊断和治疗指南(草案)[J].中华结核和呼吸杂志,2002,25(7):387.
[2]American Thoracic Society/European Respiratory Society International Multi-disciplinary Consensus Classification of the Idiopathic Interstitial Pneumonias[J].Am J Respir Crit Care Med,2002,165:277.
[3]Al-Ansari AS,Ollier WE,Villarreal J,et al.Tumor necrosis factor receptorⅡ(TNFRⅡ)exon 6polymorphism in systemic lupus erythematosus[J].Tissue Antigens,2000,55(1):97.
[4]Son JY,Kim SY,Cho SH,et al.TGF-β1T869Cpolymorphism may affect susceptibility to idiopathic pulmonary fibrosis and disease severity[J].Lung,2013,191(2):199.
[5]Pantelidis P,Fanning GC,Wells AU,et al.Analysis of tumor necrosis factor-α,lymphotoxin-α,tumor necrosis factor receptor II,interleukin-6polymorphisms in patients with idiopathic pulmonary fibrosis[J].Am J Respir Crit Care Med,2001,163:1432.
[6]Vasakova M,Sterclova M,Matej R,et al.IL-4gene polymorphisms and lung tissue markers in idiopathic pulmonary fibrosis[J].Hum Immunol,2013,74(10):1346.
[7]LIU RM.oxidative stress,plasminogen activalor inhibitor1and lung fibiosis[J].Antioxid Redox Signal,2008,10(2):303.
[8]Higgins DF,Kimura K,Bernhardt WM,et al.Hypoxia promotes fibrogenesis in vivo via HIF-1simulation of epithelial to mesenchymal transition[J].J Clin Invest,2007,117(12):3810.
[9]Wicovsky A1,Henkler F,Salzmann S,et al.Tumor necrosis factor receptor-associated factor-1enhances proinflammatory TNF receptor-2signaling and modifies TNFR1-TNFR2cooperation[J].Oncogene,2009,28(15):1769.
[10]Erickson,SLFJ,DeSauvage K.Kildy K,et al.1994.Decreased sensitivity to tumor necrosis factor but normal T-cell development in TNF receptor-2-deficient mice[J].Nature,1994,372:560.
[11]Nakamura T,Kimoto Y,Mitoma H,et al.A functional M196R polymorphism of tumour necrosis factor receptor type 2is associated with systemic lupus erythematosus:a case-control study and a meta-analysis[J].Ann Rheum Dis,2007,66(3):320.
[12]Till A,Rosenstiel P,Krippner-Heidenreich A,et al.The met-196→arg variation of human tumor necrosis factor receptor 2(TNFR2)affects TNF-α-induced apoptosis by impaired NF-kB signaling and target gene expression[J].J Biol Chem,2005,280(7):5994.
[13]Cipriano C,Caruso C.Lio D,et al.The-308G/A polymorphism of TNF-a influences immunological parameters in old subjects affected by infectious diseases[J].Int J Immunogenet,2005,32(1):13.
[14]Song GG1,Bae SC,Lee YH.Associations between functional TNFR2 196M/R polymorphisms and susceptibility to rheuma-toid arthritis:a meta-analysis[J].Rheumatol Int,2014,34(11):1529.
[15]Tung CH,Lu MC,Huang KY,et al.Association between ankylosing spondylitis and polymorphism of tumour necrosis factor receptor II in Taiwanese patients[J].Scand J Rheumatol,2009,38(5):395.
[16]Jian XD,Guo GR.Clinical observation of rheumatoid arthritis associatesd interstitial lung disease patients and changes of serum cytokines thereof[J].Zhonghua Yi Xue Za Zhi,2008,88(27):1884.
[17]李 霖,余 晨,等.肿瘤坏死因子-α及其Ⅱ型受体基因多态性与矽肺[J].中华劳动卫生职业病杂志,2004,22(5):323.
