管花肉苁蓉的生物学研究进展△
2015-09-25刘国库屠鹏飞杨太新高钦
刘国库,屠鹏飞,杨太新*,高钦
(1.河北农业大学农学院/河北省作物生长调控实验室,河北 保定 071001;2.北京大学 药学院,北京 100191)
·综述·
管花肉苁蓉的生物学研究进展△
刘国库1,屠鹏飞2,杨太新1*,高钦1
(1.河北农业大学农学院/河北省作物生长调控实验室,河北 保定 071001;2.北京大学 药学院,北京 100191)
管花肉苁蓉Cistanchetubulosa(Schenk)R.Wight为中药肉苁蓉的基源植物之一,也是肉苁蓉属植物中最易发展大规模栽培的种。为了促进管花肉苁蓉高产稳产栽培技术的研究与推广,本文对管花肉苁蓉的植物学形态特征、寄生生物学特性、分子生物学等方面研究进展进行了概述,并对其进一步研究提出了展望。
管花肉苁蓉;植物学形态;生物学特性;分子生物学
中药肉苁蓉为列当科植物肉苁蓉CistanchedeserticolaY.C.Ma或管花肉苁蓉Cistanchetubulosa(Schenk)R.Wight的干燥带鳞叶的肉质茎,具有补肾阳、益精血、润肠通便等功效[1]。国内外对肉苁蓉属植物的研究主要集中于肉苁蓉、管花肉苁蓉和盐生肉苁蓉Cistanchesalsa(C.A.Mey)G.Beck[2]。管花肉苁蓉主要分布于新疆南疆的塔克拉玛干沙漠及其周围地区,由于长期的不合理采挖,其野生资源已面临濒危。为保证中药肉苁蓉的原料供应,同时保护野生资源,从二十世纪九十年代开始发展管花肉苁蓉的人工种植,二十多年来已在新疆和田地区种植柽柳并接种管花肉苁蓉达到1.3万hm2。为了促进管花肉苁蓉高产稳产栽培技术的研究和推广应用,同时也促进野生资源的有效保护,本文对管花肉苁蓉的植物学形态特征、寄生生物学特性及分子生物学等方面的研究进展进行概述,并对其进一步研究提出了展望。
1 植物学形态特征
1.1 植物学形态
管花肉苁蓉为多年生寄生草本,植株高20~150 cm,少数可达2 m以上,地上部分高30~70 cm,少数可达120 cm。茎肉质,不分枝,基部常呈纺锤形,中上部呈圆柱型,直径5~15 cm,鲜时白色,干后棕褐色,断面白色。叶乳白色,干后变褐,三角形,长0.5~4 cm,宽0.5~2 cm,生于茎上部的渐狭为三角状披针形或披针形。穗状花序,长10~70 cm,少数达110 cm,直径5~20 cm;苞片长圆状披针形或卵状披针形,长2~2.7 cm,宽5~11 mm,边缘被柔毛,两面无毛;小苞片2枚,线状披针形或匙形,长1.5~1.7 cm,宽1~5 mm,近无毛。花萼筒状,长1.5~1.8 cm,顶端5裂至近中部,有的裂片再分裂成2~3个小裂片,乳白色,干后变黄白色,近等大,长卵状三角形或披针形,长6~10 mm,宽2.5~3 mm。花冠管状漏斗形,长3.5~4.2 cm,顶端5裂,裂片在花蕾时多数为紫色至粉红色,少数白色或鲜黄色,干后变棕褐色,近等大,近圆形,长8 mm,宽1 cm,两面无毛。雄蕊4枚,花丝着生于距筒基部7~8 mm处,长1.5~1.7 cm,基部膨大并密被黄白色长柔毛,花药卵形,长4~6 mm,密被黄白色长柔毛,基部钝圆,不具小尖头。子房长卵形,花柱长2.2~2.5 cm,柱头扁圆球形,2浅裂。蒴果长圆形,长1~2 cm,直径0.7~1.5 cm。种子多数,近圆形,干后变黑褐色,外面网状;种胚为球型原胚;珠柄突起处有种孔,直径100~200 μm。花期4~6月,果期6~8月[3]。
1.2 组织结构
屠鹏飞等[4]最先对肉苁蓉属植物肉质茎的组织结构进行了系统研究,此后付桂芳等[5]对荒漠肉苁蓉和管花肉苁蓉的茎、叶、花的组织构造进行了报道,李志军等[6]对管花肉苁蓉的异常构造的发生进行了研究。由于屠鹏飞等的研究内容发表在有关专著中,为了便于阅读,本文对管花肉苁蓉茎组织构造进行详细介绍,并对其叶、花的组织结构进行简要介绍。
管花肉苁蓉肉质茎组织特征(图1):表皮为一列扁平类长方形、类椭圆形薄壁细胞组成,外被角质层,有些部位表皮细胞和角质层脱落。后生皮层由十多列类圆形、类长圆形细胞组成,壁木栓化,外侧挤压破裂,有些部位与表皮细胞一起脱落。皮层狭窄。中柱维管束散生,外韧型,最外侧维管束单个散生,内侧常3~6个维管束成群,韧皮部向心,木质部向外,排列成梅花形,横切面每一个维管束呈卵圆形;韧皮部由薄壁性细胞组成,茎上部有少量纤维,中下部无纤维,韧皮纤维呈长条形,长至600 μm,宽11~43 μm,壁厚1~5 μm。无纹孔和孔沟;木质部由导管和木薄壁细胞组成;导管主为网纹和具缘纹孔导管,少螺纹和孔纹导管,网纹、具缘纹孔、孔纹导管分子长80~270 μm,直径25~55 μm,壁厚2~5 μm,具缘纹孔导管纹孔呈网状或梯状排列,螺纹导管分子长270~500~800 μm,直径13~20 μm,壁厚2 μm。茎上部韧皮部外侧和木质部内侧孔纹细胞易见,有些部位连接成环,木质部内侧孔纹细胞长方形至长条形,纹孔、孔沟明显,纹孔狭椭圆形,排列成网状或交叉;茎中下部木质部内侧孔纹细胞类圆形,壁略增厚,纹孔、孔沟明显。皮层和中柱基本组织中含有大量淀粉粒,单粒,类球形、卵形、椭圆形,直径10~70 μm,脐点星状、人字形、一字形、裂隙状,层纹不明显[4]。
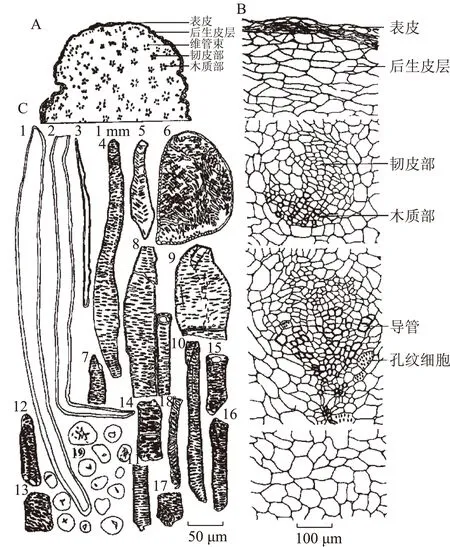
A.横切面组织简图,B.横切面组织详图,C.解离组织和粉末图。1~3.韧皮纤维,4~6.孔纹细胞,7~11.网纹导管,12~16.具缘纹孔导管,17.孔网纹导管,18.螺纹导管,19.淀粉粒。图1 管花肉苁蓉茎组织特征
管花肉苁蓉肉质茎异常构造的形成:管花肉苁蓉肉质茎的维管束散生,而且随着茎的增大,不断分化新的维管束,这种类型的维管束在双子叶植物茎的组织构造中是极罕见的。研究表明,其维管束主要发生在两个部位。首先是中柱外侧,相当于中柱鞘的部位,细胞分化,先形成韧皮部,然后向内分化木质部,向外分化韧皮部,形成新的维管束,使茎不断变粗,所以在中柱外侧可见仅有韧皮部的维管束(图2-A);其次为中柱内侧,在韧皮部外侧的薄壁细胞,恢复分生能力,形成新的维管束,分化过程也同样先分化韧皮部,然后再向外分化木质部,向内分化韧皮部,从而形成韧皮部向心、木质部向外的维管束群,此类维管束分化的结果,使中柱部分的细胞相互挤压而成脑纹状结构[4](图2-B)。
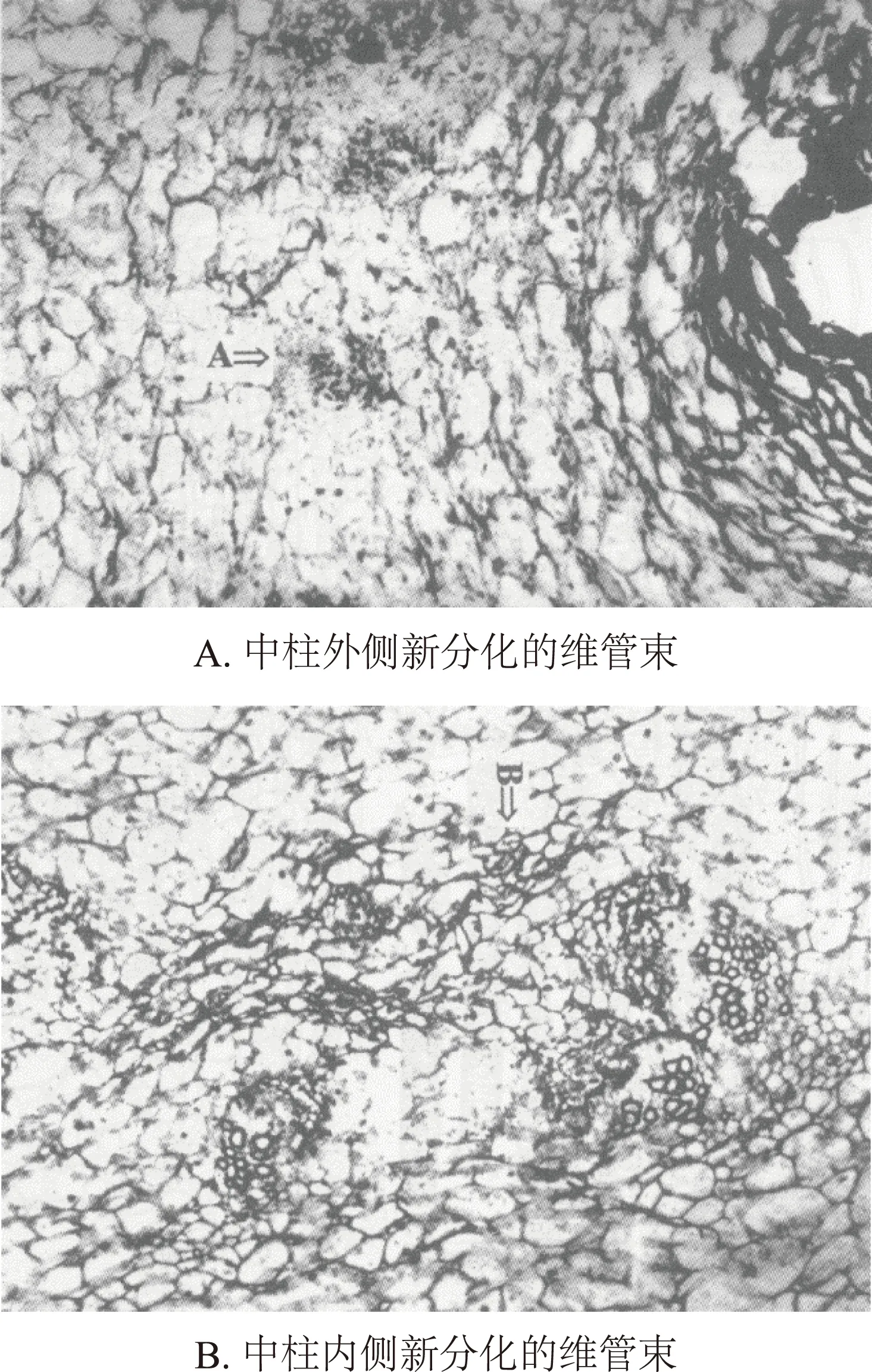
图2 管花肉苁蓉异常构造的形成
管花肉苁蓉叶的组织结构:为等面叶,上表皮为一层扁平多边形细胞,叶肉组织不分化,均为海绵状组织。维管束无限外韧型,具束中形成层,多6~13束,均有侧分枝,无髓部。上表皮无气孔,下表皮具有大量的平轴式及不等式两种气孔[5](图3)。

1.维管束,2.上表皮,3.下表皮。图3 管花肉苁蓉鳞叶横切面(×4)
管花肉苁蓉花的组织结构:子房表皮细胞由一层整齐扁平多边形细胞组成,略角质化,皮层由数十层薄壁细胞组成,心皮的胚珠着生于每一无限外韧型的维管束上,珠柄较长,每一心皮的维管束数约2~3束。开花与未开花有明显变化,四心皮单雌蕊,侧膜胎座,未开花时将子房不均分成5~7室不等,开花后将子房呈不均匀地分成8室不等(图4);空心花柱表皮由一层扁平的多边形细胞组成,皮层由数十层薄壁细胞组成,偶尔形成大的细胞腔隙,2束对生周木型维管束,腺组织由一些细胞壁增厚的薄壁细胞的腺体组成,与子房相对应的成多束(图5);开花与未开花略有变化,偶从实心的花柱到空心的花柱变化。柱头的表皮细胞均延长成乳头状[5]。

1.心皮,2.胚珠。图4 管花肉苁蓉子房横切面(×4)

1.维管束,2.腺体,3.表皮的角质化部分。图5 管花肉苁蓉花柱横切面(×4)
2 寄生生物学特性
2.1 种子休眠与萌发
种子休眠是长期自然选择的结果,是植物在系统发育中所形成的抵抗不良环境条件的适应性[7]。管花肉苁蓉种子休眠是其对沙漠环境长期适应的结果。近年来由于肉苁蓉需求量不断增加,野生资源已无法满足需求,开展了人工种植管花肉苁蓉的研究[8-10],但接种率普遍较低,这主要是因为管花肉苁蓉是寄生植物,其种子具有休眠特性,其萌发机制尚需进一步明确,自然条件下,需要寄主释放的信号物质刺激才能萌发[11]。故打破管花肉苁蓉种子休眠,提高其萌发率成为人工种植管花肉苁蓉的关键。
近年来,有关管花肉苁蓉种子休眠与促进萌发的研究很多。王华磊等[12-13]研究指出氟啶酮处理可打破管花肉苁蓉种子休眠,ABA可能参与管花肉苁蓉种子休眠的调控。乔学义等[14]研究认为氟啶酮能有效刺激肉苁蓉种子萌发和吸器发育。赵东平等[15,23]研究认为,酚酸处理对管花肉苁蓉种子发芽有明显影响,且与酚酸的浓度及种类有关,2,6-二甲氧基对苯醌对芽管膨大形成吸器的诱导作用显著。马东明等[16-17]研究了管花肉苁蓉种子脱离寄主条件下的离体萌发和吸器形成的形态学,认为管花肉苁蓉的种子萌发刺激物质可能为还原性氢醌类物质。杨重军等[18]认为适宜浓度的乙酰胆碱可促进肉苁蓉种子萌发,并改变了内源 IAA 和 ABA 含量。可见,氟啶酮、酚酸、2,6-二甲氧基对苯醌、氢醌类物质等对种子萌发均有促进作用。另外,闫妍等[19]研究表明,管花肉苁蓉花序不同部位的种子萌发率有所不同,花序中部蒴果种子萌发率显著高于基部和上部,原因为不同的有效积温所导致。
2.2 寄生过程和机理
明确管花肉苁蓉寄生过程是揭示其寄生关系建立的重要内容。管花肉苁蓉种子萌发时胚根从软化的内种皮种孔端伸出,接着形成芽管状物,继而发育出初生吸器,厚的带状表皮分化出若干吸根毛,在初生吸器顶端带状表皮围成窝状,表皮上的褶皱和窝内分布有乳头状突起,吸根毛和乳突是黏着寄主根、刺穿寄主皮层发育为内生吸器最终建立寄生关系的基础[20]。王华磊等[21]研究提出其寄生过程遵循种子萌发长出芽管,接触寄主根形成吸器并侵入寄主根,管花肉苁蓉幼体出现3个阶段(图6)。苗中芹等[22]研究认为管花肉苁蓉吸器侵入寄主根是一个主动过程,并有机械力的参与,吸器顶端分化出侵入细胞侵入寄主根的皮层、中柱,与寄主的木质部相连,最后完成幼苗的建成。为了更好地观察管花肉苁蓉的寄生过程,张金霞等发明了木箱-玻璃板法,这种方法可以在不伤害管花肉苁蓉种子和柽柳根系的情况下,直观地观察到管花肉苁蓉寄生的整个过程,为进一步明确管花肉苁蓉寄生过程和寄生机理提供了一种研究模型[24]。
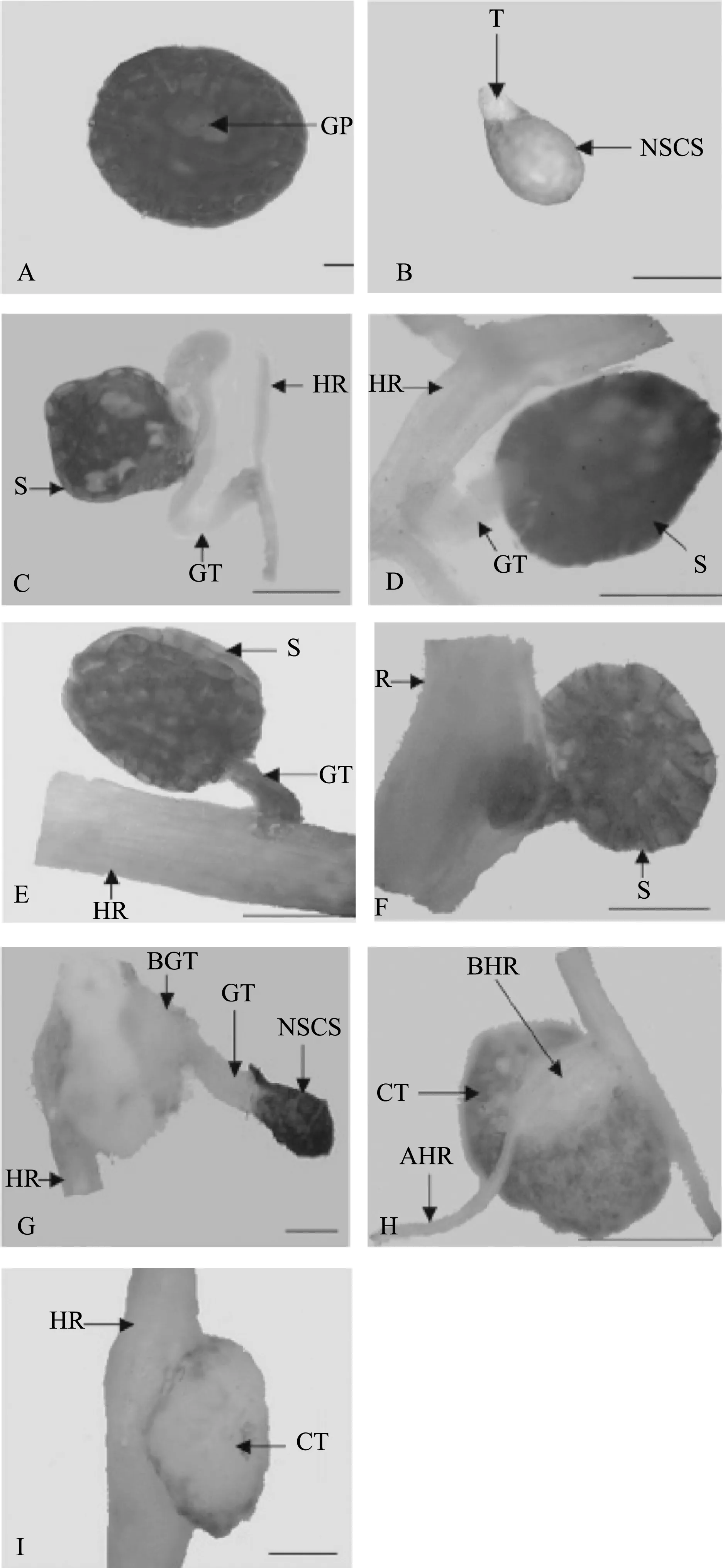
A.管花肉苁蓉种子;B.刚刚萌发的管花肉苁蓉种子;C.芽管状器官前端接触到寄主根;D.吸器侵入寄主根表皮;E.吸器前端开始膨大;F.寄主根和肉苁蓉芽管器官之间发生相互识别;G.芽管未脱落的肉苁蓉小植株;H.肉苁蓉寄生后膨大的寄主根;I.芽管脱落的肉苁蓉小植株;GP.种孔;T.小突起;S.种子;GT.芽管器官;HR.寄主根;BGT.破裂的芽管;CT.肉苁蓉小植株;NSCS.去掉种皮的种子;AHR.萎缩的寄主根;BHR.膨大的寄主根;图版中短横线均为0.5 mm。图6 管花肉苁蓉种子萌发和寄生过程
管花肉苁蓉侵入寄主柽柳根的机理研究是提高管花肉苁蓉接种率的关键问题。赵东平等[23]测定了管花肉苁蓉芽管形成过程中果胶酶、纤维素酶、木聚糖酶的活性变化,呈先增加后降低的趋势。苗东琴等[25]研究指出,管花肉苁蓉吸器侵入寄主根的过程中有果胶酶和纤维素酶的参与,离体的芽管、吸器均分泌果胶酶和纤维素酶,其含量随着芽管和吸器生长呈增加趋势。在吸器和寄主根的侵染结构界面,侵入细胞也分泌果胶酶和纤维素酶,并在吸器和寄主根相邻的胞间层、寄主细胞壁周边部位分布,导致寄主细胞间连接被解除和细胞的降解(图7)。研究结果加深了对管花肉苁蓉侵入寄主柽柳根的机理认识,但分泌降解酶所需的环境条件和调控措施仍需深入探讨。
2.3 生长环境
管花肉苁蓉生长于海拔高度约1200 m水分较充足的柽柳丛中及沙丘地,常寄生于多枝柽柳TamarixvamosissimaBunge、多花柽柳T.hohenackeriBunge、塔克拉玛干柽柳T.talamakanensisM.T.Liu和密花柽柳T.arceuthoidesBunge的根部。土壤的固相、液相和气相组成了管花肉苁蓉寄生生长的环境,影响管花肉苁蓉的生长发育状况。土壤固相决定于土壤容重和土壤密度,通常用孔隙度表示土壤固相的通气状况,不同土壤类型间存在差异[26]。杨太新等[27]研究,在沙子、沙土和壤土3种类型土壤中,管花肉苁蓉在土壤相对水分含量40% ~ 60% 时生长迅速,沙土和壤土水分含量超过80%时管花肉苁蓉出现腐烂;在沙子、沙土和壤土中,管花肉苁蓉适宜生长的固、液、气三相比分别为1∶(0.11~0.16)∶(0.52~0.57),1∶0.23∶0.57和1∶0.31∶0.67,沙土三相比1∶0.38∶0.43和壤土三相比1∶0.52∶0.46为该土壤类型管花肉苁蓉腐烂的三相比临界指标。郭玉海等[28]研究指出,黑暗、相对湿度100%、温度为20~30 ℃是管花肉苁蓉寄生的适宜环境条件。

A.未被吸器侵染的寄主根皮层细胞,Bar=10 μm;B.吸器黏附在寄主根表皮,Bar=50 μm;C.吸器黏附后,寄主根表皮层被破坏(箭头所示),Bar=10 μm;D.吸器侵入寄主根皮层,Bar=50 μm;E.寄主根皮层细胞之间连接被破坏,被吸器顶端的侵入细胞挤开一条通道(箭头所示),Bar=10 μm;F.在侵入接触面的寄主根皮层细胞被吸器细胞挤压而破碎,Bar=10 μm。Ha:管花肉苁蓉吸器;HR:寄主柽柳根。图7 果胶酶及纤维素酶对寄主根细胞形态的影响
2.4 干物质积累和成分变化
近年针对管花肉苁蓉干物质积累的研究也屡有报道。杨太新等[29-30]研究,管花肉苁蓉干物质积累呈“S”型动态变化,9月份干物质积累增加最多,生长12个月单株干物质量可达138.58 g;不同接种时间的管花肉苁蓉,随着接种时间的推迟,年内干物质积累量显著降低。杜友等[31]研究认为,多效唑具有通过抑制柽柳生长、提高柽柳光合速率和增加柽柳同化物向管花肉苁蓉的分配而提高管花肉苁蓉生物量的作用。骆翔等[32]研究认为,管花肉苁蓉寄生优化了柽柳同化物在器官间的分配,促使更多的同化产物向管花肉苁蓉分配;管花肉苁蓉呼吸可能是导致柽柳-管花肉苁蓉总干重降低的一个原因。郭东峰等研究认为,寄生肉苁蓉的柽柳与未寄生植株间水分利用效率的不同,可能是寄生肉苁蓉的柽柳植株生长速度缓慢、生物量降低的一个重要原因[33]。郭雄飞等[34]研究认为,管花肉苁蓉各部位有效成分含量的差异悬殊,有效成分主要分布在肉质茎基部。骆翔等[35]研究认为,接种有管花肉苁蓉的柽柳根随着管花肉苁蓉的生长而增粗,其初生导管有黄色粘性物质阻塞,这些阻塞物中含有糖类和脂类物质,随着管花肉苁蓉的生长而消失。
关于管花肉苁蓉活性成分变化,杨太新等[29-30]研究指出,管花肉苁蓉松果菊苷含量以生长5个月时最高,之后逐渐降低,吸器韧皮部可能是管花肉苁蓉松果菊苷的次生代谢部位。刘淑红等[36]指出管花肉苁蓉的松果菊苷和毛蕊花糖苷含量均以11月最高,12月半乳糖醇含量最高,不同部位的松果菊苷和毛蕊花糖苷含量均差异显著,基部含量最高。郭东峰等[37]研究了矿质元素在管花肉苁蓉不同部位的分布规律,结果显示,矿质元素的横向分布和纵向分布中,Na、K含量最高,其次为P和Ca;除Na外,其他几种元素含量从外层到内层逐渐降低;K含量从顶端到基部逐渐降低,P、Ca、Fe和Mn含量两端高中间低;Al含量基部最高(0.82%),Mg、Zn含量顶端最高,其他部位差别不大。
3 分子生物学及其他
3.1 遗传多样性
目前,国内外学者对于管花肉苁蓉的分子生物学研究相对较少。然而,在产业化生产时如何防止其物种的衰退,以及如何尽快恢复有限的野生居群,保存珍贵的野生种质资源,是实现其可持续利用的关键。
崔光红等[38]采用随机扩增多态性DNA方法对管花肉苁蓉的4个野生居群和2个人工栽培居群的123个个体进行了遗传多样性研究,结果显示:用10个随机引物共扩增出清晰谱带87条(图8),野生居群平均多态位点百分率27.59,各居群多态位点百分率19.54~25.29,其中安迪尔居群的最高为25.29,2个人工栽培居群的多态位点百分率仅为13.79和11.49;用UPGMA法聚类得出,4个野生居群聚为一类,2个人工栽培居群聚为一类(图9)。结果表明野生居群与人工居群间已发生了遗传分化,栽培管花肉苁蓉遗传背景单一,故对野生管花肉苁蓉的保护十分重要。

图8 引物S1500的扩增效果
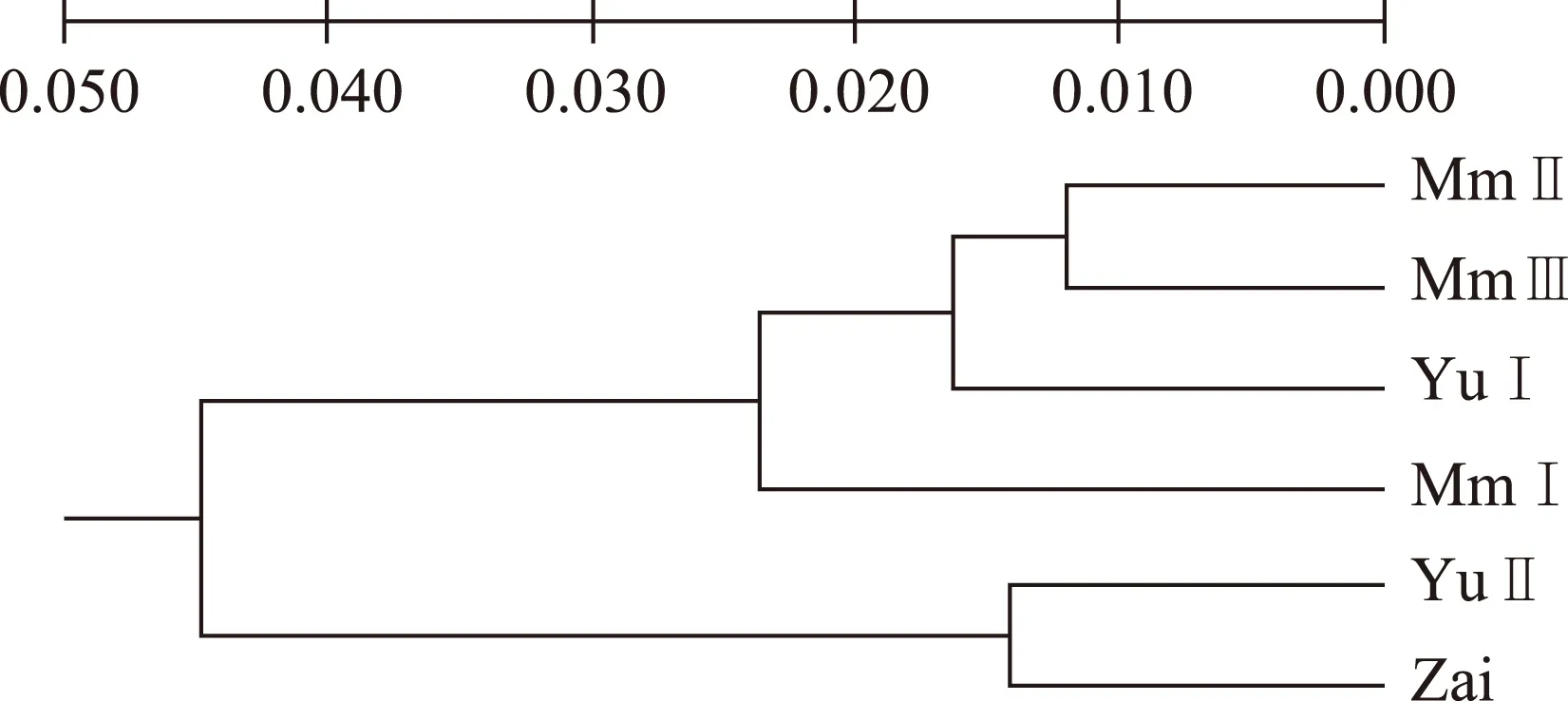
图9 管花肉苁蓉居群间的Nei,s遗传一致度聚类图
3.2 RAPD分析
王长林等[39]用筛选出来的16个10-mer寡聚核苷酸引物对寄生于8种柽柳上的管花肉苁蓉遗传物质进行了RAPD分析,寄生于8种不同柽柳上的管花肉苁蓉遗传多态性为66.7%,管花肉苁蓉不同居群之间存在有较丰富的遗传多样性,其中以刚毛柽柳和中国柽柳上寄生的管花肉苁蓉最为特别。结果表明,生长区域比寄主柽柳对管花肉苁蓉遗传物质的影响较为明显,异地引种对保持管花肉苁蓉较高的遗传多样性有利,管花肉苁蓉种内居群间遗传物质差异远小于肉苁蓉属植物种间的遗传差异。
3.3 试管苗培养
马东明等[40]用去果皮的管花肉苁蓉种子对柽柳试管苗进行接种,建立管花肉苁蓉种子与柽柳的离体接种体系,体视显微镜观察接种情况表明,通过寄主柽柳的离体快速繁殖得到的试管苗与管花肉苁蓉种子的共培养能够建立管花肉苁蓉-柽柳接种复合体(图10),为研究柽柳-管花肉苁蓉相互关系提供了有效的实验体系。

A.生根的柽柳与管花肉苁蓉种子的共培养;B.管花肉苁蓉种子的芽管;C.管花肉苁蓉种子的初生吸器;D,E.瘤状物的形成;F.萌发种子形成的愈伤组织;G,H.种子成功侵染寄主根;I.瘤状物虽与寄主接触,但未能与寄主成功建立寄生关系。GT.芽管;PH.初生吸器;T.瘤状物;HR.寄主根;P.寄生物。图10 管花肉苁蓉与柽柳试管苗的离体接种
4 展望
关于管花肉苁蓉植物学形态、种子萌发、吸器形成和寄生过程的形态学研究已多见报道,然而决定管花肉苁蓉种子萌发、专性寄生的信号物质及寄生关系建立的机理还有待进一步深入探讨。如何建立适宜的管花肉苁蓉寄生环境,提高其田间种子萌发率和接种率仍是发展人工栽培的重点。管花肉苁蓉分子生物学研究为其濒危资源保护和种质资源创新提供了新思路。今后应将保护管花肉苁蓉野生资源和发展人工栽培相结合,加强管花肉苁蓉寄生机理的理论探讨和提高田间接种率的技术研究,探求人工栽培实现高产优质的调控途径,合理开发利用管花肉苁蓉资源。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:126.
[2] 汤小蕾,孙平飞.管花肉苁蓉的研究进展[J].中医药导报,2009,15(5):101-104.
[3] 中国植物志编辑委员会.中国植物志:第69卷[M].北京:科学出版社,1990
[4] 蔡少青,李胜华.常用中药材品种整理和质量研究:第四册[M].北京:北京医科大学出版社,2001:27-28.
[5] 付桂芳,陈敏,崔光红,等.荒漠肉苁蓉和管花肉苁蓉的组织结构比较研究[J].中华中医药杂志,2007,22(12):840-843.
[6] 李志军,吕春霞.管花肉苁蓉异常结构的发育解剖学研究.西北植物学报,1997,17(5):118-122.
[7] 王忠.植物生理学[M],4版.北京:中国农业出版社,2002:415.
[8] 王学先.肉苁蓉人工栽培技术[J].新疆农业科技,2002,(1):13.
[9] 刘永博,杨黎明.肉苁蓉栽培与管理[J].特种经济动植物,2001,(8):22.
[10] 徐胜利,陈小青.南疆肉苁蓉人工栽培新技术[J].新疆农业科技,2002,(1):16.
[11] Press MC,Graves JD.Paras it ic plants[ M ].New York:Chap-man Hall,1995:18.
[12] 王华磊,郭玉海,翟志席,等.氟啶酮对管花肉苁蓉种子萌发影响的研究[J].中国中药 杂志,2006,31(19):1638-1639.
[13] Jing MY,Zhang JH.Abscisic acid and antioxidant defensein plantcells[ J].Acta Bot Sin,2004,46(1):1.
[14] 乔学义,王华磊,郭玉海.一种刺激肉苁蓉种子萌发和吸器发育的方法[J].植物学通报,2007,24(4):521-525.
[15] 赵东平,郭玉海.不同酚酸处理对管花肉苁蓉种子发芽的影响[J].北方园艺,2011(12):159-160.
[16] 马东明,徐淑莲,翟志席,等.寄生药用植物管花肉苁蓉种子的离体萌发与吸器形成的形态学研究[J].植物学通报,2005,22(1):39-43.
[17] 马东明,杨太新,翟志席,等.一种简易的研究寄主中国柽柳刺激管花肉苁蓉种子萌发的技术[J].植物生理学通讯,2005,41(5):662-664.
[18] 杨重军,张秀省,庄志坤.乙酰胆碱对管花肉苁蓉种子萌发及其内源IAA 和ABA 含量的影响[J].植物生理学通讯,2007,43(2):295-297.
[19] 闫妍,郭玉海.管花肉苁蓉花序不同部位种子质量与有效积温的关系[J].中国农学通报,2009,25(09):70-73.
[20] 马东明,徐淑莲,翟志席,等.寄生药用植物管花肉苁蓉种子的离体萌发与吸器形成的形态学研究[J].植物学通报,2005,22(1):39-43.
[21] 王华磊,杨太新,杨重军,等.管花肉苁蓉种子萌发和寄生过程的形态学研究[J].中国中药杂志,2005,30(23):1812-1814.
[22] 苗中芹,刘海虹,贾君镇,等.管花肉苁蓉幼苗发育解剖学研究[J].中国农业大学学报,2014,19(2):131-136.
[23] 赵东平,郭玉海,朱艳霞,等.吸器诱导因子对管花肉苁蓉吸器形成的影响[J].中国农业大学学报,2011,16(4):38-42.
[24] 张金霞,王华磊,郭玉海,等.一种简易观察管花肉苁蓉寄生过程的方法[J].江苏农业科学,2014,42(1):211-212.
[25] 苗东琴,赵东平,郭玉海.果胶酶和纤维素酶参与管花肉苁蓉侵入寄主根的研究[J].中国农业大学学报,2014,19(6):88-94.
[26] 林大仪.土壤学[M].北京:中国林业出版社,2002,96.
[27] 杨太新,王华磊,郭玉海,等.华北平原管花肉苁蓉寄生环境研究[J].中国中药杂志,2005,30(17):1380-1383.
[28] 郭玉海,张金霞,翟志席.管花肉苁蓉寄生实验体系的研究[J].中国药学杂志,2011,46(12):910-912.
[29] 杨太新,卢月霞,郭玉海,等.华北平原管花肉苁蓉干物质积累和松果菊苷含量动态变化研究[J].中国中药杂志,2006,31(16):1317-1320.
[30] 杨太新,张喜焕,蔡景竹.管花肉苁蓉松果菊苷次生代谢部位研究[J].中国中药杂志,2007,32(24):2591-2594.
[31] 杜友,魏民,马召,等.多效唑对柽柳和管花肉苁蓉物质分配的调控作用[J].中国农业大学学报,2013,18(6):107-112.
[32] 骆翔,翟志席,郭玉海,等.管花肉苁蓉对柽柳器官同化物分配的优化[J].中国农业大学学报,2011,16(4):43-47.
[33] 郭东锋,郭玉海,黄 勇,等.管花肉苁蓉的寄生对柽柳光合特性的影响[J].安徽农业科学,2009,37(23):11293-11295.
[34] 郭雄飞,吴亚东,倪慧,等.管花肉苁蓉不同部位有效成分含量的考察比较[J].新疆医科大学学报,35(1):49-50.
[35] 骆翔,朱艳霞,赵东平,等.柽柳根对管花肉苁蓉寄生的反应[J].植物生理学通讯,2010,46(12):1211-1214.
[36] 刘淑红.中国柽柳光和特性及其与管花肉苁蓉源库关系的研究[D].河北农业大学,2010.
[37] 郭东锋,郭玉海,黄 勇,等.管花肉苁蓉不同部位主要矿质元素含量研究[J].安徽农业科学,2009,37(22):10494-10495,10499.
[38] 崔光红,陈敏,黄璐琦,等.野生与栽培管花肉苁蓉的遗传多样性分析[J].中国中药杂志,2006,31(15):1227-1230.
[39] 王长林,郭玉海,屠鹏飞,等.不同种柽柳上寄生的管花肉苁蓉 RAPD 分析[J].中国中药杂志,2009,34(3):264-268.
[40] 马东明.管花肉从蓉种子的萌发诱导及离体接种的研究[D].中国农业大学,2005.
ProcessinginBiologyResearchofCistanchetubulosa(Schenk)R.Wight
LIUGuoku1,TUPengfei2,YANGTaixin1*,GAOQin1
(1.AgronomyCollege,HebeiAgriculturalUniversity/CropGrowthRegulationLaboratoryofHebei,Baoding071001,China;2.SchoolofPharmaceuticalSciences,PekingUniversity,Beijing100191,China)
Cistanchetubulosa(Schenk)R.Wight is an original plant of the traditional Chinese medicine named Roucongrong and it is suitable to be cultivated in large-scale production.In order to promote research and production on high and stable yield cultivation technique ofC.tubulosa,this paper made a review on the botany morphological characters,parasitic biological characters and molecular biology ofC.tubulosa,and the future research direction was put forward.
Cistanchetubulosa(Schenk)R.Wight;botany morphological characters;parasitic biological characters;molecular biology
2015-03-15)
国家科技惠民计划项目(2012GS650101);河北省现代农业产业技术体系中药材创新团队项目
*
杨太新,教授,研究方向:药用植物种质资源和规范化栽培;E-mail:yangtaixin@126.com
10.13313/j.issn.1673-4890.2015.4.022
