果胶酶解法提取陈皮中橙皮苷的工艺研究△
2015-09-25许玲玲杨晓东李群力陈贵颖盛柳青陈菲蔡芸芸
许玲玲,杨晓东,李群力,陈贵颖,盛柳青,陈菲,蔡芸芸
(金华职业技术学院 医学院,浙江 金华 321007)
·中药工业·
果胶酶解法提取陈皮中橙皮苷的工艺研究△
许玲玲,杨晓东*,李群力,陈贵颖,盛柳青,陈菲,蔡芸芸
(金华职业技术学院 医学院,浙江 金华 321007)
目的:研究酶解法提取陈皮中橙皮苷的工艺条件。方法:在单因素试验的基础上,采用响应面分析法对提取工艺进行优化。结果:最佳工艺条件液料比为40∶1(mL·g-1);果胶酶用量为3.2%;pH值为3.0;酶解温度为45 ℃;酶解时间为2.3 h。在此条件下,橙皮苷提取率理论值为5.45%,实测值为5.40%。结论:酶解法提取橙皮苷操作简单、提取率高,有利于企业大生产,但存在着提取时间长、溶剂用量大等缺点。
酶解法;响应面分析;陈皮;橙皮苷;提取
橙皮苷具有降低血管脆性、降血压、抗过敏、抑制肿瘤、抗氧化和清除自由基等作用[1-3],在临床上用于心血管系统疾病的辅助治疗[4],也可用于医药工业中制药的原料,橙皮苷还作为天然抗氧化剂用于食品和化妆品行业[5]。
从陈皮中提取橙皮苷通常采用热水提取、醇回流提取、碱提酸沉等方法[6-7],这些方法都是采用化学溶剂浸润、溶解药材中的有效成分,虽然操作简单,但提取不完全,会造成一些橙皮苷残留在果渣里,使用的化学试剂也易造成环境污染[8]。近年来有报道[9-10]微波和超声波辅助提取橙皮苷,虽然这两种方法提取时间短,但超声法噪音很大,微波法有辐射,它们对提取设备有很高的要求,这在一定程度上限制了其在企业大生产中的应用。
为了探索一种操作简单、产率高,有利于企业大生产的橙皮苷提取新方法,我们采用酶解法破坏药材细胞壁和细胞间的果胶,使橙皮苷充分溶解出来,提高橙皮苷的提取率。先通过单因素试验考察酶解法各因素对橙皮苷提取率的影响,再采用响应面分析法对酶解工艺进行优化,得到最佳工艺。
1 材料与仪器
1.1 材料
陈皮(金华市三溪堂国药馆,四川产);果胶酶(天津市诺奥科技发展有限公司);橙皮苷对照品(中国食品药品鉴定研究院,批号:110721-201115);甲醇为色谱纯;水为纯净水;其他试剂均为分析纯。
1.2 仪器
SP-2012UV PC紫外可见分光光度计(上海光谱仪器有限公司);Waters高效液相色谱仪(2487紫外分光检测器);1004 型电子天平(上海天平仪器厂);HH-6数显恒温水浴锅(国华电器有限公司)。
2 方法
2.1 酶解法提取陈皮中的橙皮苷
取适量陈皮粗粉置于锥形瓶中,加入蒸馏水和酶,调节pH值,置于恒温水浴箱中酶解一段时间,取出,放冷过滤,得橙皮苷提取液。
2.1.1 单因素试验考察酶解法影响因素 通过单因素试验,分别考察酶的用量、酶解时间、酶解温度、pH值、液料比等因素对橙皮苷提取率的影响,每个处理重复3次,取平均值。
2.1.2 响应面分析法优化提取工艺 在单因素试验的基础上,根据Box-Behnken中心组合试验设计原理,选取对橙皮苷提取率影响较大的3个因素,进行中心组合试验设计,做多组试验。然后采用Design-Expert 8.0.5.0程序,对数据处理,进行响应面分析优化,最终得到优化工艺参数。
2.2 橙皮苷含量测定方法
2.2.1 对照品溶液的配制 精确称取橙皮苷对照品10.1 mg,加入适量甲醇,超声溶解,用甲醇定容到25 mL,配制成质量浓度为0.404 mg·mL-1的橙皮苷对照品溶液。
2.2.2 陈皮样品液的制备 将酶解工艺提取所得的溶液,稀释适当倍数,用0.45 μm微孔滤膜过滤,即得。
2.2.3 检测波长的确定 以空白溶剂甲醇为参比溶液,通过紫外可见分光光度计对橙皮苷对照品溶液进行扫描(200~400 nm),同时,对陈皮样品溶液进行光谱扫描。结果显示,橙皮苷对照品溶液和陈皮样品液都在285 nm处有强吸收峰,因此取285 nm为检测波长。
2.2.4 色谱条件 色谱柱:Waters Symmetry C18(250 mm×4.6 mm,5μm);流动相:甲醇-2%冰醋酸溶液(34∶66);流速:0.5 mL·min-1;检测波长:285 nm;温度为室温;进样量:20 μL;橙皮苷保留时间为5.1 min。
2.2.5 标准曲线的制备 分别精密吸取橙皮苷对照品溶液1、2、3、4、5 mL于10 mL的容量瓶中,用甲醇定容,配成质量浓度分别为40.4、80.8、121.2、161.6、202 μg·mL-1的一系列对照品溶液,进行HPLC测定。在285 nm处测峰面积,以橙皮苷对照品溶液的浓度X(μg·mL-1)为横坐标,以其峰面积Y为纵坐标绘制标准曲线,得回归方程:Y=185 220X-25 642,r=0.999,线性范围为40.4~202 μg·mL-1。橙皮苷对照品溶液的HPLC图见图1。

图1 橙皮苷对照品溶液的HPLC图
2.2.6 精密度试验 精密吸取陈皮样品溶液20 μL,进样,测定。连续重复5次,计算橙皮苷峰面积的RSD为1.15%(n=5)。表明本法精密度良好。陈皮样品溶液HPLC图见图2。
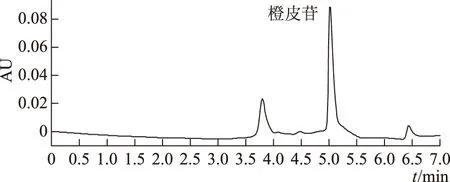
图2 陈皮样品溶液的HPLC图
2.2.7 稳定性试验 精密吸取陈皮样品溶液20 μL,分别在0、2、4、8、12、24 h进样,测定峰面积,计算橙皮苷峰面积的RSD为2.21%(n=5)。表明制备的陈皮样品溶液在24 h内稳定。
2.2.8 重复性试验 精密称取陈皮粗粉20 g,5份,加蒸馏水200 mL,加入0.6 g果胶酶,溶液pH值为5.0,置于45 ℃的恒温水浴箱中,酶解4 h。然后升温到100 ℃,煮沸20 min灭酶,取出,放冷过滤。滤液稀释后,进样测定,计算橙皮苷的含量,RSD为4.85%(n=5),表明重复性较好。
2.2.9 加样回收试验 精密称取陈皮粗粉20 g,5份,置于锥形瓶中,分别精密加入一定量的橙皮苷对照品溶液,按照2.2.8项下酶解方法处理,进样测定,计算橙皮苷的回收率。测得平均回收率95.58%,RSD为4.33%(n=5),表明该法测定橙皮苷准确度高。
3 结果与分析
3.1 单因素试验结果与分析
3.1.1 果胶酶用量对橙皮苷提取率的影响 称取陈皮粗粉各20.00 g,加水200 mL,即液料比10∶1(mL·g-1),加果胶酶的用量分别为陈皮药材的0%、0.5%、0.75%、1.50%、3.00%、4.50%、6.00%,pH值为5.0,置于45 ℃的恒温水浴箱中,酶解4 h。然后升温到100 ℃,煮沸20 min灭酶,取出,放冷过滤,滤液稀释后,测定峰面积,计算含量。结果见图3。

图3 果胶酶用量对橙皮苷提取率的影响
由图可以看出,仅用水提取陈皮中的橙皮苷时,提取率很低,当加入果胶酶后,提取率明显提高。当加入果胶酶的用量是3%时,提取率最高。
3.1.2 酶解温度对橙皮苷提取率的影响 称取陈皮粗粉各20.00 g,加水使液料比为10∶1(mL·g-1),加入果胶酶3%,pH值为5.0,分别置于40、45、50、55、60、65 ℃的恒温水浴箱中,酶解4 h。然后灭酶,过滤,测定含量。结果见图4。
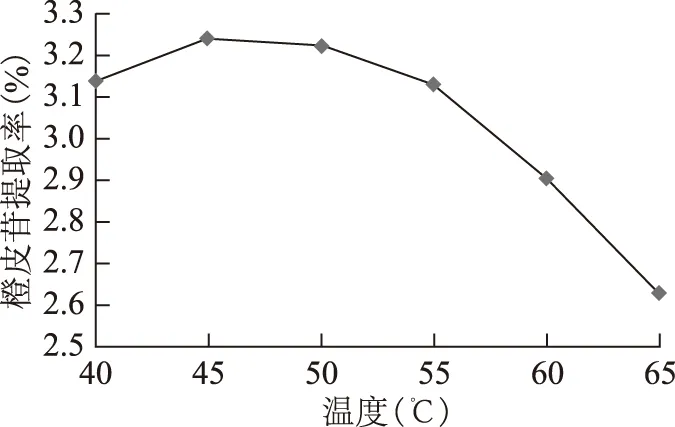
图4 酶解温度对橙皮苷提取率的影响
由图可以看出,果胶酶对温度比较敏感。当酶解温度达到45 ℃,橙皮苷提取率达到最高,当温度继续升高时,橙皮苷提取率逐渐下降。这是由于温度过高会影响果胶酶的活性。因此,酶解适宜温度为45 ℃。
3.1.3 酶解时间对橙皮苷提取率的影响 称取陈皮粗粉各20.00 g,加水使液料比为10∶1(mL·g-1),加入果胶酶3%,pH值为5.0,45 ℃条件下,分别酶解1、2、3、4、5 h。然后灭酶,过滤,测定含量。结果见图5。

图5 酶解时间对橙皮苷提取率的影响
由图可以看出,酶解时间太短,酶解不完全。当酶解时间为2 h时,橙皮苷提取率最高,延长时间,提取率下降,增加了劳动成本。因此,酶解时间2 h适宜。
3.1.4 液料比对橙皮苷提取率的影响 称取陈皮粗粉各20.00 g,加水使液料比分别为5∶1、10∶1、20∶1、30∶1、40∶1、50∶1(mL·g-1),加入果胶酶3%,pH值为5.0,置于45 ℃条件下,酶解2 h。然后灭酶,过滤,测定含量。结果见图6。
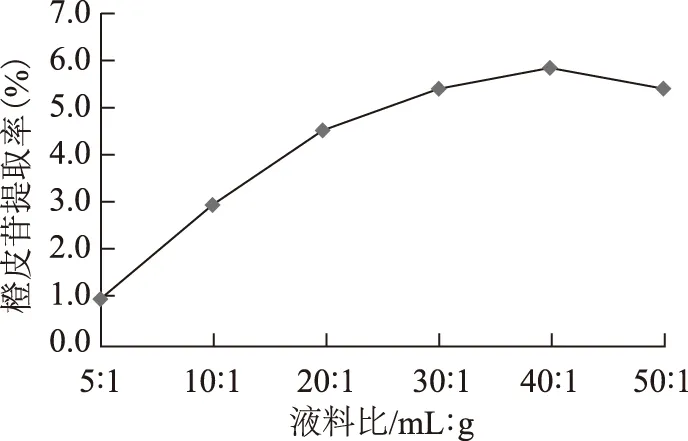
图6 液料比对橙皮苷提取率的影响
由图可以看出,水的用量对橙皮苷的提取有很大影响。加水多,增加了药材细胞内外浓度差,有利于橙皮苷的溶出,但加水量太多,不利于药液的浓缩。
3.1.5 pH值对橙皮苷提取率的影响 称取陈皮粗粉各20.00 g,加水使液料比10∶1(mL·g-1),加入果胶酶3%,调节溶液的pH值分别为2.0、3.0、4.0、5.0、6.0,置于45 ℃条件下,酶解2 h。然后灭酶,过滤,测定含量。结果见图7。
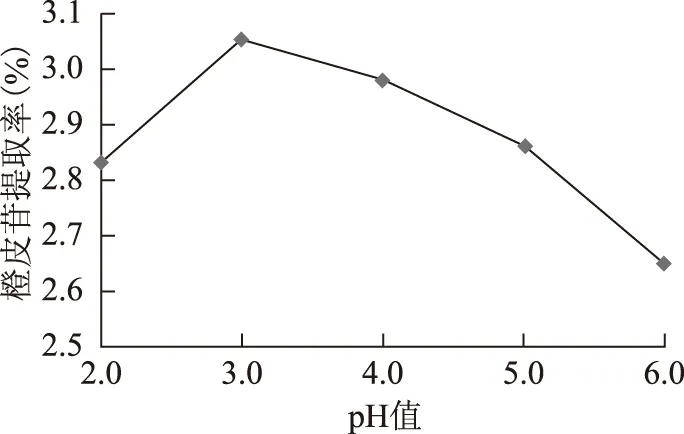
图7 pH值对橙皮苷提取率的影响
由图可以看出,pH值对酶的活性有较大影响,果胶酶pH 值为3.0的条件下最为适宜,橙皮苷提取率最高,当pH值继续增大,橙皮苷提取率反而下降。
3.2 响应面分析法优化提取工艺
3.2.1 响应面试验设计方案 根据响应面中心组合试验设计,研究各酶解因素对橙皮苷提取率的影响,从而得到酶解的最佳条件。在酶解温度为45 ℃,酶解液pH值为3.0的条件下,选取果胶酶用量(X1)、液料比(X2)和酶解时间(X3)这3个因素为自变量,橙皮苷的提取率为响应值。试验因素与水平的取值见表1。
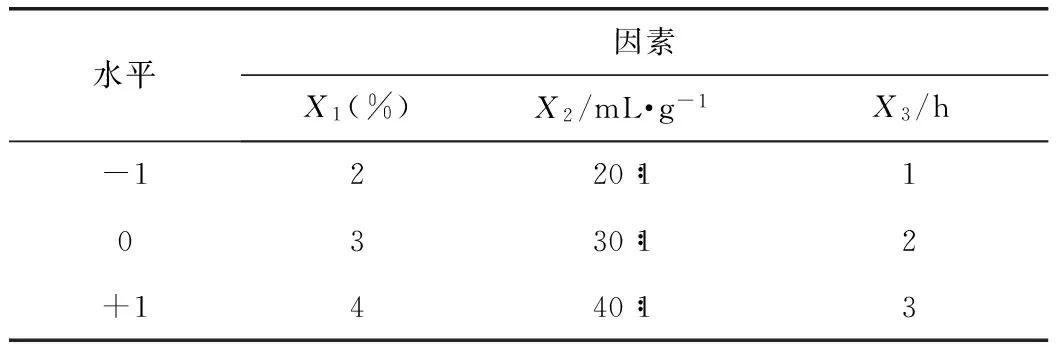
表1 响应面分析试验因素和水平
通过Box-Behnken中心组合试验设计原理进行设计,响应面试验设计方案及结果见表2。试验号1、2、4、8、17为5个中心试验,用来估计试验误差,其余为析因试验。
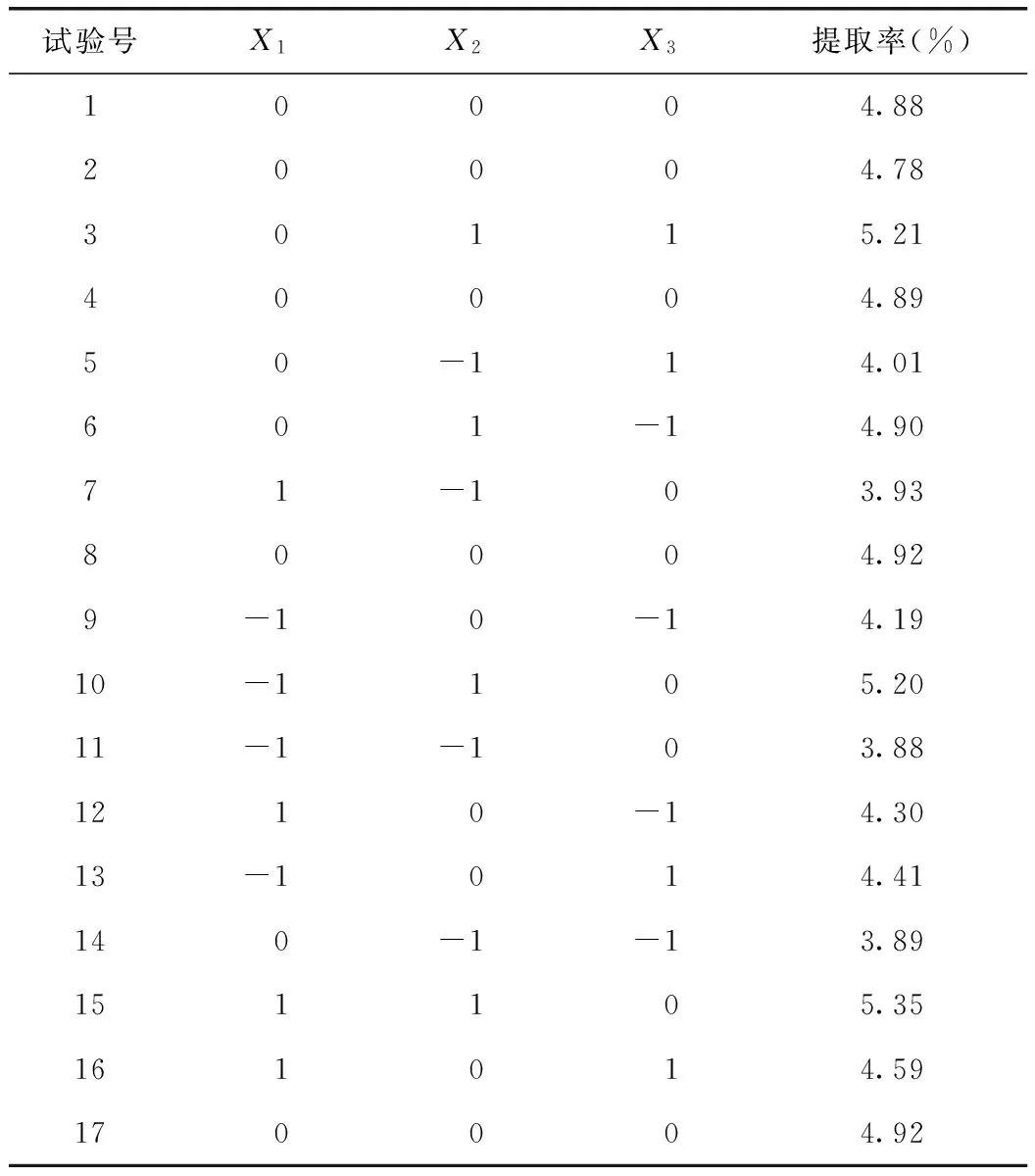
表2 响应面试验方案设计及结果
3.2.2 模型的建立及分析 对响应值与各因素进行二次线性回归拟合,得到回归方程:Y=-0.56+1.205 25X1+0.092 275X2+1.108 5X3+0.002 5X1X2+0.017 5X1X3+0.004 75X2X3-0.209X12-0.000 79X22-0.296 5X32,r=0.987 1。式子中:Y表示橙皮苷的提取率(%),X1表示果胶酶用量(%),X2表示液料比(mL·g-1),X3表示酶解时间(h)。
响应面回归模型的显著性检验和方差分析见表3,根据方差分析结果,该Quadratic回归模型的P<0.000 1,差异有统计学意义,说明与实际试验拟合好。模型的相关系数r为0.987 1,说明因变量和自变量线性关系显著。失拟项的P为0.119,P>0.05,差异无统计学意义,说明试验误差小,回归模型可以较好地描述各因素与响应值之间的真实关系,故可以用该回归方程代替实际试验对试验结果的分析和预测。由表3可以看出,在总的作用因素中,一次项和平方项的影响较大,而交互项的影响较小。对橙皮苷的提取率影响因素顺序依次为液料比>酶解时间>酶用量。

表3 方差分析表
注:**表示差异有统计学意义(P<0.01)。
响应面图也可以直观地反映各因素对响应值的影响。见图8~10。等高线的形状可反映出交互效应的强弱。由图8可看出,酶解时间和酶用量等高线近似圆形,可知他们之间的相互作用对橙皮苷提取率的影响很小。图9、图10表明,液料比对橙皮苷的提取率影响最为突出,表现为曲线很陡峭。
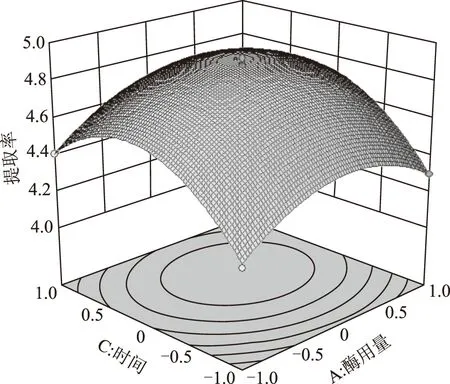
图8 时间和酶用量对提取率的响应面图
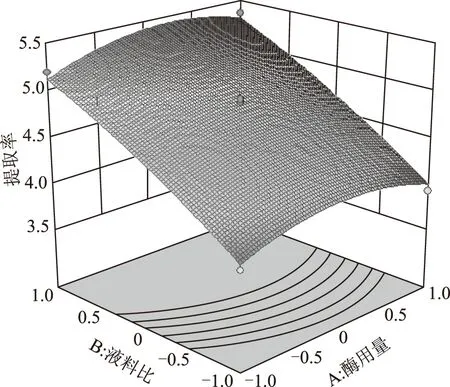
图9 液料比和酶用量对提取率的响应面图
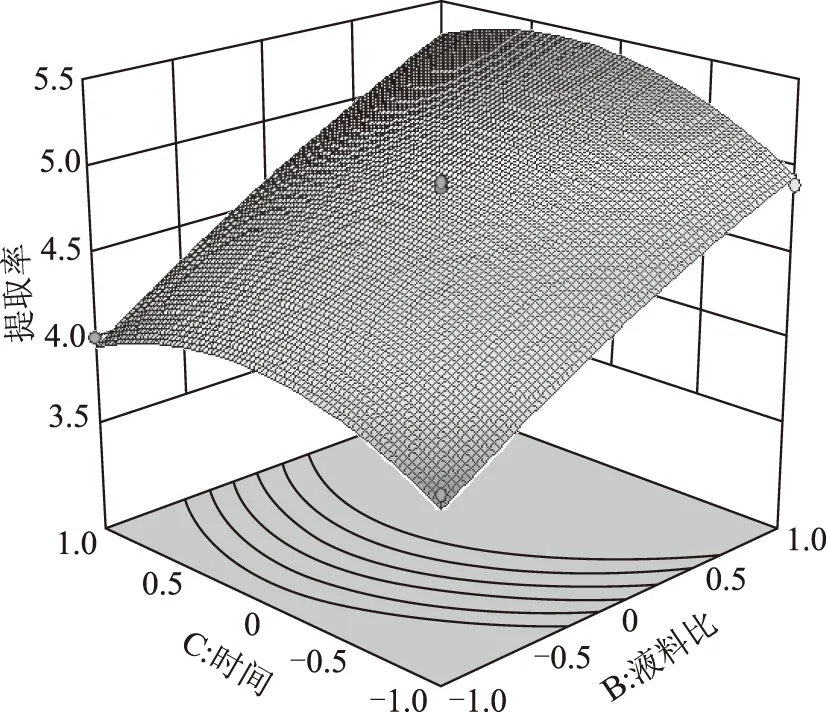
图10 液料比和时间对提取率的响应面图
3.2.3 响应面分析优化及验证性试验 采用Design-Expert 8.0.5.0程序进行响应面分析优化,理论上可得橙皮苷最佳提取工艺条件:果胶酶的用量为3.22%;液料比为40∶1(mL·g-1);酶解时间为2.29 h,提取率为5.45%。考虑到实际操作的简便,修正最佳提取工艺条件:果胶酶的用量为3.2%;酶解时间液料比为40∶1(mL·g-1);酶解时间为2.3 h。根据以上条件进行橙皮苷的提取,试验重复3次,橙皮苷的实际提取率为5.40%,RSD为3.57%,与理论值比较接近。表明响应面分析法所得的优化条件真实可靠,具有实用价值。
4 讨论
因柑橘果皮富含果胶,果胶存在于相邻细胞壁间的胞间层中,起着将细胞粘在一起的作用。通过果胶酶酶解,能有效地破坏细胞间的果胶,使橙皮苷充分地溶解出来。橙皮苷的含量受陈皮药材的产地和采收季节的影响,本课题研究的陈皮药材是四川产的。通过果胶酶解法,测得陈皮中橙皮苷的提取率为5.40%。据相关报道[9-10],采用甲醇为溶剂,通过超声法提取川陈皮中橙皮苷,测得其提取率分别为4.89%、4.93%。酶解法与文献报道的超声提取法相比,提取率提高了约10%。酶解法在橙皮苷提取率方面没有大幅度提高,可能与果胶酶的质量和活度有关。
根据研究结果,果胶酶用量比较大,原因可能是购买的果胶酶活力较小且柑橘果皮果胶含量较高。我们尝试用纤维素酶来提取橙皮苷,但研究发现,其酶解效果不如果胶酶显著。
通过单因素试验和响应面分析,得到橙皮苷的最佳提取工艺条件:陈皮粗粉适量,加水使其液料比为40∶1(mL·g-1),加入果胶酶的量为药材的3.2%,调节溶液的pH值为3.0,置于45 ℃恒温条件下酶解2.3 h。
酶解法提取橙皮苷能耗小,无需特殊设备,所用溶剂环保、经济、操作简单、生产安全性好,有利于企业大生产,但存在着溶剂用量大及提取时间长等缺点。为避免这些弊端,可考虑多次酶解法,或酶解法与其他提取方法相结合。
[1] 刘雅丽,陈思佳,张晨,等.橙皮苷、柠檬烯及茶多酚清除自由基能力的对比研究[J].口腔医学研究,2015,31(1):11-14.
[2] 黄芳,周宏,陈华,等.橘皮中橙皮苷提取的优化及其对羟自由基清除作用[J].食品与发酵工业,2012,38(5):223-227.
[3] 邹淑君,余子惠,许树军,等.橙皮苷及橙皮素清除自由基活性的研究[J].中医药学报,2013,41(1):65-68.
[4] 刘学仁,张莹,林志群.橙皮苷和橙皮素生物活性的研究进展[J].中国新药杂志,2011,20(4):331-333.
[5] 钱俊臻,王伯初.橙皮苷的药理作用研究进展[J].天然产物研究与开发,2010,22:176-180.
[6] 蔡庆顺,钟小群,余华.陈皮不同提取工艺橙皮苷提取率分析[J].中成药,2010,32(6):1067-1070.
[7] 齐兵,何志勇,秦肪,等.陈皮中橙皮苷的提取与纯化工艺研究[J].食品工业科技,2012,33(24):343-346.
[8] 姚雪莲,孙涛,廖夫生,等.高效液相法测定陈皮药渣中橙皮苷含量[J].中国药师,2012,15(2):207-208.
[9] 禤雪梅.HPLC法测定不同产地药材陈皮中橙皮苷的含量[J].北方药学,2015,12(2):9-12.
[10] 吴愫青,叶莹,张俊.HPLC测定不同产地陈皮橙皮苷的含量[J].中国现代中药,2008,10(8):20-22.
OptimizationofExtractionofEsperidinfromTangerinePeelwithEnzymaticMethod
XULingling,YANGXiaodong*,LIQunli,CHENGuiying,SHENGLiuqing,CHENFei,CAIYunyun
(MedicalCollegeofJinhuaProfessionandTechnologyCollege,JinhuaZhangjiang,321007)
Objective:To research extraction process of esperidin from tangerine peel by enzymatic method.Methods:On the basis of single factor test,the optimum condition of extraction was conducted through response surface methodology.Results:The optimum conditions were as followed:ratio of liquor to material 40∶1(mL·g-1),pectinase 3.2%,pH 3.0,enzyme digestion temperature of 45 ℃ and enzymolysis time of 2.3 h.Under these conditions,the extraction rate was 5.45%,actually 5.40%.Conclusion:The enzymatic method has advantages in simple operation,higher extraction rate and large scale production.But it is time-consuming and requires large amount of solvents.
Enzymatic methods;response surface methodology;tangerine peel;hesperidin;extraction
10.13313/j.issn.1673-4890.2015.11.020
2015-03-06)
浙江省大学生科技创新项目(2013R465005);浙江省科技厅分析测试项目(2014C37057)
*
杨晓东,教授,研究方向:天然产物的研究与开发;E-mail:jhyxd@163.com
