黄曲霉侵染对黄芪质量的影响及其储藏条件研究△
2015-09-25胡一晨孔维军刘秋桃刘洪美赵钢杨美华
胡一晨,孔维军,刘秋桃,刘洪美,赵钢,杨美华*
(1.成都大学生物工程学院,成都 610106; 2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
·专题·
黄曲霉侵染对黄芪质量的影响及其储藏条件研究△
胡一晨1,2,孔维军2,刘秋桃2,刘洪美2,赵钢1,杨美华2*
(1.成都大学生物工程学院,成都 610106; 2.中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
目的:从黄曲霉侵染对黄芪药材有效成分影响的角度评价真菌污染过程对黄芪质量的影响,并考察黄芪最佳储藏条件。方法:采用人工侵染接种的方法使黄芪染菌,通过采用Q-TOF HDMS质谱仪建立黄芪中9种有效成分(毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪甲苷和异黄芪皂苷Ⅰ)的同步分析谱,对比研究染菌前后有效成分的变化趋势。随后,采用中心组合设计—响应面法考察储藏环境温度和湿度对黄芪中真菌毒素产生的影响,优化最佳储藏条件。结果:在黄芪药材上接种曲霉孢子培养10 d后,黄芪霉变严重,其中黄酮苷成分显著减少,而黄酮苷元和皂苷成分变化较小。通过建立的温湿度与黄曲霉毒素含量相关性模型以及响应面曲线图,优化得到避免黄芪药材染菌产毒的最佳储藏环境为温度低于20 ℃,湿度小于85%。结论:本研究首次探索了黄曲霉染菌过程对黄芪药材质量的影响,并筛选出黄芪最佳储藏条件,为建立中药储藏过程防霉变体系提供依据。
黄芪;储藏;黄曲霉毒素;有效成分;响应面
黄曲霉菌(Aspergillusflavus)是一类广泛存在于自然界中的常见真菌,其代谢产物黄曲霉毒素(Aflatoxin,AFT)因其致癌、致畸、致突变性,已成为国民健康的重要威胁[1]。近年来,中药材中AFT污染问题已引起了越来越多的关注[2-3]。中药材中往往含有多糖、脂肪油、蛋白质等营养物质,这些成分都可能成为黄曲霉菌的生长和代谢过程的能量物质,若储藏条件较差,温湿度控制不当,极易引起黄曲霉毒素的污染。现有的中药质量评价标准往往只考虑中药材中黄曲霉毒素的含量,而未涉及真菌和真菌毒素污染对药材成分的影响。因此,寻找适宜于中药材的储藏温湿度,探索黄曲霉菌侵染对药材内在质量的变化迫在眉睫。
黄芪以其益气固表、利水消肿、脱毒生肌等功效被世人广泛应用[4-5]。由于黄芪中富含黄芪多糖、黄芪皂苷等有效成分[6],为黄曲霉菌提供了得天独厚的生存环境,若储藏环境的温湿度适宜则极易被黄曲霉菌侵染,从而污染黄曲霉毒素。因此,本研究将从黄曲霉菌污染对黄芪内在质量的影响入手,探究黄芪在受到黄曲霉菌污染后其化学成分(三萜皂苷和黄酮类化合物:黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪甲苷、黄芪皂苷Ⅲ、异黄芪皂苷Ⅰ、毛蕊异黄酮葡萄糖苷、芒柄花苷、毛蕊异黄酮、芒柄花素)的变化规律,为全面、深入、系统的综合评价黄芪的内在质量提供实验基础。同时运用响应面法寻找适宜储藏黄芪药材的温湿度,以期以黄芪为例来考察适宜的中药材储藏环境。
1 仪器与材料
Waters Q-TOF HDMS质谱仪(Waters,USA);KQ-500超声仪(昆山市超声仪器有限公司);甲醇和乙腈(色谱纯,美国Honeywell公司);QTRAP®5500质谱(AB SCIEX公司);LC-30AT超高效液相色谱仪(日本岛津公司)。
1.5 μm玻璃纤维滤纸(美国VICAM公司);黄曲霉毒素G2、G1、B2和B1混合标准品溶液(黄曲霉毒素G2、G1、B2、B1浓度分别为0.5、2.0、0.5、2.0 μg·mL-1,新加坡Pribolab公司);甲醇和乙腈(色谱纯,美国Honeywell公司)。黄曲霉菌冻干粉(Aspergillusflavus,CGMCC 3.4410)购自于中国普通微生物菌种保藏管理中心。察氏培养基(Salt Czapek Dox Agar,SCDA)购买于北京奥博星生物技术有限公司。
黄芪甲苷(110781-200613,98.0%),毛蕊异黄酮葡萄糖苷(111920-201203,97.3%)和芒柄花素(111703-200603,98.0%),购于中国食品药品检定研究院(北京)。芒柄花苷(CHB-M-009,HPLC≥98.0%),毛蕊异黄酮(CHB-M-016,HPLC≥98.0%),黄芪皂苷Ⅰ(CHB-H-036,HPLC≥98.0%),黄芪皂苷Ⅱ(CHB-H-037,HPLC≥98.0%),黄芪皂苷Ⅲ(CHB-H-038,HPLC≥98.0%),异黄芪皂苷Ⅰ(CHB-Y-084,HPLC≥98.0%),购于成都克洛玛生物科技有限公司(成都)。黄芪药材购于河北安国药材市场,并经中国医学科学院药用植物研究所张本刚研究员鉴定,黄芪药材均密封于-20 ℃条件下保存。
2 实验方法
2.1 黄曲霉人工侵染黄芪
2.1.1 黄曲霉菌侵染黄芪过程 用无菌接种环挑取黄曲霉菌分生孢子到察氏培养基平板上,在28 ℃、90%湿度下培养7 d。取一支已培养好的黄曲霉菌斜面,加入含1%吐温-20的无菌水10mL,用无菌接种环轻轻刮下琼脂培养基表面的分生孢子,将悬浮的孢子悬液置于无菌的离心管中,充分振摇使其混悬。然后用无菌脱脂棉过滤,并用无菌水清洗3次,得到孢子悬液。运用血球计数板(25×16)法,将上述孢子悬液用无菌水稀释至浓度为106孢子/mL的A.flavus(CGMCC 3.4410)孢子悬液。以每50 g黄芪药材为一份分别储藏,每一份中分别添加浓度为106孢子/mL的孢子悬液1 mL,在30 ℃,95%湿度下储藏10 d。
2.1.2 UFLC-QTrap-MS/MS检测黄芪中黄曲霉毒素方法的建立 准确称取10 g粉碎的黄芪样品(过2号筛),加入50 mL甲醇-水(80∶20,v/v),超声提取20 min,用玻璃纤维滤纸过滤,精密吸取2 mL续滤液于45 ℃下氮气吹至近干,并用甲醇-水(50∶50,v/v)定容至1 mL,过0.22 μm有机滤膜,转入进样瓶,进样2.0 μL,根据课题组前期已建立起的黄芪中黄曲霉毒素的UFLC-QTrap-MS/MS检测方法[7],检测染菌培养10 d后黄芪中黄曲霉毒素的含量。
2.2 黄芪染菌前后主要化学成分含量变化
2.2.1 色谱条件和质谱条件 色谱柱为Waters Acquity UPLC BEH C18 column (100 mm×2.1 mm,1.7 μm);流动相为乙腈(A相)-0.1%甲酸水(B相),梯度洗脱程序如下:0~3 min,A相从10%升至30%;3~5 min,A相保持30%;5~8 min,A相从30%升至65%;8~12 min,A相从65%升至90%;12~15 min,A相瞬间回到10%的起始浓度并保持3 min。柱温:30 ℃;进样量:2 μL;流速:0.30 mL·min-1。离子源为电喷雾离子化源(ESI源);正离子方式检测;毛细管电压(Capillary voltage)为 3.0 kV;源温度(Source temperature):120 ℃;锥孔电压(cone voltage)为 40 V;质荷比范围:100~1200 m/z;母离子扫描能量(Parent Survey CE):10~30 V。
2.2.2 对照品溶液的制备 分别精密称取对照品毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪甲苷和异黄芪皂苷Ⅰ适量,用80%甲醇配成浓度分别为34、40、45.5、43、53.25、52、51、39、56 μg·mL-1的混合对照品储备液。
2.2.3 线性关系的考察和检测限 取“2.2.2”项下的混合对照品储备液,用80%甲醇稀释得到不同浓度的对照品溶液,分别进样2.0 μL,记录色谱图,以浓度为横坐标,峰面积为纵坐标,绘制标准曲线,结果见表2。根据3倍与10倍的信噪比峰响应值,得出检测限和定量限如表1中所示。
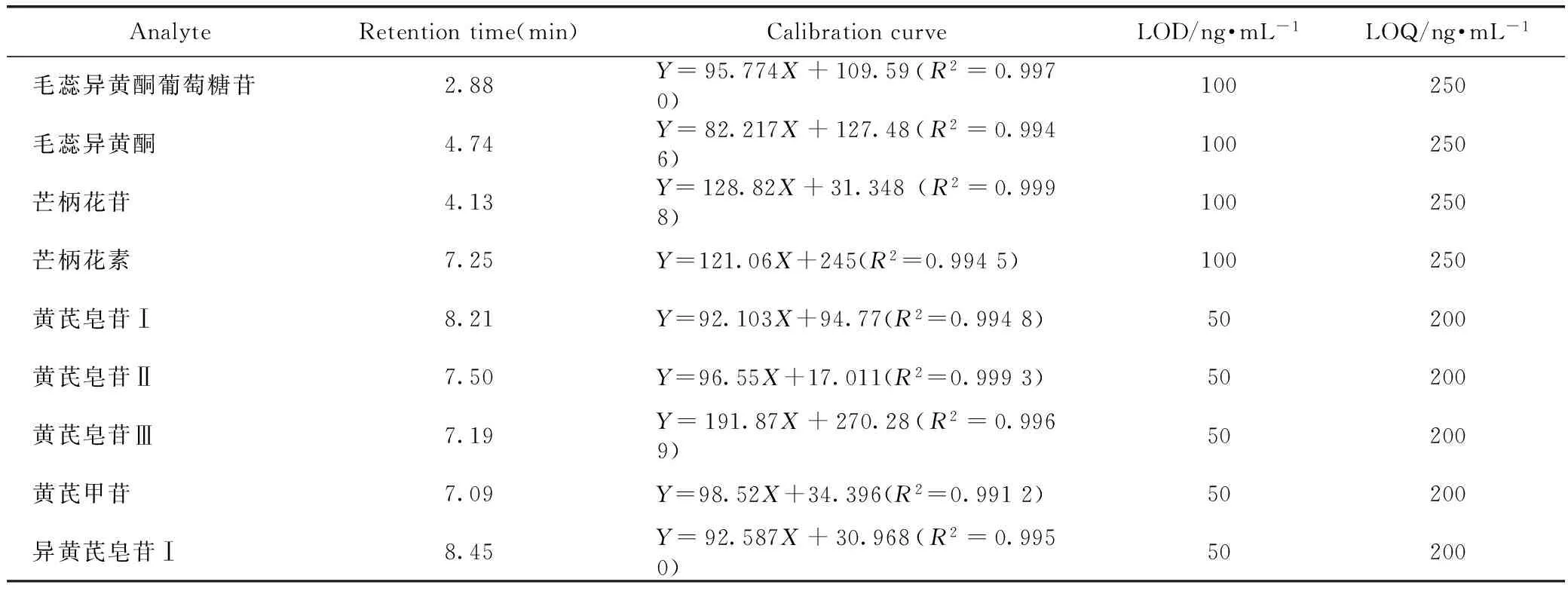
表1 黄芪中有效成分的线性关系
2.2.4 供试品溶液的制备 精密称取2.0 g黄芪药材粉末(二号筛)于锥形瓶中,加入20 mL 80%的甲醇超声提取1 h。过滤,取续滤液,滤液过0.22 μm有机滤膜,转入进样瓶,进样2.0 μL。按“2.2.1”项下色谱和质谱条件进行检测。
2.3 中心设计—响应面法优选黄芪的储藏条件
响应面法结合了统计学方法和数学方法,能够通过一系列确定性实验,用多项式函数的方式反映多个变量与其相应的结果之间的关系,并进行建模和分析,以达到寻找最佳变量值的最终目的[8-9]。中心组合设计(Central Composite Design,CCD)是响应面设计中最常用的二阶设计,其优势在于可以支持三个以下因素和水平的设计[10]。因此,本实验采用中心组合设计—响应面法,同时考察储藏环境中温度和湿度两个因素对中药材储藏期药材霉变情况的影响,以探索中药材(以黄芪为例)的最佳储藏条件。
黄曲霉菌的最适生长温度为25~40 ℃,黄曲霉毒素形成的最适温度为20~30 ℃。曲霉比其他霉菌更耐旱,在湿度较低的情况下亦能生存,而相对湿度80%~90%为其最佳的生存环境。因此本实验选择响应面设计中的中心组合设计模型,变量因子分别为:温度(20~40 ℃)和湿度(80%~95%)。每个变量因子均设有五个水平:0,±1,±α。各变量及水平的设置如表2所示。根据中心组合设计的原理,整个实验共需进行13次不同因素水平的测试。
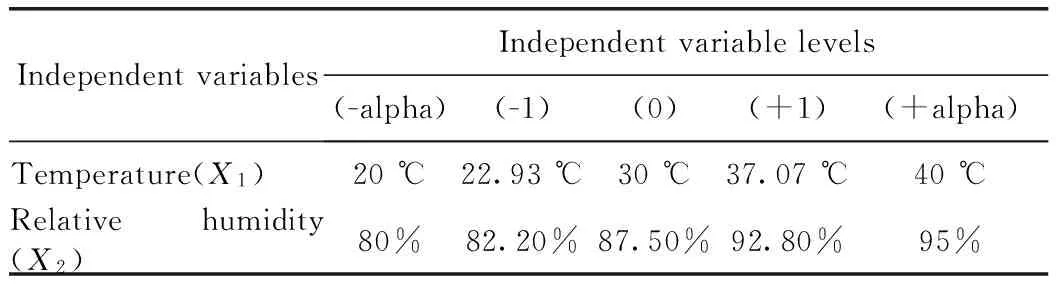
表2 中心组合设计各因素的水平设置值
3 结果与讨论
3.1 黄芪染菌过程考察
采用人工染菌将曲霉孢子接种黄芪,培养药材10 d后,黄芪药材表面出现严重霉菌现象(图1)。同时根据UFLC-QTrap-MS/MS检测方法,从接种孢子的黄芪药材中检测到黄曲霉毒素B1和B2,总量约31.8 μg·kg-1,由此证明了该人工染菌方法的可靠性。
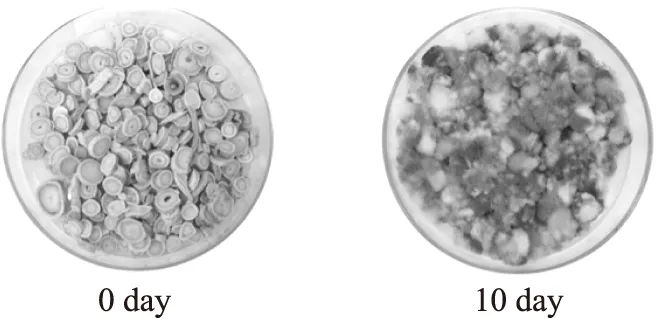
图1 黄芪药材接种曲霉孢子后在温度30℃,湿度95%下培养图
3.2 黄芪染菌前后主要化学成分变化研究
本研究采用Waters Q-TOF HDMS质谱仪建立起黄芪中毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪甲苷和异黄芪皂苷Ⅰ多个成分的同时分析图谱,并对染菌前后黄芪中有效成分含量进行对比研究。由图2A可知,该方法可将黄芪中9种成分较好的分离,并且这些组分在染菌前后的黄芪药材中都能检测到(图2B和2C)。
根据所建立的黄芪多成分测定方法线性关系和方法学,对染菌前后黄芪中黄酮和皂苷成分进行含量对比分析,结果如图3。由图3A可知,染菌后黄芪药材中黄酮苷化合物(毛蕊异黄酮葡萄糖苷和芒柄花苷)含量显著降低,对黄酮苷元化合物影响较小。尽管芒柄花素含量也出现降低,但含量减少幅度相对较小,对毛蕊异黄酮苷元含量几乎无影响。这可能是由于黄酮成分为黄芪中次生二级代谢产物,曲霉毒菌生长过程中需要摄取能量物质,在曲霉生长代谢产生曲霉毒素的过程中,将黄酮化合物中葡萄糖基团代谢掉,从而使糖苷含量显著降低,但黄酮苷元结构较稳定,因此受曲霉影响更小。由图3B可知,染菌后黄芪中皂苷成分变化较小,五种皂苷成分中仅黄芪皂苷I存在显著变化,说明黄芪染菌对其中皂苷影响较小,可能是由于皂苷分子量普遍较黄酮大,分子结构更复杂,受曲霉影响更小。综上说明,真菌毒素的污染不仅会产生毒素,导致人体的毒副作用,而且对黄芪药材的内在质量也存在影响。
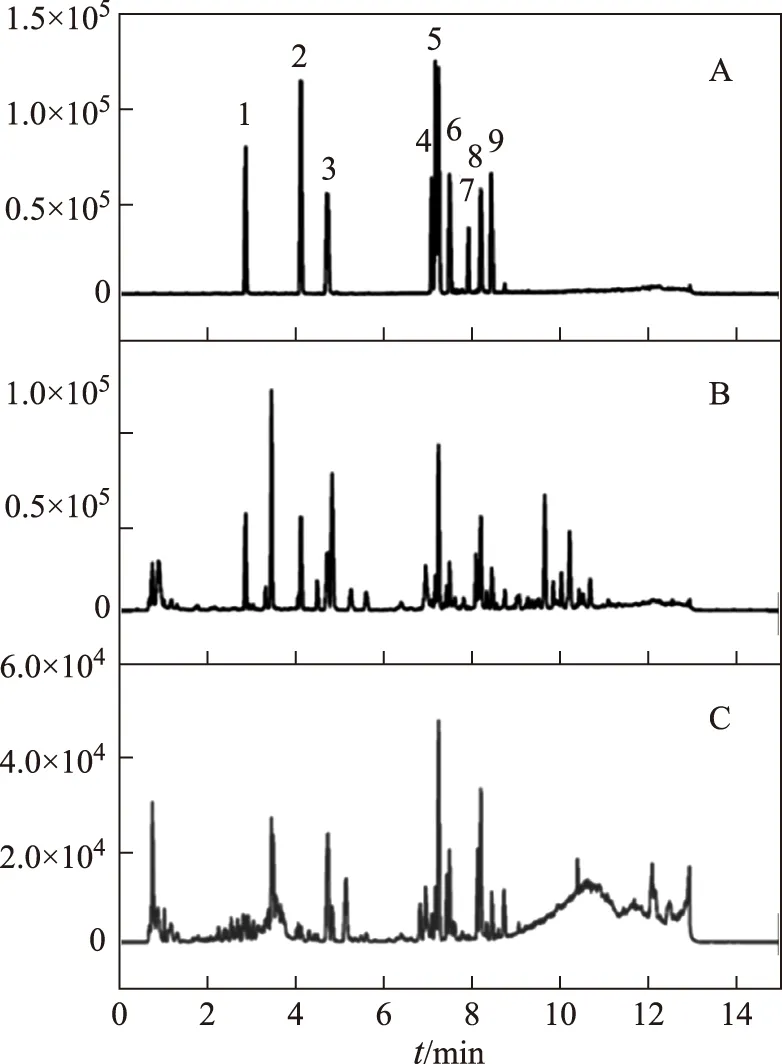
(A.黄芪混合标准品,B.黄芪药材,C.黄芪药材染菌后)(1.毛蕊异黄酮葡萄糖苷,2.芒柄花苷,3.毛蕊异黄酮,4.黄芪甲苷,5.黄芪皂苷Ⅲ,6.芒柄花素,7.黄芪皂苷Ⅱ,8.黄芪皂苷Ⅰ,9.异黄芪皂苷Ⅰ)图2 黄芪内在成分变化图
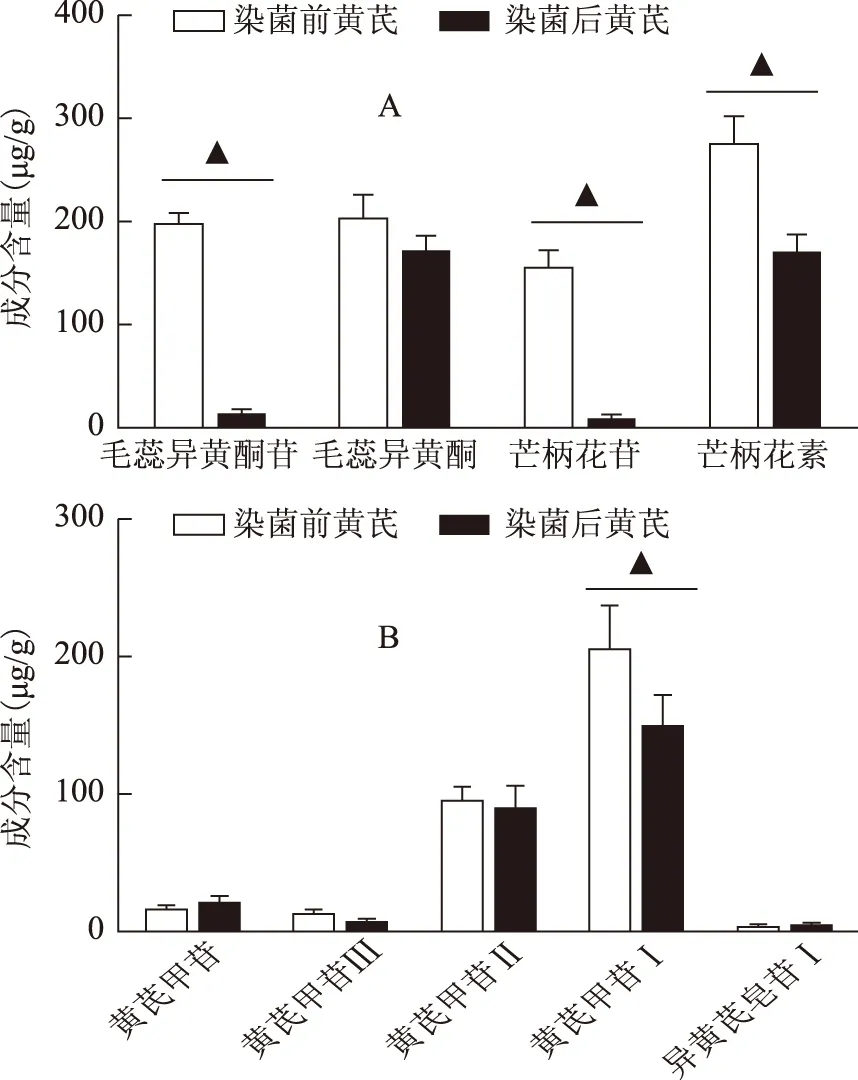
图3 黄芪药材染菌前后黄酮成分(A)和皂苷成分(B)含量变化对比
3.3 黄芪储藏条件的考察
运用UFLC-QTrap-MS/MS检测黄芪中的黄曲霉毒素,并将样品中测得的总黄曲霉毒素的含量输入Design-Expert V8.0.6软件中进行分析,中心组合设计的实验结果见表3。
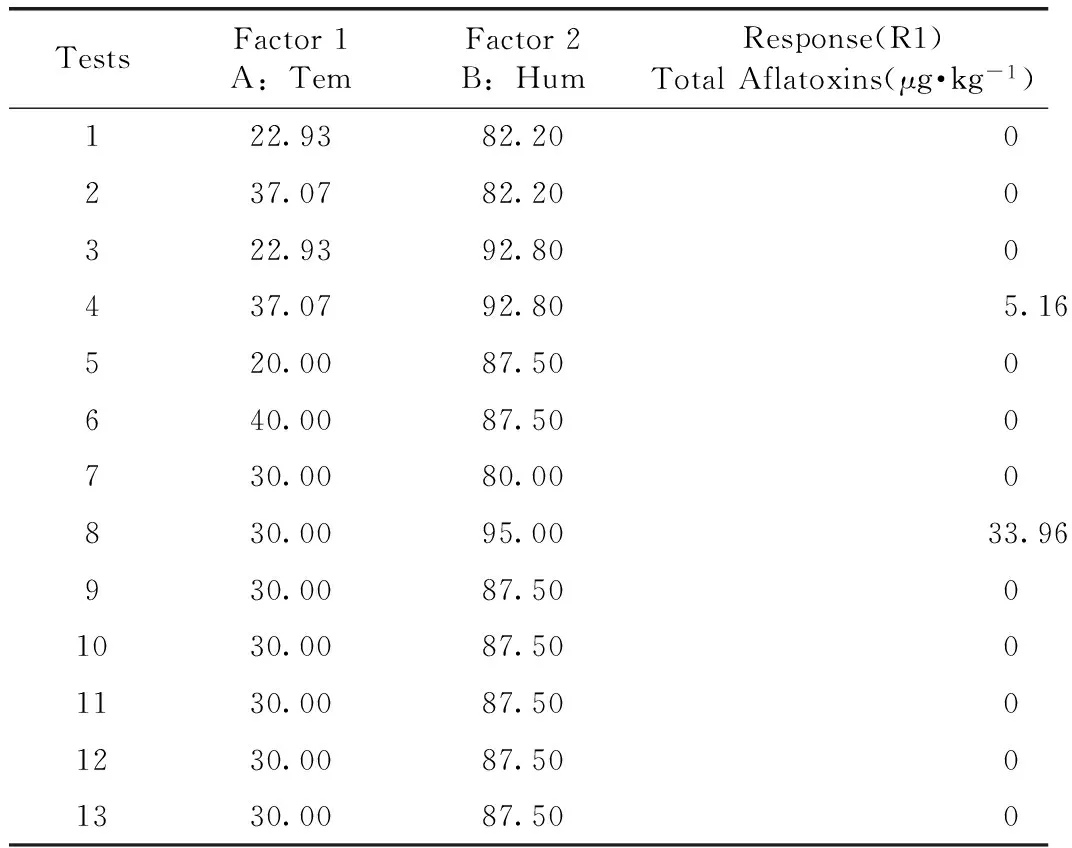
表3 Central Composite设计实验中总黄曲霉毒素的测得量
采用响应面优化法,建立黄曲霉毒素与温度、湿度相关性模型,所得方程如下:
R1=+0.000+0.000×A+12.01×B+1.29×A×B-1.80×A2+6.69×B2-10.72×A2×B+1.29×A×B2
其结果方差分析结果见表4。该模型的F-Value为6.61,表示该模型有显著性意义,且只有2.70%的可能性是由于噪音引起的F-Value大。“Prob>F”的值均小于0.0500表明模型中的各项式均具有显著性意义,即B,B2,A2B 均是具有显著性意义的模型中的各项。
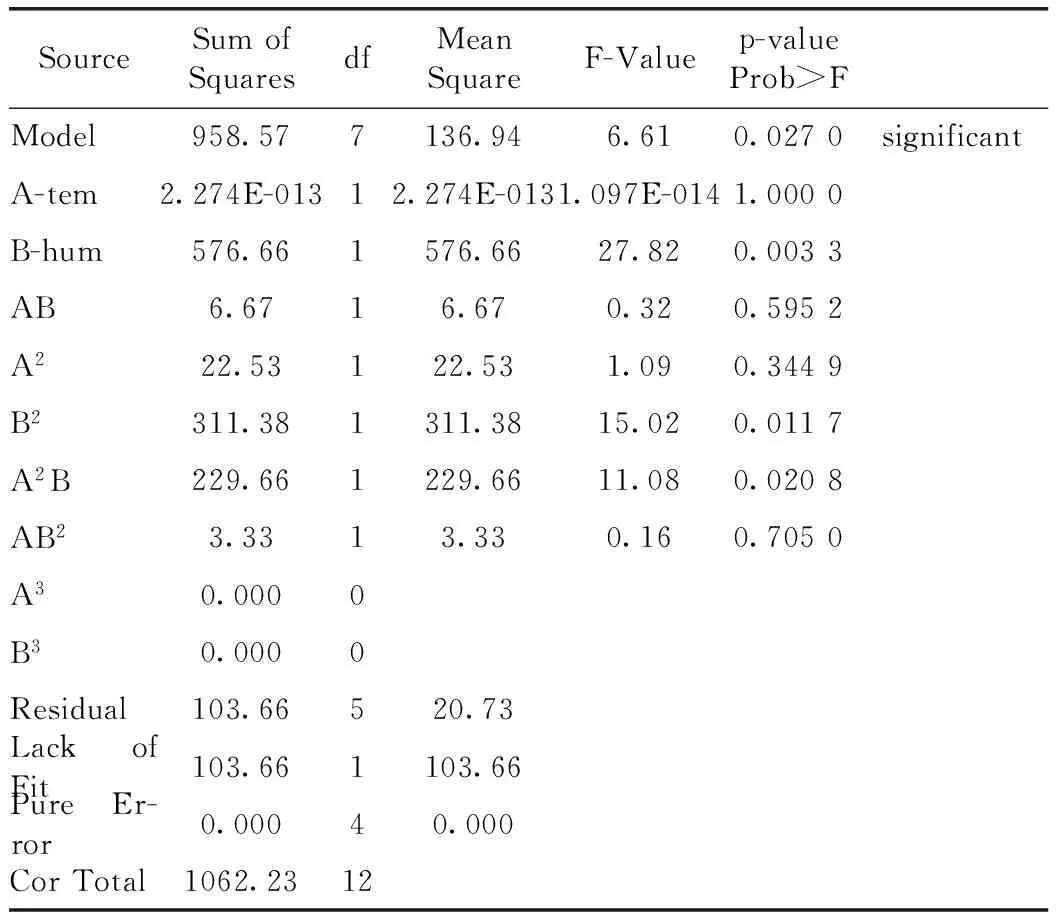
表4 方差分析表
本实验以表5中的四个参数来评估模型的好坏,评价该模式是否能应用于考察最佳的储藏环境。

表5 响应面评估参数表
R-Squared:拟合度,数值越接近1越好,本实验的拟合度有90.24%,实验误差小;Adj R-Squared:表示模型的校正决定系数,即相关指数R(判断曲线回归方程有效性的一个重要参数,R值越大则所求得的曲线回归方程越有效)的平方,本实验所得值表示该模型可以解释76.58%响应值的变化;Pred R-Squared:是用来解释模型预测新观测值的好坏能力;Adeq Precision:当此值大于4时,则指出该模型具有足够的分辨力,本实验所得的值为9.508,表明该模型可以用于实践。由此可知,本实验所建立的响应面优化模型用于预测培养环境的温湿度对真菌毒素产生量具有较好的准确率和可行性。
根据所绘制的响应面(图4)可知,当温度范围为22~37 ℃,湿度大于87.5%时,真菌毒素在黄芪中的含量会随着温度和湿度的变化而变化,其中温度为30 ℃,湿度为95%时为真菌毒素产生最多的条件。因此,根据响应面曲线图推测适宜于黄芪药材储藏的环境条件为温度低于20 ℃,湿度小于85%。
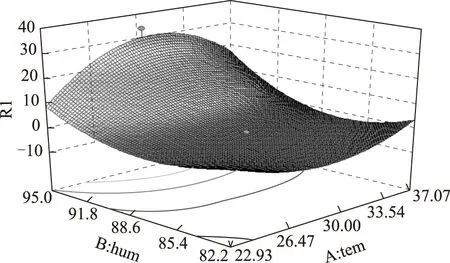
图4 温度、湿度与真菌毒素生成量关系的响应面曲线图
4 结论
黄芪中主要物质基础是黄酮和皂苷两大类组分。目前常用HPLC-DAD-ELSD同时测定这两类成分,但在灵敏度和色谱峰的鉴定上都表现出一定的不足[11]。Q-TOF-MS作为一种高分辨质谱,可适用于测定宽分子量范围的化合物,不受成分种类的影响,且具有高灵敏度,高扫描速率和高质量精度等优势。本研究采用Waters Q-TOF HDMS质谱仪建立起黄芪中毛蕊异黄酮葡萄糖苷、毛蕊异黄酮、芒柄花苷、芒柄花素、黄芪皂苷Ⅰ、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪甲苷和异黄芪皂苷Ⅰ多个成分的同时分析图谱,并采用人工接种黄曲霉菌使黄芪药材染菌,对比黄芪染菌前后有效成分变化发现,黄芪染菌过程不仅会产生毒性物质黄曲霉毒素,而且会影响黄芪药材中有效成分含量,尤其使黄酮苷类化合物含量显著降低,这可能与真菌生长代谢过程消耗黄酮苷中糖基有关。因此,中药材染菌过程不仅仅会产生外源性毒素,同时也会造成有效成分含量的降低,在中药材储藏防控体系研究中不能仅考虑将药材表面产生的真菌除去,还需要考虑到这一过程对中药质量的影响。基于此,本研究采用中心组合设计-响应面法考察了黄芪避免染菌的最佳储藏温湿度条件(温度低于20 ℃,湿度小于85%),从根本上避免了外源性毒素的产生以及中药材质量的降低。本研究不仅为综合评价黄芪的内在质量提供实验基础,而且以黄芪为例来考察适宜的储藏环境,为快速寻找适宜的中药材储藏环境提供可行方法。
[1] 金红宇,戴博,田金改,等.中药中外源性有害残留物的控制[J].中国药事,2007,21(12):1013-1018.
[2] Kong WJ,Liu SY,Qiu F,et al.Simultaneous multi-mycotoxin determination in nutmeg by ultrasound-assisted solid-liquid extraction and immunoaffinity column clean-up coupled with liquid chromatography and on-line post-column photochemical derivatization-fluorescence detection [J].Analyst,2013,138(9):2729-2739.
[3] Wen J,Kong W,Hu Y,et al.Multi-mycotoxins analysis in ginger and related products by UHPLC-FLR detection and LC-MS/MS confirmation [J].Food Control,2014,43:82-87.
[4] Zhang HW,Lin ZX,Xu C,et al.Astragalus (a traditional Chinese medicine) for treating chronic kidney disease [J].The Cochrane database of systematic reviews,2014,10:CD008369.
[5] Fu S,Zhang J,Menniti-Ippolito F,et al.Huangqi injection (a traditional Chinese patent medicine) for chronic heart failure:a systematic review [J].PloS one,2011,6(5):e19604.
[6] 张蔷,高文远,满淑丽.黄芪中有效成分药理活性的研究进展[J].中国中药杂志,2012,37(21):3203-3207.
[7] Yichen Hu,Weijun Kong,Hongli Luo,et al.Dynamic variation of bioactive compounds and aflatoxins in contaminated Radix Astragali during extraction process,JournaloftheScienceofFoodandAgriculture,2015,DOI 10.1002/jsfa.7257.
[8] Son J,Vavra J,Li Y,et al.Interactions between suspension characteristics and physicochemical properties of silver and copper oxide nanoparticles:a case study for optimizing nanoparticle stock suspensions using a central composite design [J].Chemosphere,2015,124:136-142.
[9] 陈健,孙爱东,高雪娟,等.响应面分析法优化超声波提取槟榔原花青素工艺[J].食品科学,2011,32(04):82-86.
[10] 张术易.响应面法优化中国被毛孢多糖提取工艺的研究[D].上海:上海师范大学,2012.
[11] Lianwen Qi,Ping Li,Meiting Ren,et al.Application of high-performance liquid chromatography-electrospray ionization time-of-flight mass spectrometry for analysis and quality control of Radix Astragali and its preparations.Journal of Chromatography A,2009,1216:2087-2097.
StudyontheInfluenceofAspergillusflavusContaminationontheQualityofRadixAstragaliandItsStorageConditionOptimization.
HUYichen1,2,KONGWeijun2,LIUQiutao2,LIUHongmei2,ZHAOGang1,YANGMeihua2*
(1.SchoolofBioengineering,ChengduUniversity,Chengdu610106,China; 2.InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicalSciences,PekingUnionMedicalCollege,Beijing100193,China)
Objective:The present study is aimed to evaluate the influence ofAspergillusflavuscontamination on the quality and bio-effectivity of Radix Astragali from the perspective of herbal compound changes,and investigate the best storage conditions.Methods:Radix Astragali was firstly contaminated by artificial inoculation ofAspergillusflavusspores.Based on the simultaneous determination of nine compounds in Radix Astragali by Q-TOF HDMS,including Calycosin-7-glucoside,calycosin,ononin,formononetin,Astragaloside I,Astragaloside II,Astragaloside III,Astragaloside IV and Isoastragaloside I,the variation of these bioactive compounds was monitored between herbs with or without fungal contamination.Subsequently,the storage condition about temperature and humidity of Radix Astragali was optimized by central composite design-response surface method.Results:After co-incubation withA.flavusspores for 10 days,Radix Astragali emerged significant mildew appearance and possessed remarkably reduced flavonoid glycosides,instead of flavonoid aglycones and saponins.The best storage condition for Radix Astragali to avoidA.flavuscontamination was optimized as the following:temperature and humidity below 20 ℃ and 85%,respectively according to the established response surface model.Conclusion:To the best of our knowledge,the influence ofA.flavuscontamination on the herbal quality of Radix Astragali and its optimized storage condition were evaluated for the first time herein.It would provide a promising research reference to establish the mildew prevent system during herbal storage.
Radix Astragali;storage;aflatoxin;bioactive components;response-surface
10.13313/j.issn.1673-4890.2015.11.006
2015-08-20)
十二五国家科技重大专项重大新药创制“中药质量安全检测和风险控制技术平台”(2014ZX09304307-002)
*
杨美华,研究员,研究方向:中药质量分析与安全性研究;Tel:(010)57833277,E-mail:yangmeihua15@hotmail.com
