血竭素高氯酸盐通过线粒体途径诱导人乳腺癌细胞MCF-7凋亡
2015-09-25王莹刘乐天杨柳王海燕
王莹,刘乐天,杨柳,王海燕
(1.吉林大学 第一医院 胃肠内科,吉林 长春 130000;2.吉林大学 第一医院 护理部,吉林 长春 130000)
·基础研究·
血竭素高氯酸盐通过线粒体途径诱导人乳腺癌细胞MCF-7凋亡
王莹1,刘乐天1,杨柳1,王海燕2*
(1.吉林大学 第一医院 胃肠内科,吉林 长春130000;2.吉林大学 第一医院 护理部,吉林 长春130000)
目的:研究血竭素高氯酸盐(Dracorhodin Perchlorate,DP)抗乳腺癌作用及作用机制。方法:四甲基噻唑蓝法分析60μmol·L-1DP作用不同时间后,其对肿瘤细胞的抑制率;细胞形态学分析、细胞核形态学分析和DNA片段化分析确定细胞凋亡的发生;Rhodamine123染色分析细胞线粒体膜电位;Western检测细胞凋亡相关特别是线粒体相关蛋白表达。结果:60μmol·L-1DP时间依赖性地抑制人乳腺癌MCF-7细胞生长;DP抑制细胞生长通过诱导MCF-7细胞凋亡来实现;DP诱导细胞凋亡时,其活化了线粒体通路蛋白caspase-9,剪切了DNA损伤修复蛋白PARP;进一步研究发现DP诱导细胞凋亡的主要原因是其降低了细胞线粒体膜电位(正常膜电位细胞百分比93.11%;DP处理后正常膜电位细胞百分比37.45%);而线粒体上Bcl-2、Bcl-XL表达减少,Bax、Bak增多是DP改变线粒体膜电位的主要原因。结论:DP通过调节线粒体通路来促进细胞凋亡。
血竭素高氯酸盐;凋亡;线粒体蛋白
血竭为棕榈科植物麒麟竭DaemonoropsdracoB1.果实渗出的树脂经加工制成。此外,龙舌兰科植物龙血树的树脂也作为血竭用。血竭主要成分为血竭素和血竭红素[1]。血竭素高氯酸盐(Dracorhodin perchlorate,DP)为人工合成品[2],其具有抗宫颈癌作用[3]。人乳腺癌和宫颈癌为妇科主要癌症,本研究探讨血竭素高氯酸盐抗人乳腺肿瘤作用及其机制,为进一步开发血竭素高氯酸盐为抗妇科肿瘤药物提供参考。
1 材料
1.1主要试药
血竭素高氯酸盐(中国食品药品检定研究院);应用时用二甲基亚砜(DMSO)溶解,并使DMSO的终浓度低于0.1%。DMSO、细胞核染料Hoechst3258、线粒体染料Rhodamine123(Sigma公司);RPMI1640培养基(Gibco,USA),胎牛血清(北京元亨圣马生物试剂公司)。PARP、Caspase-9、Histone、Bcl-2、Bcl-XL、Bax、Bak抗体及二抗(SantaCruz公司,CA,USA)。
1.2细胞培养
人乳腺癌细胞(MCF-7)(美国AmericanTypeCultureCollection,ATCC)。细胞单层接种在含10%胎牛血清、20g·L-1谷氨酰胺的RPMI1640培养液中,在37℃、5%二氧化碳培养箱中培养。
2 方法
2.1MTT分析抑制率
取对数生长期的MCF-7细胞接种于96孔培养板中(细胞数为每孔1×104个),每孔100μL培养12h后再加入60μmol·L-1DP,每个时间点设平行孔3个,于37℃、5%二氧化碳培养箱中继续培养12、24、36、48h,每孔加入5g·L-1MTT20μL,继续培养3h后,加入150μL DMSO溶解,于酶标仪492nm处检测,计算药物对MCF-7细胞的离体生长抑制率。
2.2细胞形态学观察
细胞以每孔1×105个接种于6孔板中,培养12h后,加入60μmol·L-1DP于24h用光学显微镜观察、拍照。
2.3细胞核形态学分析
全区设立有自治区级、市级、县级、乡镇四级社会保险征收服务机构,而税务部门根据税源变化的特点,已收缩乡镇征收机构,大多集中到县级,对城乡居民养老保险和医疗保险,尤其乡镇居民保险的征收管理带来一定程度的不便。
细胞以每孔1×105个接种于6孔板中,培养12h后,加入60μmol·L-1DP于培养的24h加入4%多聚甲醛固定15min,弃固定液,用PBS洗1次,加入终浓度200μmol·L-1Hoechst33258染色30min,荧光显微镜观察、拍照。
2.4DNA片段化分析
收集细胞,提取DNA,用2%琼脂糖凝胶电泳,溴化乙锭显色后紫外灯下观察[3]。
2.5Rhodamine染色分析线粒体膜电位
按每孔5×105个细胞将MCF-7细胞接种于6孔板中,24h后加入60μmol·L-1DP作用24h,然后加入5mg·L-1Rhodamine123在37℃孵育30min。孵育过后,细胞用PBS洗两次。荧光显微镜下观察Rhodamine123染色的强度。
2.6Western blot 分析蛋白表达
收集5×106个以上细胞,1000×g 离心10min,PBS洗两次,加入80μL 细胞裂解液(50mmol·L-1HEPES,1% Triton-100,100mmol·L-1NaF,1mmol·L-1EDTA,1mmol·L-1EGTA,2mmol·L-1正钒酸钠,1mmol·L-1PMSF,10g·L-1Pepstatin A)于冰上裂解1h,25000×g离心5min,收集上清液。加入20μL5×上样缓冲液[250mmol·L-1Tris-HCl(pH6.8),100g·L-1SDS,50%甘油,5g·L-1溴酚兰,5%二巯基乙醇],沸水中煮3min,使蛋白变性。每个点样孔加样15μL样品液,12% SDS-聚丙烯酰胺凝胶分离蛋白质。凝胶上的蛋白带转移到硝酸纤维素膜上,封闭液封闭膜上的蛋白结合位点2h。加入一抗及碱性磷酸酶标记的二抗,显色。
细胞线粒体的裂解:收集的细胞饼加入100μL 裂解液,裂解液包括sucrose250mmol·L-1,Hepes20mmol·L-1,KCl10mmol·L-1,MgCl21.5mmol·L-1,EDTA1mmol·L-1,EGTA1mmol·L-1,dithiothreitol(DTT)1mmol·L-1,PMSF1mmol·L-1(pH7.5),aprotinin1mg·L-1,leupeptin1mg·L-1。然后在4℃冰上裂解1h。12000×g离心30min,离心的沉淀加入30μL 裂解液[Hepes50mmol·L-1(pH7.4),1% Triton-X100,NaF100mmol·L-1,EDTA1mmol·L-1,EGTA1mmol·L-1Sodium orthovanadate PMSF1mmol·L-1,leupeptin10mg·L-1,aprotinin10mg·L-1,pepstatin A10mg·L-1]。在冰上裂解1h。12000×g离心30min,裂解液中包含线粒体蛋白。
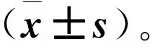
3 结果
3.1DP的抗肿瘤作用
DP作用12、24、36、48h后,其抑制率为(25.4±1.67)%、(38.58±1.71)%、(47.12±1.10)%、(59.89±1.47)%(见图1)。我们采用60μmol·L-1作为实验浓度。
3.2DP对凋亡的影响
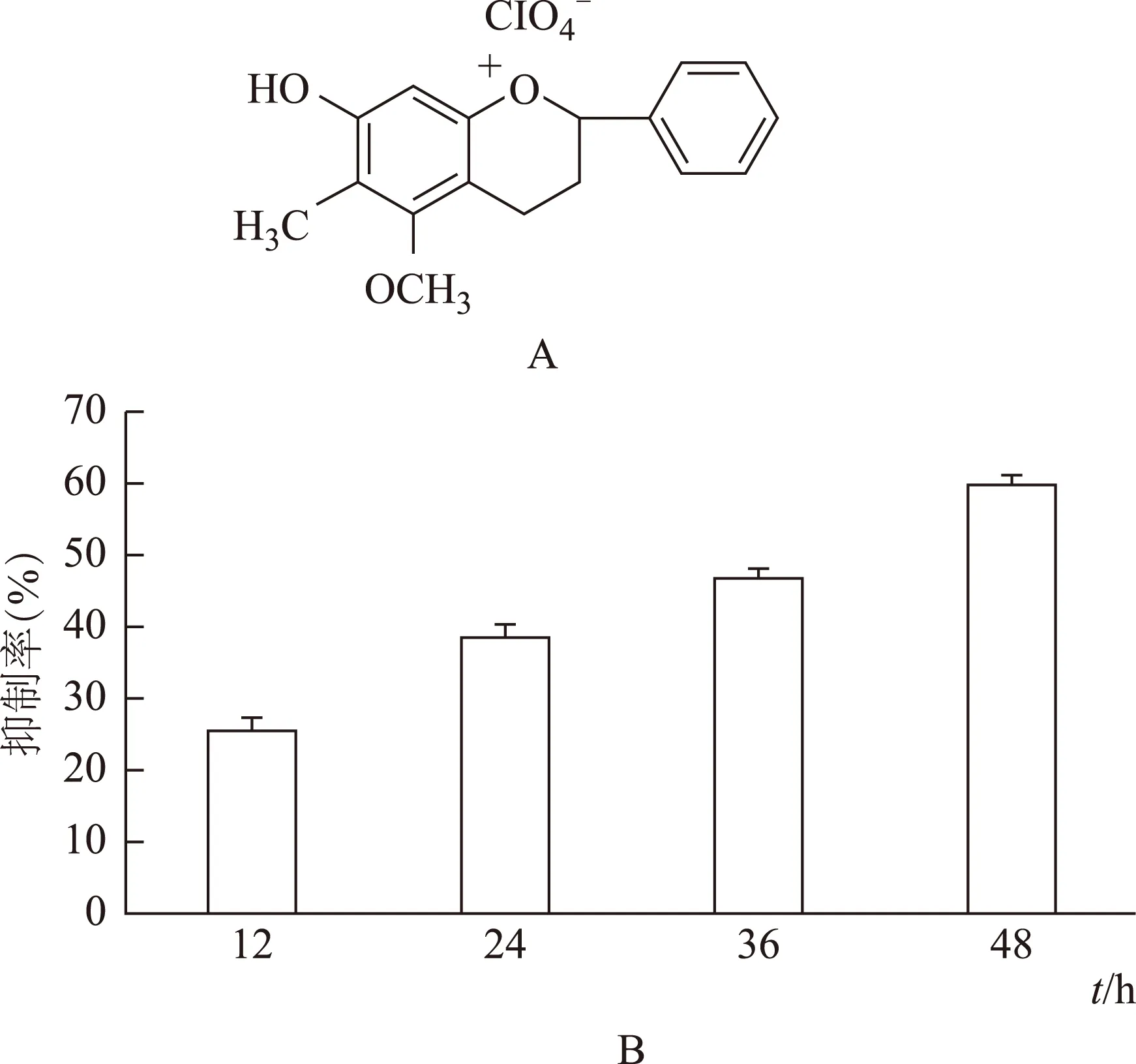
细胞凋亡时,会发生相应的形态学变化,例如细胞浮起变圆,凋亡小体出现[4]。本研究发现60μmol·L-1DP处理24h后,细胞数目减少,细胞浮起变圆,出现凋亡小体,而对照组细胞贴壁良好,没有细胞死亡(见图2A)。同样,细胞凋亡时细胞核皱缩,荧光染料Hoechst33258染色增强。我们发现对照组细胞核大小均匀,颜色一致,而60μmol·L-1DP处理24h后,细胞核皱缩变亮(见图2A)。DNA 片段化(DNA ladder)是凋亡的标志,我们发现60μmol·L-1DP处理24h后,出现DNA片段化(见图2B)。PARP蛋白[5]是DNA损伤修复蛋白,我们发现DP处理后,PARP表达降低,说明DP降低DNA修复能力(见图2C)。以上结果说明DP诱导MCF-7细胞凋亡。
注:A.DP化学结构;B.MTT分析DP处理不同时间点的肿瘤抑制率。图1 血竭素高氯酸盐(DP)对乳腺癌MCF-7的抑制作用
注:A.A1、A2图片分析DP处理24 h后细胞形态学变化,箭头指示细胞的凋亡小体。A3、A4图片分析DP处理24 h后细胞核形态变化,箭头指示皱缩的细胞核。B.DP处理24 h后,DNA片段化情况,箭头指示片段化的DNA。C.Western分析PARP蛋白表达,Histone为细胞内参。图2 DP对乳腺癌MCF-7凋亡的影响
3.3DP与线粒体途径的相关性
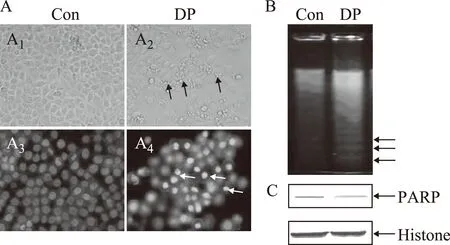
60μmol·L-1DP处理24h后,具有正常膜电位的细胞百分比为37.45%,而对照组具有正常线粒体膜电位的细胞百分比为93.11%,也就是说55.66%的细胞在DP处理后线粒体膜电位降低(见图3A)。Caspase-9是线粒体通路蛋白,线粒体途径被激活后,其由Pro-caspase-9转化为caspase-9后被活化,进而参与细胞凋亡。我们发现60μmol·L-1DP处理24h后,活化的caspase-9表达增加(见图3B),说明DP降低线粒体膜电位后,激活caspase-9来介导凋亡。
注:A:DP处理24 h线粒体膜电位情况,***P<0.001。B:DP处理24 h后,Western分析caspase-9蛋白表达,Histone为细胞内参。图3 DP对线粒体途径的影响
3.4线粒体相关蛋白的分布
线粒体膜电位降低的主要原因是线粒体相关蛋白表达和分布改变。我们提取总的线粒体相关蛋白,发现60μmol·L-1DP处理24h后,具有降低膜电位功能的Bax蛋白表达增加,而具有稳定膜电位功能的Bcl-2蛋白表达降低,但DP对Bak、Bcl-XL蛋白表达没有明显的影响(见图4A)。继而我们分离了细胞内的线粒体,观察蛋白在线粒体的分布。研究发现具有降低膜电位功能的Bax、Bak表达增加,而具有稳定膜电位功能的Bcl-2、Bcl-XL表达降低。所以DP有改变线粒体相关蛋白表达和定位的能力。

注:A.DP处理24 h后细胞线粒体蛋白的表达情况,Histone为细胞内参;B.DP处理24 h后,提取分析线粒体蛋白,Western分析蛋白表达。图4 DP对线粒体蛋白表达和定位的影响
4 讨论
近年来,从中草药中寻找安全有效的肿瘤化疗替代药物成为研究的热点之一。乳腺癌发病率自20世纪70年代末开始一直呈上升趋势,严重威胁患者的健康和生命。已知血竭素高氯酸盐(DP)对人宫颈癌具有抗肿瘤效果[3],本课题研究DP的抗妇科癌症乳腺癌效果。研究发现DP可以有效的抑制乳腺癌细胞MCF-7细胞生长,并通过凋亡方式促进细胞的死亡。说明DP可以成为潜在的抗乳腺癌药物。
线粒体途径是细胞凋亡通路之一。当线粒体膜电位降低的时候,细胞内的AIF和cytochrome C 会从线粒体内释放出来,促进pro-caspase-9剪切活化为caspase-9,进而促进caspase-3的活化。我们研究发现DP降低线粒体膜电位,并促进caspase-9的活化,说明DP攻击细胞的线粒体来促进细胞凋亡。MCF-7细胞是caspase-3缺失的细胞[7],所以caspase-9的作用无法传递给下游的caspase-3,但我们同样观察到了PARP表达降低、细胞核皱缩、DNA片段化、凋亡小体出现等凋亡现象,说明DP对caspase-3缺失的细胞仍具有促进其凋亡的作用,而DP可能活化caspase-3以外的凋亡因子,这需要进一步的实验研究。
线粒体膜电位降低的主要原因是线粒体相关蛋白表达以及分布改变。Bax和Bak等线粒体蛋白以同源二聚体形式存在时,会在线粒体上打孔来降低线粒体膜电位。而Bcl-2和Bcl-XL等线粒体蛋白以同源二聚体形式存在时,会稳定线粒体的膜电位[6]。我们研究发现DP处理后,Bcl-2的表达降低,而Bax表达增加,但Bak和Bcl-XL表达没有明显的改变,说明DP可以调节线粒体相关蛋白表达。同样我们通过提取线粒体蛋白观察了他们在线粒体的分布,研究发现线粒体的Bax和Bak表达增多,而Bcl-2和Bcl-XL表达减少。这样Bcl-2和Bcl-XL稳定线粒体膜电位的作用被Bax和Bak抑制了。说明DP可以调节线粒体相关蛋白定位来促进细胞凋亡。
总之,DP通过改变线粒体膜电位来促进细胞凋亡,DP具有抗乳腺癌作用,是潜在的抗乳腺癌药物。
[1] Hu Y Q,Tu P F,Li R Y,et al.Studies on silbene derivatives fromDracaenacochinchinensisand their antifungal activities[J].Chin Tradit Herb Drugs,2001,32(2):104-106.
[2] Gao W F,Zheng H,Wang Y S,et al.Synthesis of dracorhodin[J].Chin J Pham,1989,20(6):247-250.
[3] Xiao M,Wang M W,Wang H R,et al.Mechanism of dracorhodin perchlorate-induced HeLa cell apoptosis[J].Acta pharmaceutica Sinica,2004,39(12):966-970.
[4] Zhou J F,Chen Y,Li C Y,et al.Ara-c induced apoptosis in human myeloid leukemia cell line HL-60[J].Chin J Oncol,1997,19(2):107-108.
[5] Cui Q,Yu J H,Wu J N,et al.P53-mediated cell cycle arrest and apoptosis through a caspase-3-independent,but caspase-9-dependent pathway in oridonin-treated MCF-7 human breast cancer cells[J]. Acta Pharmacol Sin,2007,28(7):1057-1066.
[6] Kang N,Zhang J H,Qiu F,et al.Inhibition of EGFR signaling augments oridonin-induced apoptosis in human laryngeal cancer cells via enhancing oxidative stress coincident with activation of both the intrinsic and extrinsic apoptotic pathways[J]. Cancer Lett,2010,294(2):147-158.
[7] Yu J H,Cui Q,Jiang Y Y,et al.Pseudolaric acid B induces apoptosis,senescence,and mitotic arrest in human breast cancer MCF-7[J]. Acta Pharmacol Sin,2007,28(12):1975-1983.
DracorhodinPerchlorateInducedHumanBreastCancerMCF-7CellApoptosisthroughMitochondrialPathway
WANGYing1,LIULetian1,YANGLiu1,WANGHaiyan2*
(1.DepartmentofGastroenterology,TheFirstHospitalofJilinUniversity,JilinUniversity,Changchun130000,China;2.Nursingdepartment,TheFirstHospitalofJilinUniversity,JilinUniversity,Changchun130000,China)
Objective:To investigate the anti-tumor effect and the mechanism of Dracorhodin perchlorate(DP)in human breast cancer MCF-7.Methods:The inhibitory rate of60μmol·L-1DP to tumor cell was measured by MTT analysis. Cell morphology analysis,nuclear morphology analysis,and DNA fragmentation test were applied for detecting apoptosis. Rhodamine123staining was used for mitochondrial membrane potential(MMP). Western blot was applied for protein expression.Results:60μmol·L-1DP inhibited MCF-7growth in time-dependent manner,and the inhibition of DP resulted from apoptosis. The caspase-9was activated when DP induced apoptosis,and PAR Pexpression was decreased after DP treatment. The decreased MMP led to apoptosis(in control group93.11% cells kept normal MMP,but in DP-treated group only37.45% kept normal MMP). Mitochondrial Bcl-2and Bcl-XL were decreased,and Bax and Bak were increased,which led to decreased MMP in MCF-7cells.Conclusion:DP induced apoptosis through mitochondrial pathways.
Dracorhodin perchlorate;apoptosis;mitochondrial protein
*
王海燕,主管护师,研究方向:肿瘤治疗与癌症患者护理;Tel:(0431)88783436,E-mail:422321732@qq.com
10.13313/j.issn.1673-4890.2015.12.008
2015-03-10)
