人参内生ge15菌株抑菌活性物质的初步研究△
2015-09-25刘敏丁万隆胡陈云高原李勇
刘敏,丁万隆,胡陈云,高原,李勇
(中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
·中药农业·
人参内生ge15菌株抑菌活性物质的初步研究△
刘敏,丁万隆,胡陈云,高原,李勇*
(中国医学科学院 北京协和医学院 药用植物研究所,北京 100193)
目的:探究人参内生细菌ge15菌株对人参病原菌的作用机理,明确ge15菌株胞外分泌液中抑菌活性成分的提取方法、活性组分及抑菌活性物质的稳定性。方法:通过硫酸铵沉淀、浓盐酸沉淀及饱及正丁醇萃取等方法获得菌株发酵液中抑菌活性成分;牛津杯法测定提取成分的抑菌活性。结果:从ge15菌株发酵液得到的提取液均有抑菌活性;对发酵上清液经高温和蛋白酶K处理,抑菌活性未见明显变化。结论:ge15菌株能产生多种抑菌活性成分;抑菌成分对高温和蛋白酶K稳定。
人参;内生细菌;抑菌物质
人参P.ginsengC.A.Meyer为五加科人参属多年生药用植物,我国传统名贵中药材。由于人参具有强忌连作的特性,其中的人参土传病害问题严重影响人参的产量和品质[1]。目前,化学农药仍是人参病害防治的主要手段,但由此引发的人参农残超标、生态环境恶化、出口受阻等问题非常严重。利用有益微生物防治植物病害是化学防治的有效替代途径之一。内生细菌在宿主植物中具有丰富的多样性,与宿主植物长期协同进化过程中形成了特殊的共生关系[2-3]。本课题组前期分离到的人参内生细菌ge15菌株对人参黑斑菌Alternariapanax、人参锈腐菌Cylindrocarpondestructans、人参疫病菌Phytophthoracactorum等多种人参土传病原真菌有明显抑制作用[4]。笔者通过对该菌株胞外分泌液中代谢产物的分离提取,明确了ge15菌株合成的抑菌活性成分组成情况及其抑菌活性的稳定性,上述研究结果为人参及其近缘种属植物的病害防治奠定了理论基础。
1 材料与方法
1.1 材料
供试菌株
拮抗细菌ge15菌株和人参黑斑菌A.panax由本实验室分离、保存。
供试培养基
PDA培养基:鲜土豆200 g,葡萄糖20 g,琼脂17 g,蒸馏水1 L,pH 7.0。
LB液体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 5 g,蒸馏水1 L,pH 7.0。
PBS缓冲液:NaCl 8.0 g;KCl 0.2 g;Na2HPO41.44 g;KH2PO40.24 g;加蒸馏水至1000 mL,用Na2HPO4或KH2PO4调节pH 7.4。
1.2 方法
1.2.1 抑菌活性检测方法 在距平皿中心2 cm处对称摆放牛津杯,倒入PDA培养基,制成带孔PDA平板。将人参黑斑菌菌饼(Φ6 mm)接种于平板中央后,每孔加入100 μL待测液。以无菌PBS缓冲液为空白对照(CK),每种处理设3次重复。静置过夜,22 ℃倒置培养5~7 d后观察抑菌效果,测量菌落半径。抑菌率=(r对照-r待测)/r对照×100%,r-菌落半径。
1.2.2 菌株发酵上清液的制备及其抑菌活性检验 用接种环挑取1环经活化的ge15菌株,接种至100 mL的LB液体培养基中,33 ℃、160 r·min-1振荡培养24 h作为种子液。按5%接种量将种子液接种到100 mL的LB液体培养基中,相同条件振荡培养48 h,发酵液4 ℃、10 000 r·min-1离心20 min,上清液经0.22 μm微孔滤膜过滤得发酵上清液。以同批含菌发酵液为阳性对照,以无菌水为空白对照,进行抑菌试验,试验平行3次重复。
1.2.3 抑菌蛋白粗提液的制备及其抑菌活性检验 取10 mL发酵上清液,缓慢加入固体硫酸铵颗粒,使其饱和度分别达到30%、40%、50%、60%、70%、80%和90%,4℃静置过夜,10 000 r·min-1离心20 min。沉淀用0.02 mol·L-1的PBS缓冲液(pH 7.2)重悬至完全溶解,所得溶液装入透析袋(截留分子量为8~14 kD)中除盐,直至1%的BaCl2溶液滴定透析外液无沉淀生成。将透析袋内溶液冷冻干燥,PBS缓冲液定容至10 mL,经0.22 μm滤膜除菌,即得粗蛋白提取液,4 ℃保存备用。
用2.1的方法检测不同饱和度硫酸铵提取液的抑菌活性,以发酵上清液为阳性对照,以无菌PBS溶液为空白对照,试验平行重复3次。
1.2.4 粗脂肽提取物的制备其抑菌活性检验 取LB发酵上清液10 mL,用6 mol·L-1的HCl调节至pH 2.0,4 ℃静置过夜,10 000 r·min-1离心20 min。所得上清液调节PH为中性后4 ℃保存备用。所得沉淀用甲醇溶解,抽滤2次,合并滤液,旋转蒸发浓缩后冷冻干燥,所得干燥样品用PBS缓冲液(0.02 mol·L-1,pH 7.2)定容至10 mL,经0.22 μm滤膜除菌,即得脂肽粗提物。用2.1的方法检测脂肽粗提液和酸化上清液的抑菌活性,以发酵上清液为阳性对照,以无菌PBS溶液为空白对照,试验平行重复3次。
1.2.5 有机溶剂萃取其抑菌活性检验 取10 mL发酵上清液3份,分别用等量石油醚、乙酸乙酯、水饱和正丁醇萃取,萃取两次后合并有机相,分别旋干溶剂,用PBS缓冲液(0.02 mol·L-1,pH 7.2)定容至10 mL,经0.22 μm滤膜除菌,即得有机试剂萃取供试液。以同批发酵的上清液作为阳性对照,除菌PBS缓冲液为空白对照,进行抑菌活性检测。
1.2.6 发酵上清液抑菌活性成分稳定性的初步测定 取10 mL菌株发酵上清液置于高压灭菌锅中121 ℃高温灭菌30 min,0.22 μm滤膜除菌,滤液视为高温、高压处理。取发酵上清液1 mL,加入蛋白酶K(北京汇天东方科技有限公司)至终浓度1 mg·mL-1,37 ℃恒温消解2 h,0.22 μm滤膜除菌,滤液视为蛋白酶处理。未经处理的发酵上清液作为空白对照,参照2.1的方法测定样品的抑菌活性。
2 结果与分析
2.1 ge15菌株发酵上清液的抑菌活性
研究发现,ge15菌株LB发酵液对人参黑斑菌生长有非常显著的抑制作用,无菌发酵液上清液的抑菌活性略弱于含活体菌株的发酵上清液(图1)。试验结果表明,来自发酵上清液的抑菌活性成分对抑菌活性起主要作用,发酵液中的活体菌株也起到一定的抑菌作用。
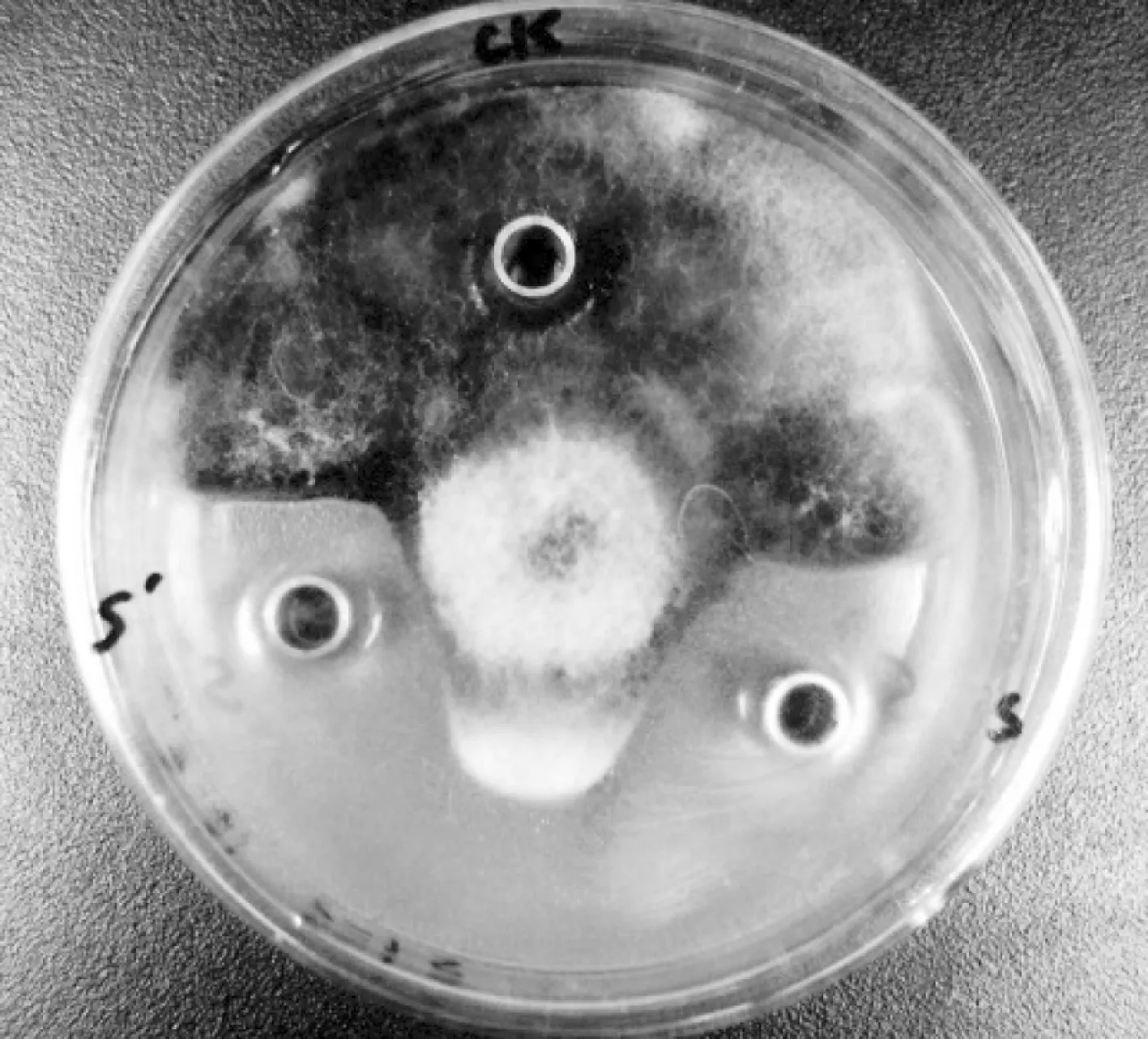
S:菌株发酵液;S’:发酵上清液。图1 发酵上清液的抑菌活性
2.2 抑菌蛋白粗提液的抑菌活性
粗蛋白提取物的抑菌活性与硫酸铵饱和度存在相关性,30%~90%硫酸铵饱和度下析出的粗蛋白均有抑菌效果;发酵液析出物对人参黑斑菌的抑制率随硫酸铵饱和度增大而升高,70%饱和度时抑菌率达到最高值,随后发酵液析出物对人参黑斑菌的抑制率逐渐下降(图2)。试验结果表明,70%饱和度的硫酸铵能够最大限度地提取ge15菌株代谢产物中的抑菌蛋白。
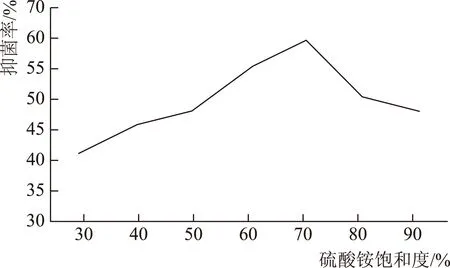
图2 硫酸铵沉淀物的抑菌作用
2.3 脂肽粗提取物的抑菌活性
菌株发酵上清液酸化后能产生明显的絮状沉淀,经超低温真空冷冻干燥后有淡黄色脂肽粗提物生成。抑菌试验结果表明,脂肽粗提液对人参黑斑菌具有明显的抑菌效果,但抑菌效果略弱于发酵上清液(图3),说明发酵液中还存在其他抑菌活性成分。酸化沉淀后的发酵上清液无抑菌效果,说明酸沉淀法能有效提取发酵液中的抑菌活性成分。
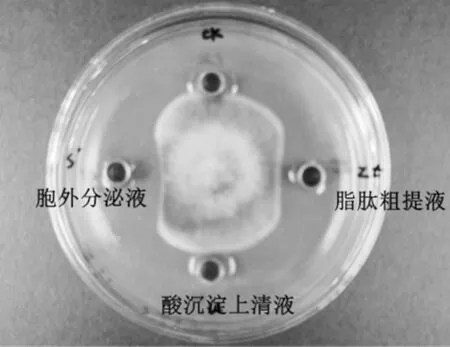
图3 脂肽粗提物的抑菌活性
2.4 有机溶剂萃取液的抑菌活性检验
用3种极性存在显著差异的有机溶剂萃取发酵上清液中的活性成分发现,石油醚与乙酸乙酯提取液无抑菌活性,饱和正丁醇提取液有抑菌活性,说明极性较大的水饱和正丁醇能有效提取发酵液中的抑菌活性物质(图4)。
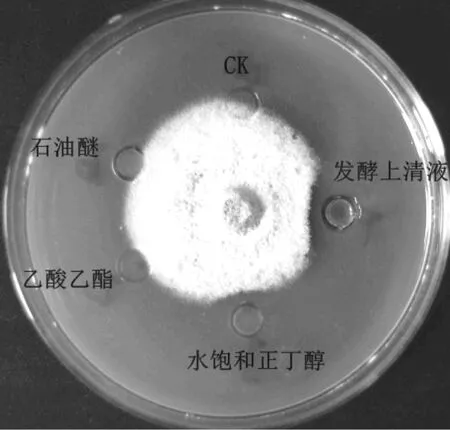
图4 有机溶剂萃取液的抑菌活性
2.5 发酵液上清液中抑菌活性物质稳定性的初步测定
经高温、高压处理,发酵上清液仍有较高抑菌活性(图5a),且与未处理发酵上清液的抑菌活性无明显差别,说明发酵上清液中的抑菌物质具有较好的热稳定性。经蛋白酶K处理后,发酵上清液仍然具有较强的抑菌活性(图5b),说明抑菌成分对蛋白酶K不敏感。实验结果表明,ge15菌株发酵液中的抑菌活性物质具有耐高温高压、耐蛋白酶水解的特性。
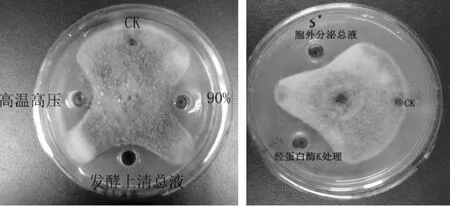
图5 发酵液中抑菌物质的稳定性
3 讨论
根据文献报道,枯草芽孢杆菌产生的分子量约为1000 Da的脂肽类抗生素对高温及蛋白酶具有良好的稳定性[5-6]。该类脂肽在溶液中达到特定浓度后会以聚合态的形式存在,并表现出蛋白质的某些特征,可通过硫酸铵沉淀法进行收集[7]。本文从ge15菌株发酵上清液中获取的抑菌活性成分与上述文献报道的脂肽类物质的理化特征相近,推测可能是结构相同或类似的脂肽类物质[8]。另外,本文用不同极性的有机溶剂萃取发酵上清液,发现极性较大的水饱和正丁醇萃取物具有较强的抑菌活性,说明ge15胞外分泌液中可能存在多种抗菌活性物质。
ge15菌株经鉴定为寡养单胞菌Stenotrophomonassp.,有关该细菌的报道主要集中在芴[9]、苦马豆素[10]、多环芳烃菲[11]、黄曲霉[12]等有毒有害物质的生物脱毒以及土壤、水体的修复[13]等研究领域,将该细菌用于植物病害防治的研究鲜有报道,仅见张泽坤等[14]报道杨树中的内生寡养单胞菌Stenotrophomonassp.对三倍体毛白杨和枫香组培苗的生根及幼苗生长有促进作用,但并未开展该菌株的次生代谢产物的成分分析。本文在对ge15菌株开展抑菌活性研究的基础上,就其次生代谢产物中的抑菌活性成分开展了初步研究,基本明确了抑菌活性物质的活性部位,这为菌株抑菌活性物质的分离纯化、结构鉴定及抑菌机理研究奠定了良好基础;另外,上述试验结果的获得也将有助于推动人参病害的生物防治。
[1] 吴连举,关一鸣,逄世峰,等.利用拮抗微生物防治人参、西洋参土传病害研究进展[J].安徽农业科学,2010,38(28):15630-15631,15657.
[2] 石晶盈,陈维信,刘爱媛.植物内生菌及其防治植物病害的研究进展[J].生态学报,2006,26(7):2395-2401.
[3] Rosenblueth M,Martínez-Romero E.Bacterial endophytes and their interactions with hosts[J].Mol Plant Microbe In,2006,19(8):827-837.
[4] 李勇,赵东岳,丁万隆,等.人参内生细菌的分离及拮抗菌株的筛选[J].中国中药杂志,2012,37(11):27-30.
[5] Kim Y S,Song J G,Lee I K,et al,Bacillussp.BS061 suppresses gray mold and powdery mildew through the secretion of different bioactive substances[J].Mycobiology,2013,41:64-166.
[6] Finking R,Marahiel M A.Biosynthesis of nonribosomal peptides[J].Annu Rev Microbiol,2004,58:453-488.
[7] 黄曦,张荣灿,王何健,等.枯草芽孢杆菌ON-6菌株抑制荔枝炭疽菌活性物质的初步研究[J].中国农学通报,2011,27(13):195-200.
[8] 汪澈,何月秋,张永庆,等.枯草芽孢杆菌B9601-Y2抑菌蛋白活性及产生条件的研究[J].植物病理学报,2005,35(1):30-36.
[9] 王晓朝.两株芴高效降解菌的分离鉴定及降解特性研究[D].江苏科技大学,2010.
[10] 赵兴华.苦马豆素降解菌分离、鉴定与特性研究[D].西北农林科技大学,2008.
[11] 杨滨银.多环芳烃菲降解菌的筛选、鉴定及其在土壤修复中的应用研究[D].新疆大学,2013.
[12] 王凯.黄曲霉生防菌的筛选鉴定及高效菌株JPP1的生防机制[D].哈尔滨工业大学,2013.
[13] 李顺鹏,蒋建东.农药污染土壤的微生物修复研究进展[J].土壤,2004,36(6):577-583.
[14] 张泽坤.氮利用内生细菌对几种植物生根及生长影响的研究[D].河北农业大学,2012.
Preliminary Study on Antagonistic Substance Produced by Ginseng Endophytic Bacterium ge15
LIU Min,DING Wanlong,HU Chenyun,GAO Yuan,LI Yong*
(Institute of Medicinal Plant Development,Beijing Union Medical College & Chinese Academy of Medical Sciences,Beijing 100193,China)
Objective:To study the antagonistic mechanism of ginseng endophytic bacterium ge15,and clarify the extraction method,active components and the stability of antagonistic substance.Methods:Antagonistic substances were acquired from fermentation broth of ge15 by ammonium sulfate precipitation,concentrated hydrochloric acid precipitation and saturated n-butanol extraction.Antagonistic activities of extracts were examined by oxford cup method.Results:All extracts from fermentation broth of ge15 showed antagonistic activity against ginseng pathogen,and the antagonistic activity of suspension hardly changed when treated by high temperature and protease K.Conclusion:Some antagonistic substances may produced by ge15,and which are stable to high temperature and protease K.
Panaxginseng;endophytic bacterium;antagonistic substance
10.13313/j.issn.1673-4890.2015.2.011
2014-09-21)
中央公益性科研院所基金项目(yz-12-17);协和青年科学基金项目(3332013113)
*
李勇,副研究员,研究方向:药用植物病害生物防治;E-mail:liyong@implad.ac.cn
