聚合酶链式反应-限制性片段长度多态性方法对太白贝母鉴别检验的适用性探讨△
2015-09-25张文娟尚柯魏锋马双成
张文娟,尚柯,魏锋*,马双成*
(1.中国食品药品检定研究院,北京 100050;2.成都市食品药品检验研究院,成都 610045)
·基础研究·
聚合酶链式反应-限制性片段长度多态性方法对太白贝母鉴别检验的适用性探讨△
张文娟1,尚柯2,魏锋1*,马双成1*
(1.中国食品药品检定研究院,北京 100050;2.成都市食品药品检验研究院,成都 610045)
目的:探讨聚合酶链式反应-限制性片段长度多态性方法(PCR-RFLP)对于太白贝母的适用性。方法:采集太白贝母野生及栽培品,收集市场上太白贝母伪品,利用性状、PCR-RFLP鉴别法、DNA序列分析三种方法分析太白贝母与常见伪品的区别。结果:从性状上看,太白贝母栽培品与伪品往往非常相似,较难辨别;通过PCR-RFLP方法可以正确、客观的鉴别太白贝母与常见伪品,基于ITS2 的DNA条形码方法进一步验证了PCR-RFLP法的准确性。市场上太白贝母的伪品多为伊犁贝母。结论:PCR-RFLP鉴别法可准确鉴别太白贝母与其伪品;市场上太白贝母伪品较多,应加强监管。
太白贝母;伊犁贝母;鉴别;性状;聚合酶链式反应-限制性片段长度多态性方法(PCR-RFLP);内转录间隔区(ITS)
太白贝母FritillariataipaiensisP. Y. Li为百合科贝母属多年生草本植物,其干燥的鳞茎作为药用。根据《城口厅志》记载,早在清道光二十三年 (公元1843 年) 城口就有贝母药用[1]。《中华人民共和国药典》 2010 版将太白贝母作为川贝母的原植物收载[2],这给太白贝母资源的开发带来了机遇,同时也给太白贝母野生资源的保护带来了新的挑战,增加了紧迫感。
野生太白贝母资源主要分布在大巴山、巫山及武陵山海拔1860~2500 m 的山坡草丛或灌木丛中,资源稀少,呈带状或片块状分布。太白贝母又称尖贝、川东贝母,主产重庆市巫溪、城口和陕西太白县,具有引种栽培适应性强、产量高的特点,为目前川贝母中最易栽培的品种之一,目前市场上的太白贝母以栽培品为主[3-4]。
太白贝母栽培品的出现也带来了新的问题。有些栽培品与市场上川贝母的常见伪品(如伊贝母)相比,在外观上非常相似,给鉴别检验带来了一定的困难。《中华人民共和国药典》 2010 版 第一增补本中,收录了基于ITS序列的川贝母PCR-RFLP鉴别法[5]。ITS(internal transcribed spacer)是核糖体RNA基因的非转录区,包括ITS1和ITS2两个部分。该区域在物种内差异不大,然而种间差异较明显,因而非常适用于植物分类学研究和中药材的基原鉴定[6,7]。PCR-RFLP鉴别法即在PCR 的基础上,对特异片段进行切割,如果酶切位点发生了突变,便不能被切割;片段是否被切割可以通过琼脂糖凝胶电泳法检测。由于川贝母基因组rDNA的ITS1区段存在限制性内切酶SmaI的识别位点,而贝母属其他品种在该区域没有这一位点,因此可以用这种方法区别川贝母和其他贝母[8]。
该方法从DNA角度对样品进行分析鉴别,不受外观变异的影响,也不易被药材取样部位、放置时间等因素干扰,结果客观、稳定、准确。川贝母基原多样、外观多变,一直以来其真伪鉴别是个难点问题,而该方法的出现无疑为解决这一难题提供了强有力的武器。检验人员在用该方法检验“太白贝母”样品时,发现较多批次不合格,其中多为栽培品。这些被判为了不合格的“太白贝母”本来就是伪品,还是发生了栽培变异,从而导致该方法不适合太白贝母栽培品的检验?为了揭开这一疑问,我们收集了太白贝母野生品和栽培品,以及市场上太白贝母的样品,对这些样品进行性状、PCR-RFLP以及DNA条形码分析,结果发现正品太白贝母具有符合药典标准的性状特征,PCR-RFLP法检验亦符合药典相关标准规定,PCR-RFLP法检验判定为不合格的太白贝母样品,用基于ITS2的DNA条形码方法进一步得到了验证。我们的研究结果提示,PCR-RFLP法适用于太白贝母的鉴别检验;市场上太白贝母伪品较多,以伊贝母最为常见。本研究肯定了PCR-RFLP法在太白贝母鉴别中的适用性,在一定程度上揭示了太白贝母的市场状况,为其市场监控检验提供了理论和技术指导。
1 仪器材料与方法
1.1 仪器和材料
1.1.1 仪器
PCR仪(ABI VERITI),分析天平(Mettler AB135-S),纯水仪(Millipore公司),电泳仪(EPS-301,Amersham),全自动凝胶成像系统(SyngeneGeneGenius),球磨仪(M400,Retsch),微量紫外分光光度计,水浴锅。
1.1.2 试剂
快捷型植物基因组提取试剂盒(DP321,天根生化科技有限公司),Ex Taq(DRR100B,TaKaRa),dNTP Mixture 10 mM(N0447,New England Biolabs),Sma I(R0141,New England Biolabs) GelRed(41003,Biotium),琼脂糖(BLOWEST),GelRed(Biotium),Tris碱,冰醋酸,EDTANa22H2O(国药集团化学试剂有限公司),引物(华大基因)上游:5‘-CGTAACAAGGTTTCCGTAGGTGAA-3’下游:5‘-GCTACGTTCTTCATCGAT-3’,用于测序的引物(华大基因)上游:5’-GGAAGTAAAAGTCGTAACAA GG-3’,下游:5’-TCCTCCGCTTA TTGATATGC -3’。
1.2 方法
1.2.1 样品来源 本实验所用太白贝母野生品为野外采集并经过相关专家确认,栽培品部分采自栽培基地,部分为厂家送样。
1.2.2 样品处理 取太白贝母样品一粒,用酒精棉球将表面擦拭干净,晾干;用球磨仪磨成极细粉末,称取粉末样品约30 mg备用。
1.2.3 DNA提取和定量分析 按照基因组DNA提取试剂盒说明书进行操作。用微量紫外分光光度计进行DNA定量。
1.2.4 聚合酶链式反应(PCR)反应条件
预变性94 ℃ 5 min
反应循环(35轮) 94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s
最后延伸 72 ℃ 5 min
1.2.5 SmaI酶切反应:反应体系20 μL——取PCR产物10 μL,加入SmaI 0.5 μL,反应缓冲液2 μL,高压蒸汽灭菌的去离子水7.5 μL。
1.2.6 琼脂糖凝胶电泳及凝胶成像:使用1.5%琼脂糖凝胶进行电泳,电压5V/cm,约40 min;之后使用紫外凝胶成像仪拍照并保存结果。1.2.7 序列测定:PCR反应条件:预变性94 ℃ 5 min;反应循环(35轮)94 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s;最后延伸 72 ℃ 5 min。PCR反应体系25 μL:DNA模板1 μL,上下游引物各0.2 μL,Taq DNA聚合酶0.2 μL,dNTP(10 mM)0.6 μL,反应缓冲液2.5 μL,高压蒸汽灭菌的去离子水(ddH2O)20.3 μL[5]。PCR样品送华大基因完成测序。
1.2.8 序列分析:用Codoncode Aligner 4.06(Codoncode Co.,USA)软件进行序列拼接及校对,去除序列两端的低质量部分。利用ITS2数据库(http://its2-old2.bioapps.biozentrum.uni-wuerzburg. de/cgi-bin/index.),去除序列两端5.8S和28S区域,获得完整的ITS2序列。用MEGA5.0软件,对不同样品的ITS2序列进行比对(Clustal W)及变异位点分析。
2 结果
2.1 性状特征
收集野生太白贝母样品10批,太白贝母栽培品10批及以太白贝母送检的样品6批。野生样品由中国食品药品检定研究院张南平老师鉴定。
野生太白贝母以青贝多见,即类扁球形,鳞叶大小悬殊,大瓣与小瓣抱合不紧;顶部闭合,先端尖;小瓣中下部近等宽,先端渐尖;大瓣基部明显隘缩状。高0.4~1.0 cm,直径0.6~1.1 cm,呈黄白色,表面较粗糙,有褐色斑点,气微,略苦。
太白贝母栽培品在性状上变异较大,呈类长圆柱形,鳞叶大小悬殊,抱合紧密;顶部闭合,先端钝圆,基部明显隘缩状。高0.7~1.8 cm,直径0.9~1.6 cm。表面及气味特征似野生品种。
以“太白贝母”送检的6批样品,多呈类圆锥或圆柱形,外层鳞叶两瓣,肥大,一片较大或近等大,抱合。顶端稍尖,少有开裂,基部微凹陷。与野生太白贝母及其栽培品相比,个头较大,一般高1.5~2.0 cm,直径1.0~1.5 cm。表面及气味特征与野生和栽培太白贝母无明显差异(图1,表1)。
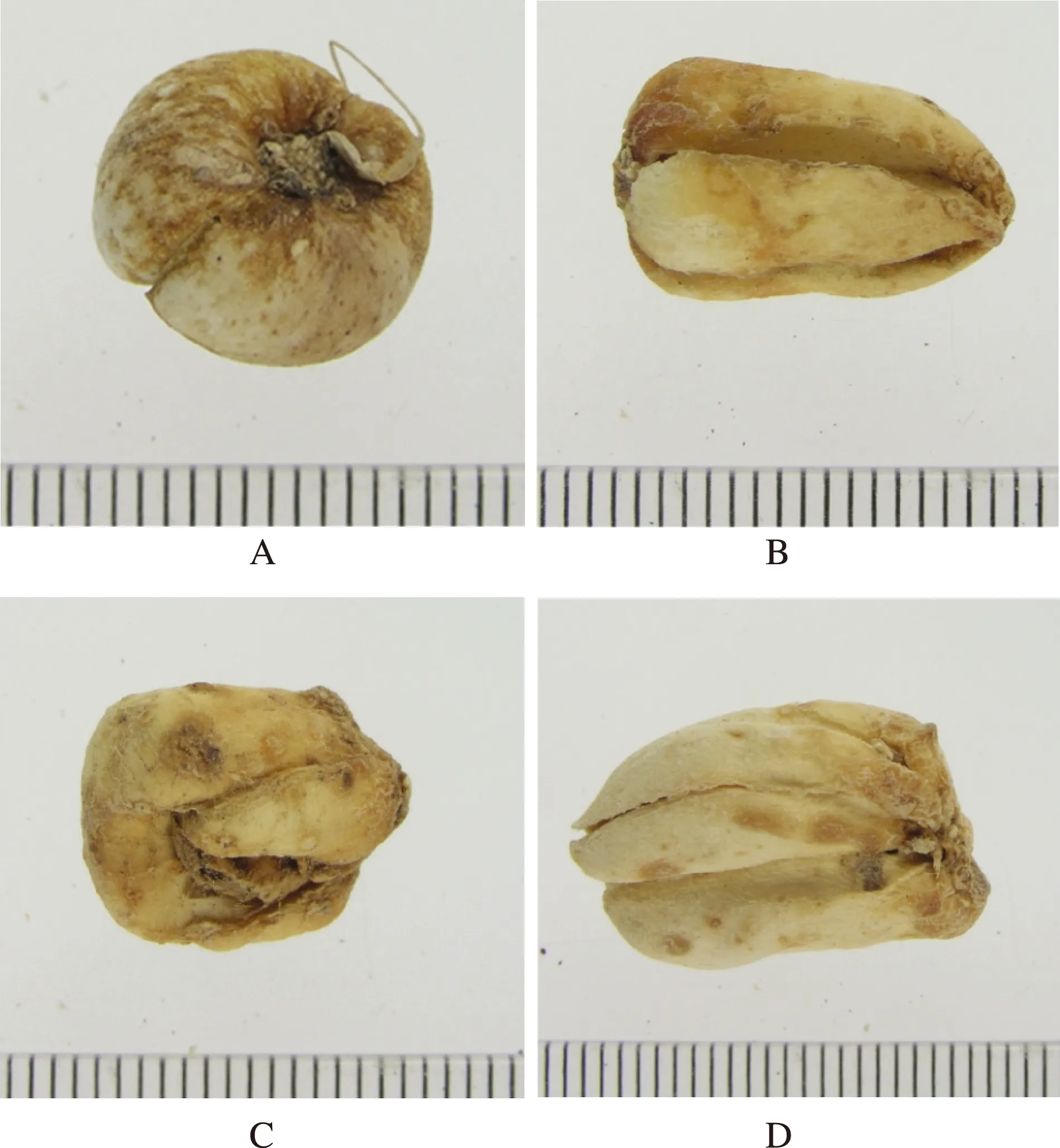
A 太白贝母(野生);B 太白贝母(栽培);C和D:太白贝母伪品(伊贝母)图1 太白贝母及伪品伊贝母

样品名称形状大小色泽表面气味太白贝母(野生)呈类扁圆锥形,鳞叶大小悬殊,大瓣与小瓣抱合不紧;顶部闭合,先端尖;小瓣中下部近等宽,先端渐尖;大瓣基部明显隘缩状高0.4~1.0cm,直径0.6~1.1cm黄白色较粗糙,有褐色斑点气微,味微苦太白贝母(栽培)呈类长圆柱形,鳞叶大小悬殊,抱合紧密;顶部闭合,先端钝圆,基部明显隘缩状高0.7~1.8cm,直径0.9~1.6cm黄白色较粗糙,有褐色斑点气微,味微苦伪品(伊贝母)呈类圆柱形,外层鳞叶两瓣,肥大,一片较大或近等大,抱合。顶端稍尖,少有开裂,基部微凹陷。高1.5~2.0cm,直径1.0~1.5cm黄白色较粗糙,有褐色斑点气微,味微苦
2.2 PCR-RFLP结果
按照《中华人民共和国药典》2010版第一增补本 川贝母项下的PCR-RFLP鉴别法,我们对这些太白贝母样品进行了检测。所有野生太白贝母样品的PCR产物都能够被限制性内切酶Sma I切成两个片段,大小位于100~250bp,即符合《中华人民共和国药典》的相关规定。太白贝母栽培品10批中有8批也得到相同的结果;另有2份栽培品,其PCR产物不能被 Sma I 酶切,即不符合《中华人民共和国药典》的相关规定(图2,3,4)。所有标为“太白贝母”的待检样品,其PCR产物均不能被 Sma I 酶切。DNA测序结果提示,这些不符合《中华人民共和国药典》相关规定的“太白贝母”样品实际为伊犁贝母。
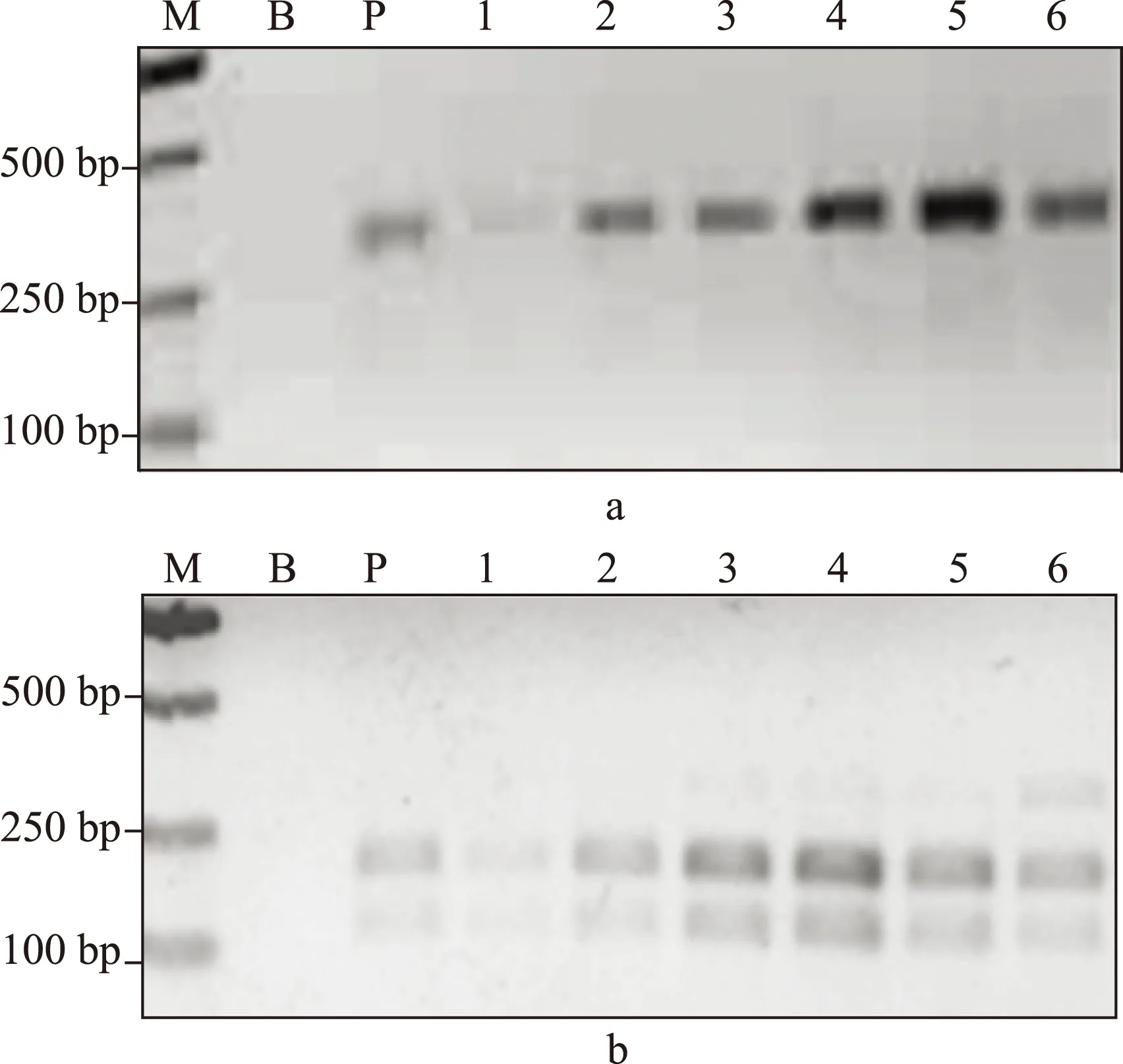
a:PCR产物;b:PCR产物被SmaI酶切后;1-6:太白贝母(野生);M:DNA分子量标记;B:空白对照;P:阳性对照图2 太白贝母(野生)的PCR-RFLP结果
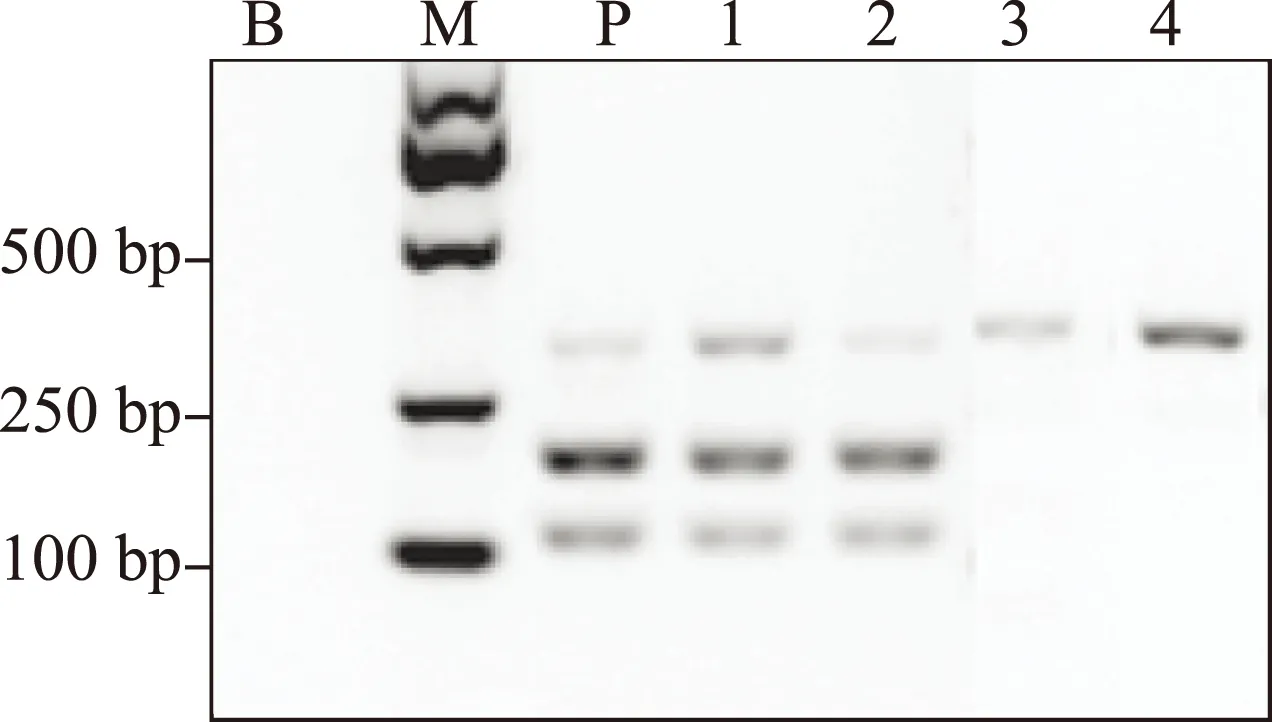
1-4:太白贝母(栽培);M:DNA分子量标记;B:空白对照;P:阳性对照图3 太白贝母(栽培)的PCR-RFLP结果
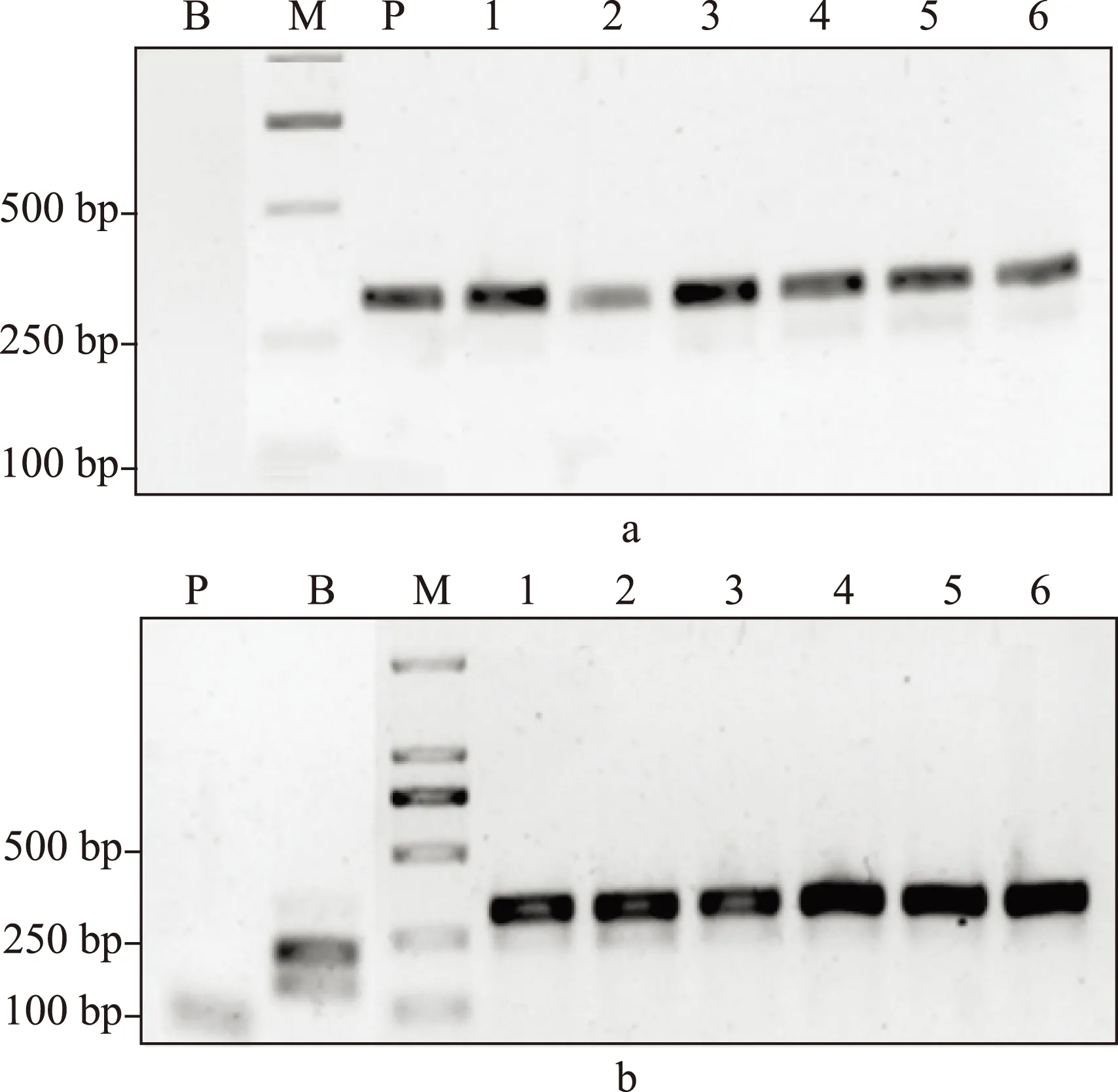
a:PCR产物;b:PCR产物被 SmaI酶切后;1-6:太白贝母检品 M:DNA分子量标记;B:空白对照;P:阳性对照图4 太白贝母检品的PCR-RFLP结果
2.3 以ITS2作为分子标记的DNA条形码和序列分析
我们选择被PCR-RFLP鉴定法判定为不符合规定的样品及部分正品的PCR产物进行测序,得到样品DNA的ITS2区段,BLAST检索NCBI的核酸数据库,得到样品的基原信息,用以佐证PCR-RFLP的结果。被PCR-RFLP方法判定为合格的样品,确实为太白贝母;而判定为不合格的太白贝母样品,DNA条形码方法的分析结果为伊犁贝母(表2)。即两种方法的结果是一致的,说明PCR-RFLP法可以用于太白贝母的检验。
进一步对样品DNA的ITS2 序列进行分析,发现太白贝母的ITS2为238bp,伊犁贝母为239bp,二者之间共存在12处变异,其中伊犁贝母在ITS2序列的第34位插入了一个“G”,因此总长度比太白贝母多一个碱基(图5)。
3 讨论
按照《中华人民共和国药典》2010版第一增补本的规定,太白贝母被作为川贝母来源之一[5]。因其引种栽培适应性强、产量高,故市场上的太白贝母以栽培品多见[3-4]。然而栽培品性状变异较大,与其它贝母属植物来源的贝母(如伊犁贝母)相似度较高,因此仅依靠性状鉴别往往难以得出真伪与否的结论。PCR-RFLP鉴别法与仅凭肉眼观察的形状鉴别法相比,客观,准确,很好的解决了这一难题[5]。然而,利用该方法对市场上的太白贝母进行检验之后,发现很少有合格产品。面对这种情况,检验人员不禁产生了疑虑:究竟是市场上太白贝母伪品多,还是该PCR-RFLP鉴别法不适用呢?本研究通过对基原明确的太白贝母样品以及检品,同时进行性状、PCR-RFLP和DNA条形码的分析,明确了正品太白贝母,无论野生还是栽培品,均应符合《中华人民共和国药典》2010版第一增补本川贝母项下PCR-RFLP鉴别法的规定进行测序的样品中,有2批(符合和不符合PCR-RFLP鉴别法规定的各有1批)样品测序结果因严重套峰而导致测序失败。溯源样品发现这两批样品真菌污染非常严重,可能PCR产物中存在真菌ITS的污染,从而导致测序套峰的出现。尽管我们尽可能去除真菌污染部分之后,重复试验并再次送样测序,仍然是严重套峰的结果。ITS存在多拷贝现象[9],也可导致套峰的出现。究竟是因为真菌污染还是ITS多拷贝,目前尚不清楚。
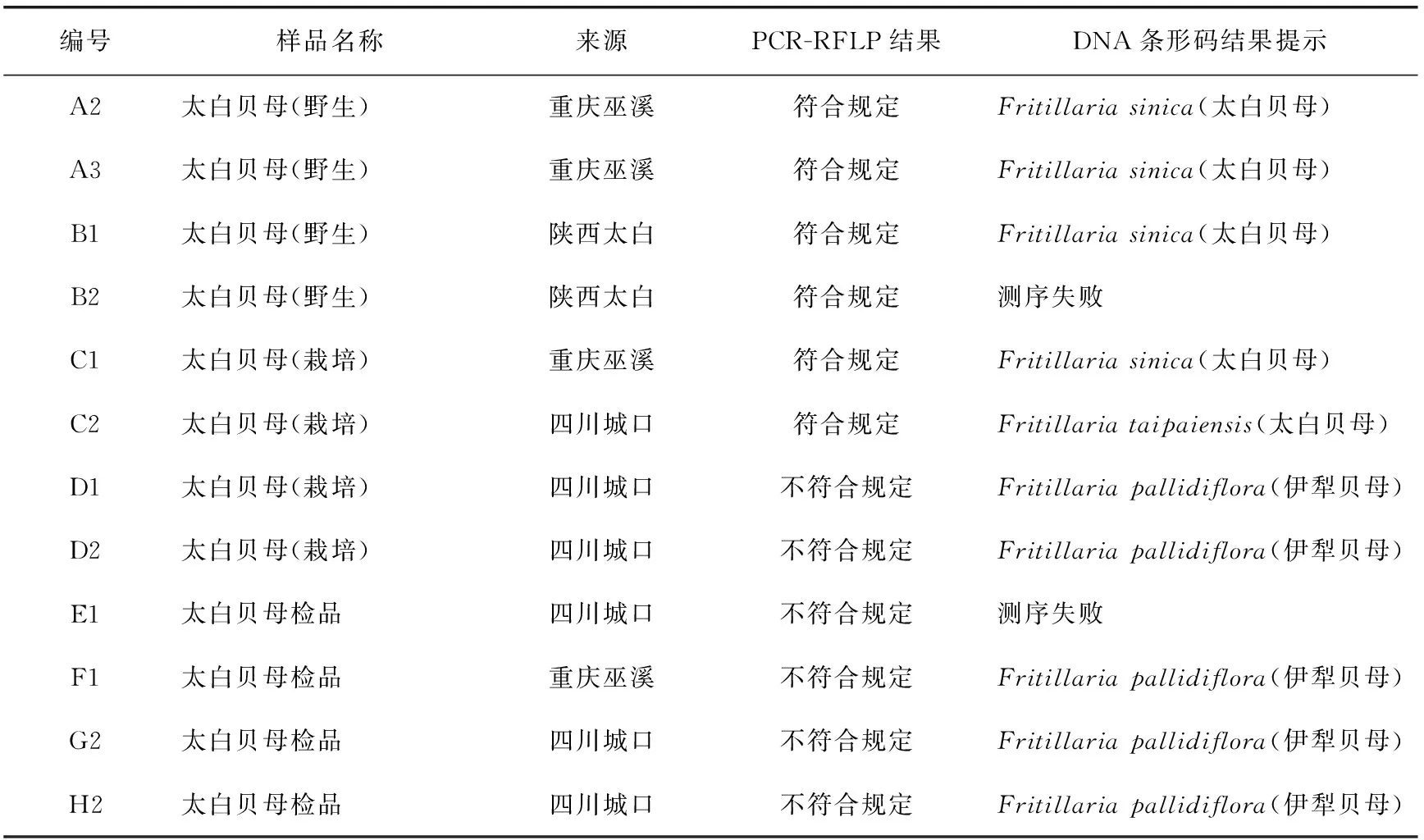
表2 样品信息及对应的PCR-RFLP、DNA条形码鉴定结果
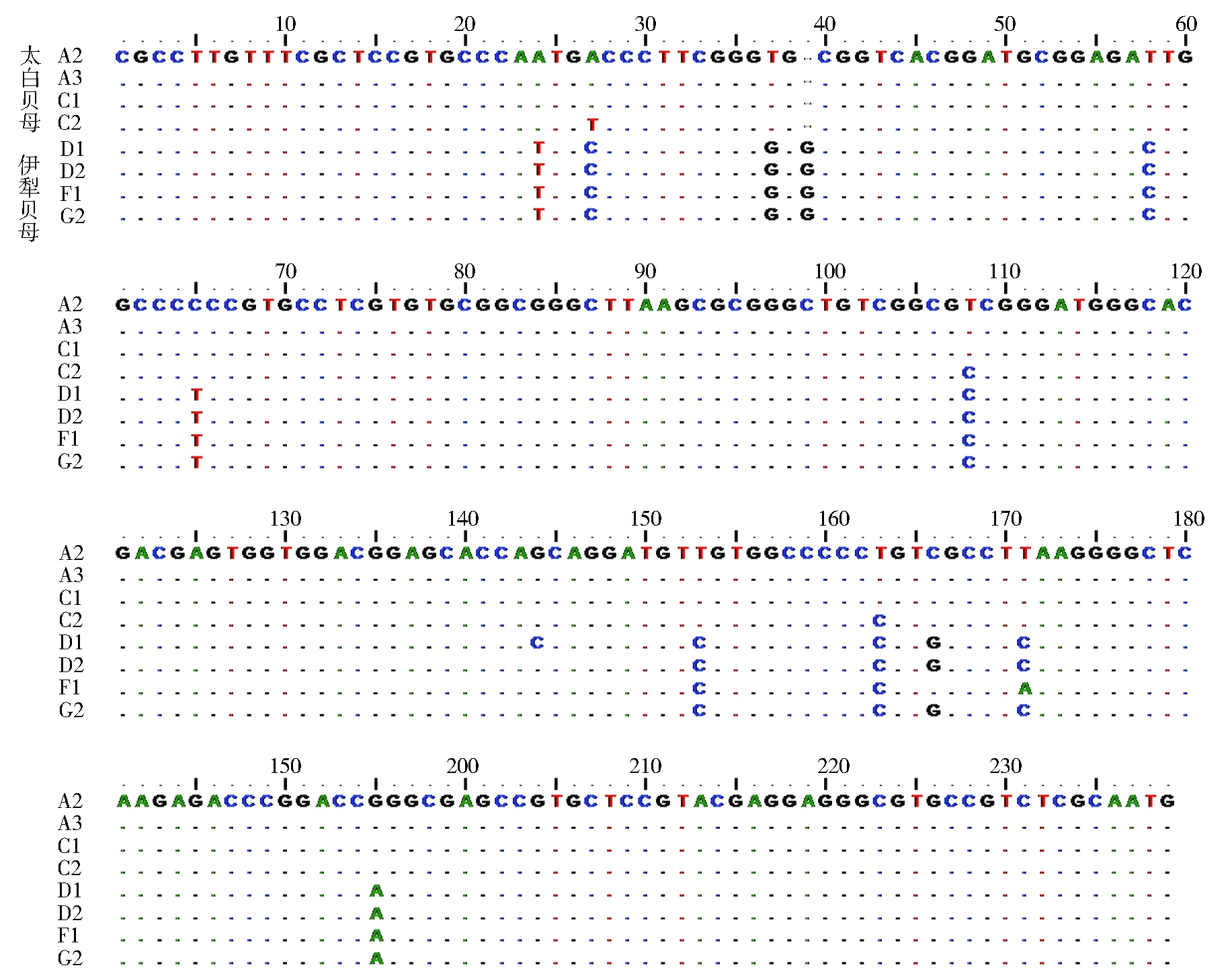
图5 太白贝母与常见混伪品伊犁贝母的序列比对分析
在本研究中,DNA条形码技术作为对PCR-RFLP结果的验证方法,起到了关键性作用。由于可以精确知晓待鉴定药材的基因序列,DNA条形码的方法较之其他的DNA分子鉴别法,其结果更为准确、可靠。因此,当我们在实际工作中遇到用其他方法难以鉴别的中药材时,可采用该方法予以检验,从而得到比较确定的结论。目前,中药材DNA条形码方面的应用研究已有较大进展:对于现行《中华人民共和国药典》收录的绝大多数中药材品种,已获得其准确的DNA条形码序列;并且,在此基础上,将二维码技术与DNA条形码技术相结合,为每个药材基原物种提供标准二维DNA条形码,有利于DNA条形码信息在不同平台间转换,为二维DNA条形码技术在实际流通监管工作中的应用提供理论基础,能有效实现对中药材流通的数字化监管,推动中药材流通监管现代化、国际化进程。这些研究成果为DNA条形码在中药材鉴定中的应用打下了良好的基础。由陈士林教授课题组起草的“中药材DNA条形码分子鉴定指导原则”已收录入《中华人民共和国药典》,表明该技术面向应用迈出了坚实的一步,未来的应用前景十分广阔[10-13]。本研究结果提示,市场上太白贝母伪品较多,需加强监管力度。在未来,如果二维DNA条形码技术得到推广应用,相信类似贝母这样基原复杂中药材的市场乱象将得到很好控制。
[1] 城口县志办. 城口厅志[M]. 1843,18:160.
[2] 国家药典委员会. 中华人民共和国药典:一部 [S].北京:中国医药科技出版社. 2010:34.
[3] 付绍智. 长江三峡地区野生太白贝母的生态类型与保护对策[J] 时珍国医国药,2012,23(8):2018-2019.
[4] 沈力,周浓,付绍智.太白贝母栽培品的生药学研究 [J] 中药材,2014,37(1):45-49.
[5] 国家药典委员会. 中华人民共和国药典:第一增补本 [S].2010:83.
[6] Yao H,Song J,Liu C,et al. Use of ITS2 region as the universal DNA barcode for plants and animals[J]. PloS one,2010,5(10):e13102.
[7] China Plant BOL Group,Li D Z,Gao L M,et al. Comparative analysis of a large dataset indicates that internal transcribed spacer (ITS) should be incorporated into the core barcode for seed plants[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(49):19641-19646.
[8] 张文娟,刘薇,魏锋,等. 聚合酶链式反应-限制性片段长度多态性法用于检定川贝母掺伪情况的研究[J]. 药物分析杂志,2014,34(10):127-132.
[9] Song J,Shi L,Li D,et al. Extensive Pyrosequencing Reveals Frequent Intra-Genomic Variations of Internal Transcribed Spacer Regions of Nuclear Ribosomal DNA[J]. PLoS ONE,2012,7(8):e43971.
[10] 陈士林. 中国药典中药材DNA条形码标准序列[M].北京:科学出版社,2015.
[11] Chen S L,Pang X H,Song J Y,et al. A renaissance in herbal medicine identification:from morphology to DNA [J]. Biotechnol Adv,2014,32(7):1237-1244.
[12] 陈士林,姚辉,韩建萍,等. 中药材DNA条形码分子鉴定指导原则[J]. 中国中药杂志,2013,38(2):141-148.
[13] 辛天怡,李西文,姚辉,等. 中药材二维DNA 条形码流通监管体系研究[J]. 中国科学:生命科学,2015,45:695-702.
Applicability of PCR-restriction Fragment Length Polymorphism Method in Identification of Fritillaria taipaiensis Bulbus
ZHANG Wenjuan1,SHANG Ke2,WEI Feng1*,MA Shuangcheng1*
(1.National Institutes for Food and Drug Control,Beijing 100050,China;2.Chengdu Institutes for Food and Drug Control,Chengdu 610045,China)
Objective:To explore the applicability of polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) on identification of Fritillaria taipaiensis Bulbus.Methods:The samples of wild and cultivatedF.taipaiensisand the samples from the market were colleeted, and they were identified from the common adulterants adulterants based on characteristics,PCR-RFLP,and DNA sequence analysis.Results:It was difficult to identifyF.taipaiensisfrom its adulterants by characteristics as they showed similar appearance. With the method of PCR-RFLPF.taipaiensiswas accurately and objectively identified,which was further verified by DNA barcoding based on ITS2. On the market,most of the adulterants ofF.taipaiensiswereF.pallidiflora.Conclusion:The method of PCR-RFLP could be successfully applied in the identification ofF.taipaiensis. The adulterants ofF.taipaiensison the market are so common that its quality control needs to be strengthened.
Fritillariataipaiensis;F.pallidiflora;identification;characteristics;polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP);internal transcribed spacer (ITS)
10.13313/j.issn.1673-4890.2015.9.006
2015-08-03)
国家自然科学基金青年科学基金项目(31200673);重大新药创制国家科技重大专项(2014ZX0930437001,2014ZX0930437002)
*
马双成,博士,研究员,研究方向:中药材检验与质量标准研究;Tel:(010)67095272,E-mail:masc@nifdc.org.cn 魏锋,博士,研究员,研究方向:中药材检验与质量标准研究;Tel:(010)67095432,E-mail:weifeng@nifdc.org.cn