超声波对草鱼肌肉肌原纤维蛋白溶液理化特性的影响
2015-09-22常海霞石燕王辉黄小琴李瑞平包中宇涂宗财
常海霞,石燕,王辉,黄小琴,李瑞平,包中宇,涂宗财,,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.江西师范大学生命科学学院,江西南昌330022)
超声波对草鱼肌肉肌原纤维蛋白溶液理化特性的影响
常海霞1,石燕1,王辉1,黄小琴2,李瑞平1,包中宇1,涂宗财1,2,*
(1.南昌大学食品科学与技术国家重点实验室,江西南昌330047;2.江西师范大学生命科学学院,江西南昌330022)
采用超声波技术对草鱼肌原纤维蛋白进行处理,通过分析处理前后肌原纤维蛋白粒度、表面疏水性、巯基含量及分子质量等结构信息的变化,研究超声波对草鱼肌肉肌原纤维蛋白溶液理化特性的影响。结果表明:超声波处理可使草鱼肌原纤维蛋白颗粒分布更加均匀,肌原纤维蛋白颗粒粒径、热聚集程度、内源荧光强度及巯基含量降低,且随着处理时间的增加,降低的幅度增加,肌原纤维蛋白颗粒平均粒径最小可达270.3nm。处理后的肌原纤维蛋白表面疏水性增加,分子质量无明显变化。这说明超声波可诱导草鱼肌原纤维蛋白分子展开,使疏水基团等暴露,高级结构受到破坏,蛋白颗粒发生解聚集,但对肌原纤维蛋白一级结构无影响。
超声波;肌原纤维蛋白;粒度;热聚集;巯基;分子质量
草鱼是著名的“四大家鱼”之一,其肉质肥嫩,味鲜美,营养丰富,蛋白质含量高,最高可达26%[1]。草鱼肌肉蛋白中主要含肌原纤维蛋白、肌浆蛋白和基质蛋白,其中肌原纤维蛋白约占总蛋白的60%~70%[2],是草鱼肌肉蛋白的主要成分。肌原纤维蛋白是盐溶性蛋白,具有凝胶性、持水性、乳化性等优良性质,不仅可作为功能性蛋白成分广泛应用于食品工业中,而且是鱼糜制品的功能成分,其结构与性质直接影响鱼糜制品的形成,进而影响鱼肉制品的品质[3]。但草鱼肌原纤维蛋白存在凝胶强度差、易发生冷冻变性等缺陷[4],因此有必要对其进行改性。目前的研究主要集中在pH值、提取方法以及添加糖、卡拉胶、谷氨酰胺转氨酶(transglutaminase,TG)等化学改性对其功能性质的影响。Li Xingke等[5]研究发现,用脱乙酰度为77.3%的壳聚糖修饰鲢鱼肌原纤维蛋白具有很好的改性效果;Chen Hongsheng等[6]研究发现,冷冻保护剂的加入使鲤鱼鱼糜肌原纤维蛋白热稳定性、凝胶性得到提高。但上述研究具有低效率、耗时、耗能、成本高等缺点。
超声波对食品中生物大分子的改性具有较好的效果,其通过机械效应、空化效应、热效应和化学效应作用于接触它的物质,使底物的物理、化学反应变得快速、均匀[7-8],具有效率高、成本低、操作简单、污染小等优点,因此,在食品加工中的应用备受关注。张崟等[9]研究发现,超声波处理提高了鱼糜的凝胶强度、黏性、弹性、恢复性等;Julian McClements等[10]研究表明,超声波可以促进肌原纤维蛋白的释放,进而提高了肉制品的持水性、嫩度、黏结性等理化性质。然而,超声波对肌原纤维蛋白理化特性的影响鲜有报道。
由于蛋白质的理化特性与蛋白质的功能性质有很大的关系,其理化特性的改变可以引起蛋白质功能性质的改变。因此本实验以草鱼肌原纤维蛋白为原料,研究超声波处理对肌原纤维蛋白理化特性的影响,以期为超声波改性肌原纤维蛋白提供理论基础。
1 材料与方法
1.1材料与试剂
草鱼,购于南昌市青山湖区天虹超市。
十二磺基硫酸钠、丙烯酰胺、过硫酸铵等(分析纯)阿拉丁试剂有限公司;8-苯胺-1-萘磺酸(8-aniline-1-naphthalene sulfonic acid,ANS)、β-巯基乙醇、25~170kD Marker美国Sigma公司。
1.2仪器与设备
T6新世纪紫外-可见分光光度计北京普析通用仪器有限公司;HR2094飞利浦搅拌机飞利浦家庭电器有限公司;ML104电子天平、DZG-6021P pH计梅特勒-托利多有限公司;HH-4数显恒温水浴锅国华电器有限公司;JY98-ⅢDN超声波细胞粉碎机宁波新芝生物科技股份有限公司;F-7000荧光光谱仪日本日立公司;Mini Protean Tetra MP4电泳仪美国伯乐公司;NICOMPTM380激光纳米粒度测定仪美国Nicomp公司。
1.3方法
1.3.1肌原纤维蛋白的提取
参照Liu Qian等[11]的方法从草鱼肌肉中提取肌原纤维蛋白。生鲜草鱼去皮、骨、内脏,所得鱼肌肉用搅拌机打碎,鱼糜加入4倍体积(m/V)的0.02mol/L pH7.5的磷酸盐缓冲溶液,用搅拌机搅拌匀浆60s,肌肉匀浆液于4℃、2000×g离心15min,取其沉淀,用上述磷酸盐缓冲溶液(4倍体积)在相同的搅拌和离心条件下洗涤3次以上,得到的沉淀再用4倍体积0.1mol/L的NaCl溶液在上述相同的条件下洗3次,最后一次离心前,用3层纱布过滤以除去肌肉匀浆液中的结缔组织。得到的沉淀用0.02mol/L pH6.5含0.6mol/L NaCl的磷酸盐缓冲液溶解,该溶液即为肌原纤维蛋白溶液,于4℃储存备用。肌原纤维蛋白的质量浓度采用双缩脲法进行测定,以牛血清白蛋白为标准品[12]。
1.3.2肌原纤维蛋白的超声波处理
将肌原纤维蛋白溶液稀释至质量浓度10mg/mL,取200mL该溶液于连有冷却管套的双层玻璃烧杯中,将烧杯置于超声波细胞破碎仪中(超声探头为频率20kHz,直径15mm的钛金属探头),设置超声时间为0、3、6、9、12、20min(工作时间和间歇时间分别为1s和3s),超声功率设为480W,冰水通过冷却套管持续循环,控制样品温度为4~8℃,处理后的样品于0~4℃冰箱内储存备用[13]。
1.3.3粒度的测定
参考Zhang Qiuting等[14]的方法,肌原纤维蛋白溶液用0.02mol/L pH6.5含0.6mol/L NaCl的磷酸盐缓冲液稀释2倍,采用NICOMP380/ZLS激光纳米粒度测定仪对样品的平均粒径进行测定。
1.3.4热聚集程度的测定
在鱼糜产品加工过程中,热处理是塑造肌原纤维蛋白凝胶特性的重要手段,其主要作用来源于蛋白的热聚集行为的变化。本实验参考Li Yanqing等[15]的方法,肌原纤维蛋白溶液用0.02mol/L pH6.5含0.6mol/L NaCl的磷酸盐缓冲液稀释至质量浓度为1mg/mL,将稀释后的样品从30℃加热到80℃,分别选择加热至30、40、50、60、70、80℃时测定样品在600nm波长处的吸光度。
1.3.5总巯基含量的测定
参考Liu Qian等[11]的方法,肌原纤维蛋白溶液用0.02mol/L pH6.5含0.6mol/L NaCl的磷酸盐缓冲液稀释至2mg/mL,取1mL稀释后的蛋白与8mL缓冲溶液(0.086mol/L Tris-HCl、0.09mol/L Gly、0.004mol/L乙二胺四乙酸二钠盐(ethylenediaminetetraacetic acid disodium salt,EDTA)、8mol/L尿素,pH8.0)混合,于8000×g离心15min。取4.5mL上清液于10mL离心管中,加入0.5mL Ellman’s试剂(0.01mol/L5,5’二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)),漩涡振荡后,于412nm波长处测吸光度。
Ellman’s试剂的配制:0.198175g DTNB用50mmol/L Na2HPO4(pH7.0)配制成50mL溶液,于棕色瓶中,暗处低温储存备用。
1.3.6自由巯基含量的测定
取1mL2mg/mL的肌原纤维蛋白溶液于8mL缓冲溶液(0.086mol/L Tris-OH、0.09mol/L Gly、0.004mol/L EDTA、8mol/L尿素,pH8.0)中,于8000×g离心15min,取其上清液测定自由巯基的含量测定方法同总巯基含量的测定,自由巯基的含量按以下公式计算。
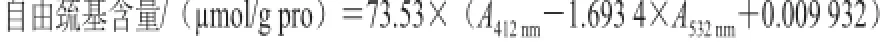
式中:A412nm和A532nm分别代表反应溶液在412nm和532nm波长处的吸光度。
1.3.7内源性荧光和表面疏水性的测定
蛋白溶液用样品缓冲液稀释至质量浓度1mg/mL后,以280nm为激发波长测定肌浆蛋白溶液在300~400nm范围内的发射光谱,分析其内源荧光强度的变化。
参照Chelh等[16]的方法。样品溶液采用样品缓冲溶液分别稀释为质量浓度0.5、1.0、1.5mg/mL。取50μL稀释后的样品于20mL、0.008mol/L ANS磷酸盐缓冲液(0.1mol/L,pH7.0)中,混匀并定容至4mL。使用F-7000荧光分光光度计分析样品的表面疏水性,激发波长为338nm,发射波长为496nm,扫描速率200nm/min,以未加荧光探针的相应质量浓度的蛋白质溶液所测得的荧光强度作为空白。以蛋白质质量浓度(mg/mL)对荧光强度作图,采用线性回归分析进行曲线拟合,直线的斜率即是蛋白质的表面疏水性(H0)。
1.3.8分子质量分析
参考Zhou Feibai等[17]的方法,电泳条件:5%浓缩胶,10%分离胶,4倍上样缓冲液,上样量8 μL,电流12mA,分离胶电压24mA,Marker为低分子质量(25~170kD)。用考马斯亮蓝G250染色45min后脱色,直至背景清晰。
1.4数据处理与统计学分析
2 结果与分析
2.1超声波对肌原纤维蛋白粒度的影响
蛋白质的粒度是影响蛋白质功能特性的因素之一[18],也是蛋白质结构的宏观表现。前期研究表明,超声波处理可改变蛋白颗粒粒度。由图1A可知,超声波处理可明显降低肌原纤维蛋白的平均粒径,且随着处理时间的延长,降低的程度增大,肌原纤维蛋白的平均粒径由未处理的2211.4nm降低至处理20min的270.3nm。可能是由于超声波的声空化作用可产生强烈的物理作用力,包括剪切力、震波和湍流,能有效使蛋白质颗粒发生破碎,粒度下降。由图1B可知,超声波处理后肌原纤维蛋白溶液的平均粒径降低,未经超声波处理的肌原纤维蛋白粒径分布范围为200~2300nm,而经超声波处理后的肌原纤维蛋白粒径分布范围变为100~5000nm,这表明,超声波处理可以显著影响肌原纤维蛋白溶液的粒径分布范围,使得肌原纤维蛋白溶液的粒径分布更集中,分布宽度变窄,即颗粒大小更加均匀。

图1 超声波处理对肌原纤维蛋白平均粒径(AA)和粒度分布(BB)的影响Fig.1Effect of ultrasonic treatment on the mean part icle diameter(A)and particle distribution(B)of myofibrillar protein
2.2超声波对肌原纤维蛋白热聚集的影响

图2超声波处理对肌原纤维蛋白热聚集的影响Fig.2Effect of ultrasonic treatment on the thermal aggregation of myofibrillar protein
肌原纤维蛋白热变性聚集能反映蛋白质构象的变化以及分子间相互作用,包括氢键、二硫键、肽键等之间的相互作用[19]。浊度是反映蛋白质聚集程度的指标,肌原纤维蛋白经超声波处理后在加热过程中其浊度变化如图2所示,超声波处理可以明显降低肌原纤维蛋白的浊度,且随着处理时间的延长,降低的程度也增大。与原样相比,经超声处理3、6、9、12、20min后,其加热至80℃时的浊度分别降低了57.8%、66.8%、67.5%、75.0%、70.1%,可能的原因是超声波对溶液体系的空化效应产生强烈的剪切力、震波、湍流等物理作用力[20],蛋白颗粒发生了聚集,其热变性聚集程度降低。一般情况下,随着加热温度的升高,蛋白分子会发生变性,蛋白分子间会发生聚集,温度越高,聚集程度越高,但经超声波处理后,样品的浊度随温度增加而增加趋势明显变缓,说明超声波处理削弱了加热对肌原纤维蛋白分子的变性聚集作用。以上结果表明,超声波对肌原纤维蛋白具有去聚集作用,能抑制蛋白质与蛋白质之间的共价和非共价交联。
2.3超声波对肌原纤维蛋白内源荧光和表面疏水性的影响
蛋白质具有内源荧光性,蛋白质分子中色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)能发射荧光[21],因此可以通过荧光光谱分析蛋白质分子结构的变化。草鱼肌原纤维蛋白经超声波处理后其内源荧光强度的变化如图3A所示,处理前后肌原纤维蛋白分子的荧光最大发射波长未发生改变,均为280nm处,但随着超声时间的延长,其内源荧光强度呈下降的趋势。可能原因是超声波处理使肌原纤维蛋白分子展开,使Trp和Tyr等发色团暴露于溶剂中产生了溶剂猝灭作用,从而使荧光强度降低[22]。
表面疏水性是蛋白质重要的结构性质之一,其能反映蛋白质分子微观构象的变化[23]。蛋白质表面疏水性主要通过测定蛋白质表面疏水性氨基酸与ANS形成的结合物的荧光强度来表示。肌原纤维蛋白经超声波处理后其表面疏水性的变化如图3B所示,随着超声时间的延长,表面疏水性呈明显的上升趋势,超声处理20min时,样品表面疏水性比未经处理的样品增加了3.8倍。可能的原因是超声波产生的综合作用促使蛋白质分子展开,原来包埋在分子内部的疏水性氨基酸残基暴露至分子表面,这与内源性荧光的结果一致。这说明超声波处理对草鱼肌原纤维蛋白分子高级结构具有一定的破坏作用,蛋白的表面疏水性增加。

图3超声波处理对肌原纤维蛋白内源荧光(AA)和表面疏水性(BB)的影响Fig.3Effect of ultrasonic treatment on the intrinsic fluorescence intensity(A)a nd surface hydrophobicity(B)of myofibrillar protein
2.4超声波对肌原纤维蛋白总巯基和自由巯基含量的影响
巯基基团是蛋白质中活性最强的官能团之一,也是影响蛋白质功能特性的重要因素。经超声波处理后,肌原纤维蛋白的总巯基和自由巯基含量的变化如图4所示,超声处理后溶液中肌原纤维蛋白的自由巯基和总巯基含量下降,且随超声时间变化的趋势一致,即随着超声时间的延长,下降程度增加。经超声处理20min总巯基和自由巯基含量分别由未经处理的55.711μmol/g pro和51.398μmol/g pro降低至31.912μmol/g pro和27.015μmol/g pro。可能的原因是超声波处理可以使蛋白质分子展开,巯基基团暴露,同时,超声波产生的空化效应能使水解离为氢原子和高活性的羟自由基[24],羟自由基会使肌原纤维蛋白的巯基含量减少[15],巯基含量的减少是超声促使肌原纤维蛋白分子展开与羟自由基产生的共同结果。
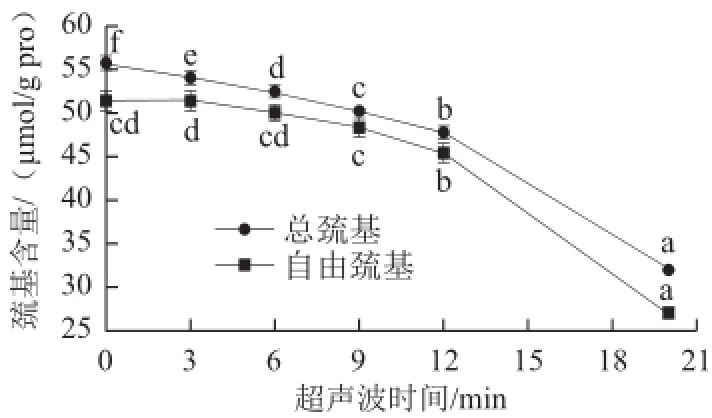
图4超声波处理对肌原纤维蛋白巯基含量的影响Fig.4Effect of ultrasonic treatment on the content of sulfhydryl groups in myofibrillar protein
2.5超声波处理对肌原纤维蛋白分子质量的影响
肌原纤维蛋白主要包括肌球蛋白、肌动蛋白和原肌球蛋白,分子质量分别约为480、43kD和33~36kD。肌球蛋白由2条分子质量为220kD重链和4条分子质量为10~27.5kD轻链组成。超声波处理后的肌原纤维蛋白经电泳分析,结果如图5所示,肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白(actin)谱带比较明显且较宽,说明肌原纤维蛋白的主要成分为肌球蛋白和肌动蛋白。与原样相比,超声波处理并没有引起肌原纤维蛋白电泳谱带大的变化,未出现蛋白降解片段或蛋白共价聚集产物,说明超声波处理不会引起蛋白质分子质量变化[25-26]。

图5超声波处理对肌原纤维蛋白分子质量的影响Fig.5Effect of ultrasonic treatment on the molecular weight of myofibrillar protein
3 结论
超声波技术是食品生物大分子物理改性方法之一,食品生物大分子经超声波处理后可引起分子理化特性的变化。草鱼肌原纤维蛋白经超声波处理后,颗粒粒径下降,颗粒大小分布更加均匀,平均粒径由2211.4nm降低至270.3nm;超声波对肌原纤维蛋白具有去聚集作用,热聚集程度降低,在12min、80℃处理条件下,其浊度降低了75.0%;超声处理后的草鱼肌原纤维蛋白内源荧光强度及巯基含量降低,总巯基和自由巯基含量分别由55.711μmol/g pro和51.398μmol/g pro降低至31.912μmol/g pro和27.015μmol/g pro,表面疏水性增加了3.8倍,蛋白质高级结构受到破坏,分子质量未受影响。因此,采用超声波技术对肌原纤维蛋白进行改性具有一定的效果。超声波对草鱼肌原纤维蛋白高级结构的影响机理以及对草鱼肌原纤维蛋白功能性质的影响有待进一步研究。
[1]徐文杰,李俊杰,贾丹,等.基于近红外光谱技术的草鱼营养成分的分析[J].食品科学,2013,34(20):161-164.
[2]韩黎,陶妍,汪之和.草鱼和鲢鱼肌球蛋白Ca2+-ATPase热力学活化参数的季节变化[J].水生生物学报,2008,32(2):161-166.
[3]韩敏义,费英,徐幸莲,等.低场NMR研究pH对肌原纤维蛋白热诱导凝胶的影响[J].中国农业科学,2009,42(6):2098-2104.
[4]LUO Y K,KUWAHARA R,KANENIWA M,et al.Comparison of gel properties of surimi from Alaska pollock and three freshwater fish species:effects of thermal processing and protein concentration[J].Journal of Food Science,2001,66(4):548-554.
[5]LI Xingke,XIA Wenshui.Effects of chitosan on the gel properties of salt-soluble meat proteins from silver carp[J].Carbohydrate Polymers,2010,82(3):958-964.
[6]CHEN Hongsheng,KONG Baohua,GUO Yuanyuan,et al.The effectiveness of cryoprotectants in inhibiting multiple freeze-thawinduced functional and rheological changes in the myofibrillar proteins of common carp(Cyprinus carpio)surimi[J].Food Biophysics,2013,8(4):302-310.
[7]KNORR D,ZENKER M,HEINZ V,et al.Applications and potential of ultrasonics in food processing[J].Trends in Food Science and Technology,2004,15(5):261-266.
[8]O’DONNELL C,TIWARI B,BOURKE P,et al.Effect of ultrasonic processing on food enzymes of industrial importance[J].Trends in Food Science and Technology,2010,21(7):358-367.
[9]张崟,曾庆孝,朱志伟,等.超声波辅助凝胶化对罗非鱼鱼糜凝胶性能的影响[J].华南理工大学学报:自然科学版,2009,37(4):138-142.
[10]JULIAN McCLEMENTS J.Advances in the application of ultrasound in food analysis and processing[J].Trends in Food Science and Technology,1995,6(9):293-299.
[11]LIU Qian,CHEN Qian,KONG Baohua,et al.The influence of superchilling and cryoprotectants on protein oxidation and structural changes in the myofibrillar proteins of common carp(Cyprinus carpio)surimi[J].LWT-Food Science and Technology,2014,57(2):603-611.
[12]PAN Jinfeng,SHEN Huixing,YOU Juan,et al.Changes in physiochemical properties of myofibrillar protein from silver carp(Hypophthalmichthys mollitrix)during heat treatment[J].Journal of Food Biochemistry,2011,35(3):939-952.
[13]ZHAO Yingying,WANG Peng,ZOU Yufeng,et al.Effect of preemulsification of plant lipid treated by pulsed ultrasound on the functional properties of chicken breast myofibrillar protein composite gel[J].Food Research International,2014,58:98-104.
[14]ZHANG Qiuting,TU Zongcai,XIAO Hui,et al.Influence of ultrasonic treatment on the structure and emulsifying properties of peanut protein isolate[J].Food and Bioproducts Processing,2014,92(1):30-37.
[15]LI Yanqing,KONG Baohua,XIA Xiufang,et al.Structural changes of the myofibrillar proteins in common carp(Cyprinus carpio)muscle exposed to a hydroxyl radical-generating system[J].Process Biochemistry,2013,48(5):863-870.
[16]CHELH I,GATELLIER P,SANT☒-LHOUTELLIER V.Technical note:a simplified procedure for myof ibril hydrophobicity determination[J].Meat Science,2006,74(4):681-683.
[17]ZHOU Feibai,ZHAO Mouming,SU Guowan,et al.Gelation of salted myofibrillar protein under malondialdehyde-induced oxidative stress[J].Food Hydr ocolloids,2014,40:153-162.
[18]HU Hao,FAN Xin,ZHOU Zhi,et al.Acid-induced gelation behavior of soybean protei n isolate with high intensity ultrasonic pretreatments[J].Ultrasonics Sonochemistry,2013,20(1):187-195.
[19]WANG Hang,LUO Yongkang,SHEN Huixing.Effect of frozen storage on thermal stability of sarcoplasmic protein and myofibrillar prote in from common carp(Cyprinus carpio)muscle[J].International Journal of Food Science and Technology,2013,48(9):1962-1969.
[20]G☒LSERENİ,G☒ZEY D,BRUCE B D,et al.Structural and functional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry,2007,14(2):173-183.
[21]王守业,徐小龙,刘清亮,等.荧光光谱在蛋白质分子构象研究中的应用[J].化学进展,2001,13(4):257-260.
[22]赵新淮,徐红华,姜毓君.食品蛋白质:结构,性质与功能[M]. 北京:科学出版社,2009:58.
[23]SANTE-LHOUTELLIER V,AUBRY L,GATELLIER P.Effect of oxidati on on in vitro digestibility of skeletal muscle myofibrillar proteins[J].Journal of Agricultural and Food Chemistry,2007,55(13):5343-5348.
[24]MARCHIONI C,RICCARDI E,SPINELLI S,et al.Structural chang es induced in proteins by therapeutic ultrasounds[J].Ultrasonics,2009,49(6/7):569-576.
[25]GULSEREN I,GUEZEY D,BRUCE B D,et al.Structural and funct ional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry,2007,14(2):173-183.
[26]涂宗财,马达,王辉,等.超声波对鸡肉肌浆蛋白理化性质和结构的影响[J].食品科学,2013,34(19):32-36.
Effect of Ultrasonic Treatment on Physico-chemical Properties of Myofibrillar Protein from Grass Carp
CHANG Haixia1,SHI Yan1,WANG Hui1,HUANG Xiaoqin2,LI Ruiping1,BAO Zhongyu1,TU Zongcai1,2,*
(1.State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang330047,China;2.College of Life Science,Jiangxi Normal University,Nanchang330022,China)
The physico-chemical pr operties of myofibrillar protein solution treated by ultrasonic were evaluated by particle diameter,surface hydrophobicity,sulfhydryl content and SDS-PAGE profile.After ultrasonic treatment,the particles of samples were distributed more uniformly.The mean particle diameter,thermal aggregation,fluorescence intensity and sulfhydryl content of myofibrillar protein decrease d with increasing ultrasonic treatment time.The minimum particle diameter of myofibrillar protein was270.3nm.The surface hydrophobicity of the protein increased,but the molecular weight showed no significant change.Therefore,myofibrillar protein could be unfolded and the hydrophobic groups were exposed by ultrasonic treatment;finally the high-order structure was destroyed and the aggregation was promoted although the primary structure was not changed.
ultrasonic treatment;myofibrillar protein;particle diameter;thermal aggregation;sulfhydryl groups;molecular weight
TS254.1
A
1002-6630(2015)05-0056-05
10.7506/spkx1002-6630-201505011
2014-06-30
江西省重大科技创新研究项目(20124ACB00600);江西省现代农业产业技术体系建设专项(JXARS-02)
常海霞(1989—),女,硕士研究生,主要从事极端条件下食品蛋白质营养与安全研究。
E-mail:hxchang_ncu@163.com
涂宗财(1965—),男,教授,博士,主要从事极端条件下食品蛋白质营养与安全研究。E-mail:tuzc-mail@aliyun.com
