旋磁在人前列腺增生BPH-1细胞增殖和凋亡中的作用与机制探讨*
2015-09-22雷洪恩许永德关瑞礼杨璧铖李猛惠宇高喆珠辛钟成
雷洪恩许永德关瑞礼杨璧铖李 猛惠 宇高喆珠辛钟成**
1.北京大学第一医院男科中心(北京 100034);
2.宁夏医科大学总医院泌尿外科; 3. 苏州大学附属第一医院泌尿外科
·论 著·
旋磁在人前列腺增生BPH-1细胞增殖和凋亡中的作用与机制探讨*
雷洪恩1许永德1关瑞礼1杨璧铖1李 猛2惠 宇3高喆珠1辛钟成1**
1.北京大学第一医院男科中心(北京 100034);
2.宁夏医科大学总医院泌尿外科; 3. 苏州大学附属第一医院泌尿外科
目的 研究旋转磁场在人前列腺增生BPH-1细胞增殖和凋亡中的作用,并就其影响机制作相关探讨。方法 设置空白对照(NC)组和旋转磁场处理(MF)组,不同时间剂量MF组使用CKJ-II(QLX-II)型高场强旋磁治疗仪分别处理1 min、5 min、10 min和20 min。然后利用CCK-8实验、细胞划痕及免疫荧光染色检测其对细胞增殖迁移影响,利用Annexin V-PE/ 7-AAD双染流式细胞术法检测其对细胞凋亡影响,利用蛋白印迹实验和免疫荧光检测其对细胞凋亡相关信号通路蛋白表达的影响。结果 与NC组相比,MF组BPH-1细胞经旋转磁场处理后,细胞增殖计数和细胞迁移距离明显降低,细胞增殖核抗原Ki67表达明显降低,细胞凋亡比例明显增加,并且与细胞内p38 MAPK磷酸化水平明显增加及Caspase-3活化蛋白明显增加有关。结论 旋转磁场可使BPH-1细胞发生增殖迁移减弱和凋亡增加,可能与细胞中细胞增殖相关的核抗原Ki67表达减少和细胞凋亡相关的p38 MAPK/Caspase-3凋亡分子信号通路激活有关。
前列腺增生; 旋转磁场; 细胞增殖; 细胞凋亡
良性前列腺增生症(benign prostatic hyperplasia, BPH)为泌尿外科常见疾病,其患病率随着年龄的增加而增加,该疾病在40~49岁男性中患病率为25%,而在70~79岁男性中患病率高达80%,临床上主要表现为下尿路刺激症状,严重危害中老年人的生活质量[1,2]。目前BPH的治疗方法主要有改变生活习惯和选择性α-受体阻滞剂、5α-还原酶抑制剂等口服药物治疗,口服药物治疗效果不佳的重度BPH患者、反复泌尿系感染合并结石症、尿潴留、输尿管扩张肾盂积水和肾功能损伤患者需要手术治疗[1]。但已有的上述BPH治疗方法还存在症状改善不彻底、药物副作用、手术耐受性和术后并发症等问题。
旋转磁场(gyromagnetic field)属于物理疗法的一种,可通过磁场与人体的相互作用而达到治疗疾病和调节生理病理状态的作用。研究表明,旋转磁场可以通过洛伦兹力、磁力、涡电流和热效应等作用于生物体,达到改善细胞代谢、增加细胞膜的通透性等效果[3]。有研究报道,磁疗具有缓解肌肉痉挛和降低血压以及抑制某些癌的生长与转移等功能[4,5],近年来磁疗这一非侵入治疗方式已经应用至眼科、神经疾病、口腔、心脏病和骨关节炎等疾病中[6],并且临床研究及动物模型研究中也已经有磁疗用于治疗BPH的相关报道[7,8]。我们前期临床观察发现CKJ-Ⅱ(QLX-Ⅱ)型高场强旋磁治疗仪可显著改善BPH患者的下尿路刺激症状,但是其作用机制目前还不清楚。
本研究采用体外培养的人前列腺增生上皮细胞系BPH-1细胞,观察其经旋转磁场处理后细胞增殖迁移和凋亡及相关分子信号通路的变化,探讨旋转磁场治疗BPH的可能性及其相关作用机制。
材料与方法
一、材料
(一)细胞
人前列腺增生上皮细胞系BPH-1细胞,购买自国家实验细胞资源共享平台。
(二)试剂
RPMI-1640培养基、胎牛血清、磷酸盐缓冲液(PBS)、0.25%胰酶消化液购买自美国Hyclone公司,CCK-8细胞计数试剂盒购买自DOJINDO东仁化学科技(上海)有限公司,Annexin V-PE/ 7-AAD细胞凋亡检测试剂盒和蛋白提取试剂盒购买自南京凯基生物科技发展有限公司,Anti-Ki67抗体购买自美国Abcam公司,Anti-P-p38 MAPK抗体、Anti-p38 MAPK抗体和Anti-Cleaved Caspase-3抗体购买自美国Cell Signaling Technology(CST)公司。
(三)仪器
CKJ-Ⅱ(QLX-Ⅱ)型高场强旋磁治疗仪购买自北京旋磁医疗设备有限公司,Mutiskan MK3型酶标仪购买自美国Thermo公司,DMI 6000 B型荧光显微镜购买自德国Leica公司,FACSCalibur型流式细胞仪购买自美国BD公司,C-DiGit™型扫膜仪购买自英国LICOR公司。
二、方法
(一)细胞培养
BPH-1细胞培养条件为37℃和5% CO2的饱和湿度恒温培养箱内培养,使用含10%胎牛血清和1%L-谷氨酰胺的RPMI-1640培养基培养,细胞汇合率达80%时,使用0.25%胰酶消化传代,每周传代3次,传代比例为1:3,直至细胞数量达到实验要求。细胞冻存时使用含10%二甲基亚砜(DMSO)、20%胎牛血清和70% RPMI-1640培养基的冻存液,慢速逐级降温至液氮中保存。
(二)旋转磁场处理细胞方法
CKJ-Ⅱ(QLX-Ⅱ)型高场强旋磁治疗仪处于工作状态时,旋转时上磁极表面的磁场强度为280 mT(2800 Gs),下磁极的表面的磁场强度为150 mT(1500 Gs),上下磁极的间距为32 cm;其实验器皿放置处磁场强度随时间变化而变化,且磁场强度按正弦函数分布,最大值为300 mT(3000 Gs),频率为6 Hz。根据旋磁治疗仪使用说明书,旋转磁场处理细胞时,人前列腺增生上皮细胞系BPH-1细胞培养皿置于CKJ-II(QLX-II)型高场强旋磁治疗仪的上述实验器皿放置处。
(三)细胞增殖计数实验
BPH-1细胞汇合率达80%时,使用0.25%胰酶消化后计数,接种至96孔细胞培养板中,每孔100 μL培养基,设3个平行复孔。实验设置空白对照(NC)组和旋转磁场处理(MF)组。等待细胞贴壁后,将实验组96孔细胞培养板置于CKJ-Ⅱ(QLX-Ⅱ)型高场强旋磁治疗仪中分别处理1 min、5 min、10 min和20 min,处理方法如上述所述,每天1次,连续处理2d;当比较NC组和MF 10 min组生长曲线时,处理方法如上述所述,每天1次,连续处理4d。细胞计数时,向96孔细胞培养板的每孔中加入10 μL的CCK-8溶液,将培养板在37℃恒温培养箱内孵育1 h,用Mutiskan MK3型酶标仪测定在450 nm处的吸光度,样品中活细胞数量与其吸光度大小成正比。
(四)细胞划痕实验
将BPH-1细胞接种于6孔细胞培养板中,待细胞贴壁后,将实验组细胞置于CKJ-Ⅱ(QLX-Ⅱ)型高场强旋磁治疗仪中按上述方法进行处理,每天1次,连续处理2d。待细胞汇合率达90%时,使用灭菌的200 μL移液器枪头垂直于孔背面的横线标记划线,每组3个平行复孔。划线后使用PBS清洗3次以去除细胞残骸和碎片,后换用不含胎牛血清的RPMI-1640培养基培养。于划线0 h和24h分别将细胞行0.2%结晶紫染色,经DMI 6000 B型荧光显微镜行明场观察并拍片后,使用美国国立卫生研究院(NIH)研发的ImageJ 1.47u软件统计并分析细胞迁移距离。
(五)细胞爬片免疫荧光实验
将已消毒的24 mm×24 mm盖玻片置于6孔细胞培养板中,按2×104/mL的细胞密度将细胞接种于培养皿中进行细胞爬片,设置NC组和MF 10 min组。细胞贴壁后经旋转磁场处理,方法如上述所述,每天1次,连续处理2d。行免疫荧光时,细胞爬片经PBS清洗、甲醛固定、0.5% Triton X-100通透液孵育、5%正常二抗血清封闭和一抗孵育4℃过夜,经荧光二抗和DAPI(4',6-二脒基-2-苯基吲哚)染色后,至DMI 6000 B型荧光显微镜下观察并拍片。
(六)细胞凋亡流式检测
将细胞按2×104/mL的密度将细胞接种于6孔细胞培养板中,设置NC组和MF不同剂量组。等待细胞贴壁后,将实验组6孔细胞培养板置于旋转磁场中分别处理1 min、5 min、10 min和20 min,处理方法如上述所述,1次/d,连续处理2d。细胞凋亡流式检测使用南京凯基生物科技发展有限公司的Annexin V-PE/ 7-AAD细胞凋亡检测试剂盒,按其操作说明书收集细胞孵育染液后,行FACSCalibur型流式细胞仪上机检测。
(七)蛋白印迹实验
使用蛋白提取试剂盒提取细胞蛋白后,经变性聚丙烯酰胺不连续凝胶电泳(SDS-PAGE)后,将分离的蛋白质转移到PVDF膜上,后经5%脱脂奶粉溶液封闭和一抗孵育4℃过夜,后经HRP标记的二抗孵育后,使用膜化学发光法检测结果,曝光经C-DiGit™型扫膜仪扫描。目的蛋白条带及内参蛋白条带的灰度值使用NIH研发的ImageJ 1.47u软件统计并分析。
三、统计学方法
所有资料均采用SPSS 19.0进行统计学处理,结果以均数±标准差(±s)表示。各组间比较采用单因素方差分析,其中方差齐者用LSD法,方差不齐者用Dunnett's检验,P<0.05为有统计学意义。
结 果
一、旋转磁场可抑制人前列腺增生上皮细胞系BPH-1细胞的增殖和迁移
与空白对照(NC)组相比,旋转磁场处理(MF)组人前列腺增生上皮细胞系BPH-1细胞行CCK-8细胞计数实验时细胞数目降低。其中MF 5 min组、MF 10 min组和MF 20 min组BPH-1细胞增殖较NC组细胞增殖明显降低且具有统计学意义(见图1A),并且MF 10 min组增殖抑制效果最好,故后续生长曲线观察和细胞免疫荧光等实验中选取MF 10 min组作为实验处理组。此外,BPH-1细胞经上述旋转磁场处理,连续4d行生长曲线观察,发现MF 10 min组BPH-1细胞增殖较NC组细胞增殖在第2、3和4天明显降低且具有统计学意义(见图1B)。
细胞划痕检测细胞迁移试验结果显示,MF 10 min组BPH-1细胞经上述旋转磁场处理后,细胞迁移能力较NC组明显降低且具有统计学意义(见图1C和图1D)。
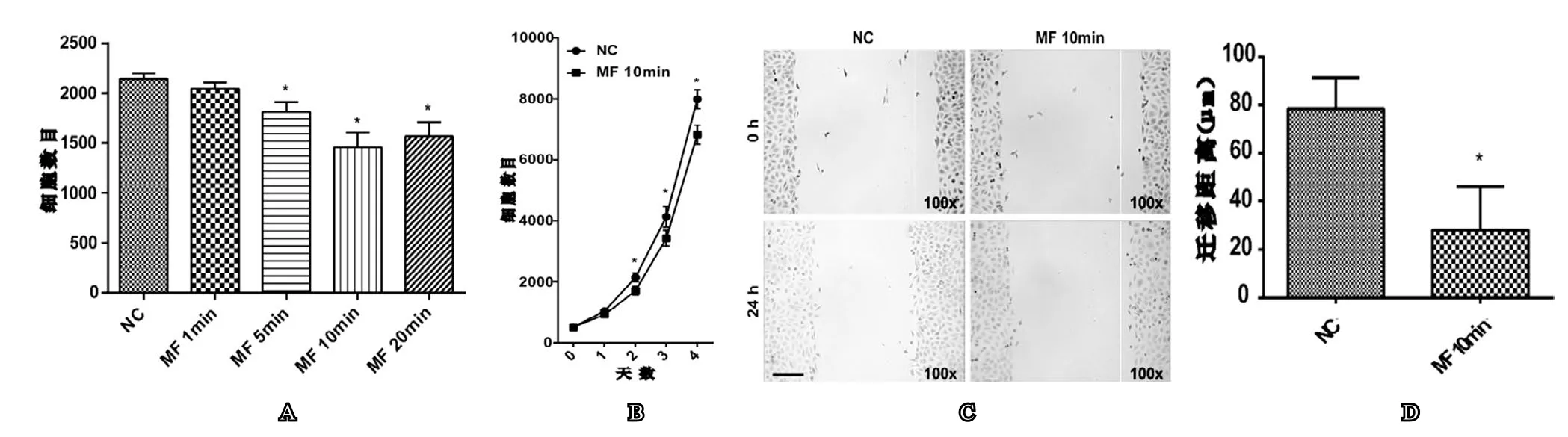
图1 旋转磁场对人前列腺增生上皮细胞系BPH-1细胞增殖迁移的影响
二、旋转磁场可抑制人前列腺增生上皮细胞系BPH-1细胞核抗原Ki67的表达
旋转磁场MF 10 min组BPH-1细胞经上述方法处理后,行细胞增殖相关的核抗原Ki67免疫荧光染色,发现MF 10 min组细胞较NC组细胞Ki67阳性率明显降低且具有统计学意义(见图2),以上结果证明了BPH-1细胞经旋转磁场处理后增殖明显减弱,与细胞Ki67表达受抑制有关。
三、旋转磁场可促进人前列腺增生上皮细胞系BPH-1细胞的凋亡
与NC组相比,BPH-1细胞经上述方法处理后,MF 10 min组和MF 20 min组BPH-1细胞总凋亡率明显增加且具有统计学意义(见图3),其中细胞凋亡率增加以晚期细胞凋亡率增加为主。

图2 旋转磁场对人前列腺增生上皮细胞系BPH-1细胞Ki67阳性率的影响

图3 旋转磁场对人前列腺增生上皮细胞系BPH-1细胞凋亡的影响
四、旋转磁场促进人前列腺增生上皮细胞系BPH-1细胞凋亡的作用与p38 MAPK/Caspase-3细胞凋亡信号通路的激活有关
将细胞蛋白提取行蛋白印迹实验时,发现MF 5 min、MF 10 min组和MF 20 min组BPH-1细胞蛋白中p38 MAPK磷酸化水平较NC组明显升高具有统计学意义(见图4A和图4B);另外,MF 10 min组BPH-1细胞经上述方法处理后,行凋亡相关抗原Cleaved caspase-3免疫荧光染色,发现MF 10 min组细胞较NC组细胞Cleaved caspase-3阳性率明显增加且具有统计学意义(见图4C和图4D)。以上结果提示BPH-1细胞经旋转磁场处理后凋亡增加与细胞内p38 MAPK/Caspase-3细胞凋亡信号通路激活有关。
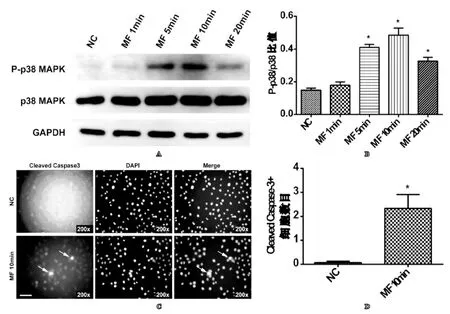
图4 旋转磁场对人前列腺增生上皮细胞系BPH-1细胞中p38 MAPK/Caspase-3细胞凋亡相关信号通路的影响
讨 论
BPH发生的具体病理生理学机制仍有待于进一步的研究,目前已知其发生与体内睾酮和双氢睾酮存在有关,其它危险致病因素有体内高水平的脱氢表雄酮和雌二醇、胰岛素样生长因子和C反应蛋白等[9,10]。此外,BPH的发生还与种族、肥胖、糖尿病、饮酒和缺乏锻炼有关[11,12]。前列腺发生BPH病理改变时,其腺体移行区平滑肌细胞和上皮细胞发生增生,进而引起下尿路刺激症状等临床表现。人前列腺增生上皮细胞系BPH-1细胞来源于BPH病人前列腺上皮细胞,其细胞增殖能力与BPH的发生有密切的病理生理学基础关联。本研究采用体外培养的人前列腺增生上皮细胞系BPH-1细胞作为实验研究对象,为探讨BPH发生的分子机制及寻找潜在治疗靶点提供了一个良好的病理生理学模型。
据文献研究报道,目前磁疗已经广泛应用于神经疾病[13]、心脏疾病[14]和骨关节疾病[15,16]等,但其具体作用机制还不甚清楚。磁疗中应用的磁场可分为静态磁场和动态磁场两种,且不同磁场因应用方法或产生方式的不同而具有不同的物理学参数,磁疗的具体临床应用方法有很多种,如磁针法、磁电法、直流电磁疗、旋转磁疗法、交变磁疗法等[17]。目前,关于磁疗过程中物理能量转化为生物学效应的具体作用机制研究还不是很清楚。有研究认为,磁场可以通过产生洛伦兹力、磁力、涡电流和热效应等作用于生物体,从而进一步产生生物学效应[3]。动态磁场的生物学效应可分为微电流和热效应,本研究中应用的旋转磁场属于动态磁场的一种。当旋转磁场作用于BPH-1细胞时,细胞内的微电流和热效应的变化可能进一步影响相关信号通路分子表达的变化。而丝裂原活化蛋白激酶(MAPK)通路是细胞应对外界刺激的重要调节体,所有的真核细胞都能表达MAPK,其调节着细胞生长、分化和凋亡等重要过程[18]。其中,p38 MAPK信号转导通路在细胞凋亡、炎症和细胞应激反应中发挥着重要的作用[19]。含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)是一组存在于细胞质中的蛋白酶,为细胞凋亡的重要指标,其活化后在细胞凋亡执行阶段可切割某些蛋白,使细胞发生程序性死亡(凋亡)[20]。p38 MAPK磷酸化可介导Caspase-3发生活化,为细胞内重要凋亡转导信号通路,可使细胞内Caspase发生层联激活,引起细胞不可逆地发生凋亡[21]。在本研究中,旋转磁场引起的细胞内微电流和热效应的变化可被认作为一种应激源,而p38 MAPK作为细胞中应对外界刺激的重要调节分子,对此刺激作出应有的调节反应。我们的研究结果发现,旋转磁场可促进BPH-1细胞中p38 MAPK磷酸化水平增加及Caspase-3发生活化等变化,证明BPH-1细胞在旋转磁场作用下发生增殖与迁移减弱和凋亡增加等变化与细胞中p38 MAPK/Caspase-3凋亡分子信号通路激活有关。简而言之,人前列腺增生上皮细胞系BPH-1细胞在旋转磁场作用下,细胞内细胞增殖相关的核抗原Ki67表达受到抑制,而细胞凋亡相关的p38 MAPK/ Caspase-3信号通路激活,且BPH-1细胞发生细胞增殖与迁移减弱和凋亡增加等现象,证明旋转磁场具有治疗BPH的潜在可能性。
目前,磁疗这一非侵入治疗方式已经在治疗BPH的临床研究中有所应用,但未就其具体分子机制展开讨论。2011年,Giannakopoulos等利用脉冲磁场治疗年龄在68~78岁间的BPH病人,并同时将其治疗效果与服用α-受体阻滞剂药物治疗的病人作了对照[8],结果发现,经脉冲磁场连续治疗2周,每周治疗5次,每次治疗30 min后,10例BPH病人的国际前列腺症状评分(IPSS)、超声测量前列腺体积、尿残余量和平均尿流率等指标均较治疗前明显改善,而服用α-受体阻滞剂药物治疗对照组的10例病人较治疗前只有IPSS指标有明显改善。2014年,Leoci等利用前列腺增生的犬作为模型,研究脉冲磁场对BPH的治疗作用[7],结果发现,经脉冲磁场连续治疗3周,每天治疗2次,每次治疗5 min后,20只实验犬的前列腺体积平均降低57%,而且磁场对精子数量、睾酮水平和性欲没有不利影响。这些临床及临床前研究为磁疗将来应用于BPH治疗提供了证据支持。
综上所述,旋转磁场可使人前列腺增生上皮细胞系BPH-1细胞发生增殖迁移减弱和凋亡增加等变化,且此变化与细胞中细胞增殖相关的核抗原Ki67表达减少和细胞凋亡相关的p38 MAPK/Caspase-3凋亡分子信号通路激活有关。旋转磁场治疗将来可能成为一种潜在的非侵入式临床治疗BPH的新方法。
1 Sarma AV, Wei JT. Clinical practice. Benign prostatic hyperplasia and lower urinary tract symptoms. N Engl J Med 2012; 367(3): 248-257
2 Berry SJ, Coffey DS, Walsh PC, et al. The development of human benign prostatic hyperplasia with age. J Urol 1984; 132(3): 474-479
3 Yamaguchi-Sekino S, Sekino M, Ueno S. Biological effects of electromagnetic fields and recently updated safety guidelines for strong static magnetic fields. Magn Reson Med Sci 2011; 10(1): 1-10
4 Hinman MR. Comparative effect of positive and negative static magnetic felds on heart rate and blood pressure in healthy adults. Clin Rehabil 2002; 16(6): 669-674
5 Salvatore JR, Harrington J, Kummet T. Phase I clinical study of a static magnetic field combined with antineoplastic chemotherapy in the treatment of human malignancy: initial safety and toxicity data. Bioelectromagnetics 2003; 24(7): 524-527
6 Markov MS. Magnetic field therapy: a review. Electromagn Biol Med 2007; 26(1): 1-23
7 Leoci R, Aiudi G, Silvestre F, et al. Effect of pulsed electromagnetic field therapy on prostate volume and vascularity in the treatment of benign prostatic hyperplasia: a pilot study in a canine model. Prostate 2014; 74(11): 1132-1141
8 Giannakopoulos XK, Giotis C, Karkabounas Sch, et al. Effects of pulsed electromagnetic fields on benign prostate hyperplasia. Int Urol Nephrol 2011; 43(4): 955-960
9 Neuhouser ML, Kristal AR, Penson DF. Steroid hormones and hormone-related genetic and lifestyle characteristics as risk factors for benign prostatic hyperplasia: review of epidemiologic literature. Urology 2004; 64(2): 201-211
10 Hung SF, Chung SD, Kuo HC. Increased serum C-reactiveprotein level is associated with increased storage lower urinary tract symptoms in men with benign prostatic hyperplasia. PLoS One 2014; 9(1): e85588
11 Kristal AR, Arnold KB, Schenk JM, et al. Race/ethnicity, obesity, health related behaviors and the risk of symptomatic benign prostatic hyperplasia: results from the prostate cancer prevention trial. J Urol 2007; 177(4): 1395-1400; quiz 1591
12 Sarma AV, St Sauver JL, Hollingsworth JM, et al. Diabetes treatment and progression of benign prostatic hyperplasia in community-dwelling black and white men. Urology 2012; 79(1): 102-108
13 Suszynski K, Marcol W, Szajkowski S, et al. Variable spatial magnetic field influences peripheral nerves regeneration in rats. Electromagn Biol Med 2014; 33(3): 198-205
14 Baldi E, Baldi C, Lithgow B J. A pilot investigation of the effect of extremely low frequency pulsed electromagnetic fields on humans' heart rate variability. Bioelectromagnetics 2007; 28(1): 64-68
15 Ongaro A, Pellati A, Masieri F F, et al. Chondroprotective effects of pulsed electromagnetic fields on human cartilage explants. Bioelectromagnetics 2011; 32(7): 543-551
16 Turan Y, Bayraktar K, Kahvecioglu F, et al. Is magnetotherapy applied to bilateral hips effective in Ankylosing spondylitis patients? A randomized, doubleblind, controlled study. Rheumatol Int 2014; 34(3): 357-365
17 Markov MS. Expanding use of pulsed electromagnetic feld therapies. Electromagn Biol Med 2007; 26(3): 257-274
18 Cuadrado A, Nebreda AR. Mechanisms and functions of p38 MAPK signalling. Biochem J 2010; 429(3): 403-417
19 Ono K, Han J. The p38 signal transduction pathway: activation and function. Cell Signal 2000; 12(1): 1-13
20 Li J, Yuan J. Caspases in apoptosis and beyond. Oncogene 2008; 27(48): 6194-6206
21 Shimizu T, Nakazato T, Xian M J, et al. Resveratrol induces apoptosis of human malignant B cells by activation of caspase-3 and p38 MAP kinase pathways. Biochem Pharmacol 2006; 71(6): 742-750
(2015-04-15收稿)
The effects of gyromagnetic feld on cell proliferation and apoptosis in human benign prostatic hyperplasia epithelial cell line BPH-1 and its mechanism*
Lei Hongen1, Xu Yongde1, Guan Ruili1, Yang Bicheng1, Li Meng2, Hui Yu3, Gao Zhezhu1, Xin Zhongcheng1**
1. Andrology Center, Peking University First Hospital, Peking University, Beijing 100034, China; 2. Department of Urology, General Hospital of Ningxia Medical University; 3. Department of Urology, the First Affliated Hospital of Soochow University Corresponding Author: Xin Zhongcheng, E-mail: xinzc@bjmu.edu.cn
Objective To investigate the effects of gyromagnetic field (MF) on cell proliferation, migration, and apoptosis in human benign prostatic hyperplasia epithelial cell line BPH-1 and explore its related mechanism. Methods Cells in the normal control (NC) group and the MF group were exposed in MF for 1 min, 5 min, 10 min, and 20 min. Cell proliferation was analyzed by cell counting kit-8 and immunofuorescence, cell migration was analyzed by wound healing assay, cell apoptosis was analyzed by FACS double staining with Annexin V-PE/ 7-AAD, and cell apoptosis signaling pathway was analyzed by western blot and immunofuorescence. Results Compared with cells in the NC group, the cells in the MF group showed a signifcant decrease in cell number, migration distance, Ki67 expression, as well as a signifcant increase in apoptosis rate, levels of p38 MAPK phosphorylation and cleaved Caspase-3 expression. Conclusion In exposure to MF, BPH-1 cells' proliferation and migration were attenuated and cell apoptosis was increased, which may related to the down-regulation of Ki67 and activation of p38 MAPK/Caspase-3 signaling pathway.
prostatic hyperplasia; gyromagnetic feld; cell Proliferation; apoptosis
10.3969/j.issn.1008-0848.2015.06.001
R 697.32
资助: 高等学校博士学科点专项科研基金博导类(编号:20120001110021)**
, E-mail: xinzc@bjmu.edu.cn
