晚期糖基化终末产物受体与核因子-κβ在中耳胆脂瘤中的表达
2015-09-18廖军林昶福建医科大学附属泉州市第一医院耳鼻喉科泉州362000福建医科大学附属第一医院耳鼻喉科福州350000
廖军 林昶福建医科大学附属泉州市第一医院耳鼻喉科(泉州362000)福建医科大学附属第一医院耳鼻喉科(福州350000)
·基础研究·
晚期糖基化终末产物受体与核因子-κβ在中耳胆脂瘤中的表达
廖军林昶
福建医科大学附属泉州市第一医院耳鼻喉科(泉州362000)
福建医科大学附属第一医院耳鼻喉科(福州350000)
目的研究中耳胆脂瘤中核因子-κβ(NF-κβ)与晚期糖基化终末产物受体(RAGE)的表达,探究上皮炎症反应在胆脂瘤的发病机制中的作用,寻找可能的中耳胆脂瘤干预治疗措施。方法中耳胆脂瘤手术中收集中耳胆脂瘤标本23例及正常外耳道皮肤组织18例,采用免疫组化法检验两种标本中NF-κβ和RAGE表达分布。结果胆脂瘤上皮组织中NF-κβ表达强度显著高于正常外耳道皮肤组织,两者NF-κβ阳性平均光密度分别为0.442±0.060及0.293±0.047(t=8.654,P<0.01);胆脂瘤上皮组织中RAGE表达强度显著高于正常外耳道皮肤组织,两者RAGE阳性平均光密度分别0.175±0.017及0.133±0.013(t= 8.516,p<0.01)。胆脂瘤上皮NF-κβ与RAGE表达具有弱相关性r=0.546(P=0.034)。结论NF-κβ与RAGE在中耳胆脂瘤上皮中表达增加,可能在胆脂瘤的发生和持续发展中起重要作用。调控NF-κβ与RAGE信号传导通路可能是中耳胆脂瘤治疗干预的有效靶点之一。
中耳胆脂瘤;核因子-κβ;晚期糖基化终末产物受体
中耳胆脂瘤是一种来源于角化复层鳞状上皮的囊性病变,上皮过度角化产生杂乱无章的角蛋白纤维层层堆积,刺激周围组织发生炎症反应包裹形成囊性肿物,并侵袭周围组织引起骨质破坏,最终导致听力损失、前庭功能障碍,并能引起严重的颅内外并发症,严重威胁人类健康。目前关于中耳胆脂瘤的发病机制众说纷纭,但其上皮组织中发生的慢性炎症反应被广泛认为是其中重要的始动和促进因素。胆脂瘤病变扩大,乃至破坏周围相关骨质与异常的免疫反应关系密切,这一过程离不开多种炎症因子介导[1,2],胆脂瘤中表达异常增高的白细胞介素1、6、8及肿瘤坏死因子等导致了胆脂瘤的上皮增殖凋亡、骨质破坏吸收。这些炎症因子调控与释放与核因子表达有关。晚期糖基化终末产物受体作为机体炎症反应发动的多条信号通路的启动靶点,在糖尿病并发症、动脉粥样硬化、原发性高血压等疾病的发生发展中的作用经过越来越多的研究得以证实[3,4],相应的信号通路的特异性和复杂性也逐渐为人所知。但在中耳胆脂瘤这一领域,相关的研究还未见诸报道。本研究采用免疫组化方法检测中耳胆脂瘤中RAGE以及NF-κβ的表达分布,以深入阐明中耳胆脂瘤的发病机制,寻找胆脂瘤非手术干预治疗的可能的药物靶点。
1 材料与方法
1.1病例选择
选取福建医科大学附属泉州市第一医院耳鼻喉科2012-2013年因中耳胆脂瘤行手术的患者23人,留取中耳胆脂瘤组织标本23例。胆脂瘤组织术后HE染色证实原诊断无误,且均含胆脂瘤上皮组织。其中男性11人(11耳),女性12人(12耳),年龄17-58岁,平均39.3岁。耳流脓史3个月-15年,平均2.6年。复发者1人。对照组织选取正常外耳道皮肤18例,于手术同期取得。所有标本行常规石蜡包埋并切片用作HE染色及免疫组化染色。
1.2主要试剂及来源
鼠抗人RAGE、NF-κβp65抗体为美国Sanda Cruz公司产品,购自上海亿欣生物科技有限公司;ElivisionTM Plus试剂盒,抗原修复试剂:0.01mmol/L柠檬酸型缓冲液购自福州迈新生物技术开发有限公司。
1.3检测RAGE、NF-κβ在组织中的表达
采用ElivisionTM Plus法检测中耳胆脂瘤上皮及正常外耳道皮肤组织中RAGE、NF-κβ的蛋白表达和分布。NF-κβ单抗稀释比例为1:100,RAGE单抗稀释比例为1:200。具体步骤按ElivisionTM Plus检测说明书进行操作。RAGE以胞膜、胞质或胞核着色,着色部分出现清晰棕黄色或棕黑色为阳性细胞,NF-κβ以胞质或胞核着色,着色部分出现清晰棕黄色为阳性细胞。观察阳性着色部位并采用Image-Pro Plus6.0图像分析软件对染色结果进行半定量分析。每张切片任意选取上皮组织5个阳性清晰颗粒、无非特异性背景着色的部位为代表性部位,在400倍显微视野下测定其中阳性细胞的阳性染色面积及累计光密度值并计算平均光密度(MOD),取5个代表性部位MOD值的平均值作为该切片的上皮组织的MOD值。
1.4统计学分析
应用SPSS19.0统计软件包对数据进行分析。采用两组独立样本t检验比较胆脂瘤标本中上皮组织与正常外耳道皮肤表皮组织中RAGE、NF-κβ蛋白表达的差异。采用相关分析探究胆脂瘤上皮组织中NF-κβ及RAGE是否存在相关性。
2 结果
2.1组织标本中NF-κβ蛋白表达
41例标本免疫组化染色均有NF-κβ蛋白的阳性表达。在23例胆脂瘤组织中,NF-κβ阳性细胞分布于上皮全层,多数标本呈强阳性表达(见图1)。23例标本均有胞质染色,有8例标本上皮细胞中出现胞核阳性着色。18例正常外耳道皮肤组织标本可见表皮弱阳性表达,均为胞质染色(见图2)。
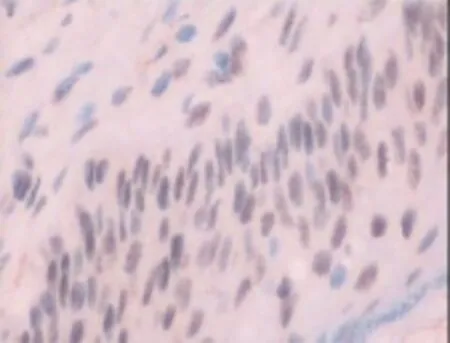
图1 胆脂瘤上皮NF-κβp65高表达×400倍
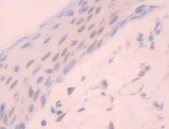
图2 正常皮肤NF-κβp65低表达×400倍
胆脂瘤上皮组织NF-κβ阳性平均光密度为0.442±0.060,正常外耳道皮肤组织表皮NF-κβ阳性平均光密度为0.293±0.047,两者平均光密度具有显著性差异(t=8.654,P<0.01)(见表1)。

表1 胆脂瘤组织标本NF-κβ蛋白表达
2.2组织标本中RAGE表达
41例标本免疫组化染色均有RAGE的阳性表达,主要位于上皮组织,细胞膜细胞质中表达明显,偶有胞核表达(见图3、图4)。胆脂瘤上皮组织中RAGE阳性平均光密度为0.175±0.017,正常外耳道皮肤表皮RAGE阳性平均光密度为0.133±0.013,两者差异具有统计学意义(t=8.516,P<0.01)(见表2)。

图3 胆脂瘤上皮RAGE高表达×400倍
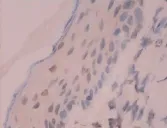
图4 正常皮肤RAGE低表达×400倍

表2 胆脂瘤组织标本中RAGE表达
2.3组织标本中NF-κβ与RAGE表达相关性
经过Spearman分析,胆脂瘤上皮中NF-κβ与RAGE表达的相关性r=0.546(p=0.034),具有弱相关性,正常外耳道皮肤表皮NF-κβ与RAGE表达r= 0.235(p=0.348),不具有相关性(见表3、4)。

表3
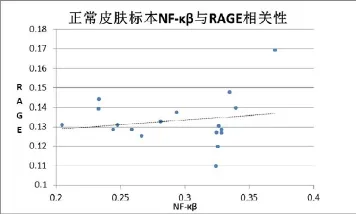
表4
3 讨论
中耳胆脂瘤是一种囊性病变,其生物学来源为角化的复层鳞状上皮。过度角化的上皮产生层层堆积的杂乱无章的角蛋白纤维,周围组织受到刺激发生炎症反应增生包裹角蛋白堆积物,形成囊性肿物逐渐膨大,侵袭周围组织引起骨质压迫吸收,最终导致听骨链破坏、听力丧失与前庭功能障碍,更有甚者会引起严重的颅内外并发症,严重威胁人类健康。胆脂瘤上皮组织局部微环境包括免疫细胞等受到多种内、外源性刺激,产生炎性介质级联式反馈作用,使组织中炎症反应逐步加重。多层基质(角化上皮)和免疫细胞及周边基质(如肉芽组织)混杂在一起是胆脂瘤的主要组织学特征。免疫机制的反复正反馈保持并增强了胆脂瘤上皮的增殖潜能。本研究通过对中耳胆脂瘤标本中RAGE、NF-κβ表达的检测,希望能够进一步明确病变发生发展的机制,发现新的治疗靶点,从而有效控制中耳胆脂瘤的发展。
作为一种跨膜信号转导受体,RAGE是免疫球蛋白大家族中的一员。RAGE具有多种配体,是机体炎症反应发动的多条信号通路的启动靶点。不同细胞表面的RAGE通过与多种配体结合发挥功效,能够向细胞内传递不同的信息,使得细胞对不同的刺激做出相应的反应。细胞中的RAGE的表达在正常生理状态下较低,而应激状态下的细胞可观察到RAGE表达明显增高。经还原辅酶1 (NADPH)氧化酶介导,RAGE与AGEs结合会引起细胞内氧化应激的发生,活性氧簇(ROS)随之增多[12]。氧自由基在细胞内生成后可使细胞膜发生超氧化;也可造成细胞内的活性物质如蛋白质、DNA、脂质等的直接损伤,最终导致细胞的结构改变、功能失调、代谢异常,甚至诱发细胞凋亡。RAGE与配体结合后还可以激活细胞内包括cdc42/rac,p21ras,MAPK和NF-κβ等[13-15]重要的信号转导通路。MAPK通路的激活促进了细胞的增殖、浸润,这与基质金属蛋白酶(MMPs)的活化有关[13]。在氧化应激产物、MAPK通路激活产物作用下,NF-κβ被激活,使得炎症信号继续沿着传导通路向下游传递,细胞得以表达相应的功能蛋白。Bierhal等[14]发现,血管内皮细胞表面的RAGE与各种AGEs结合后,在体内外均可引起NF-κβ增加(实验中观察到p65mRNA和抗原表达水平提高),NF-κβ持续活化。而NF-κβ的活化,能够导致多种细胞因子的形成与释放,引起复杂的生物学效应。其中包括大量炎症性细胞因子的表达和释放,这将会导致炎症的进一步持续和加重[16,17]。本研究通过免疫组化的检测发现,中耳胆脂瘤标本中RAGE的表达明显增强,提示了RAGE的大量沉积或基因表达是中耳胆脂瘤疾病发生发展的相关因素之一。
NF-κβ是一种转录调节因子,多种炎症和免疫基因表达都受到其调控。生理状态下,NF-κβ存在于细胞的胞质中并不具有生物学活性;当受到各种胞内胞外因素的活化时,才被激活从胞质转移至胞核,启动靶基因的转录[18,19]。NF-κβ对炎症基因的表达调控中位于多条信号通路的交汇点,因此绝大多数学者认为NF-κβ通路是典型的炎症信号转导通路。目前体内外实验观察到有多种细胞内外环境刺激因素可以激活NF-κβ。蛋白磷酸化和蛋白水解是NF-κB激活的细胞内信号途径主要环节[20],无活性的NF-κB以p105构成的二聚体及p50-p65-IκB构成的三聚体的形式存在,NF-κB的核位置信号区未能暴露,当细胞外刺激信号通过激活磷酸激酶C,分别磷酸化抑制性亚单位IκB和p105;IκB结构磷酸化后与具有活性p50-p65异构二聚体解离,而磷酸化的p105单位随即被蛋白酶水解成p50亚单位,使p105二聚体转化为p50-p65异构二聚体产生活性,这样蛋白磷酸化和蛋白水解使NF-κB的核位置信号区暴露,促使NF-κB从细胞核外进入细胞核发挥核基因调控作用。激活的NF-κB进入细胞核后与靶基因结合,使该处的DNA呈现构象变化,从而对靶基因的转录进行启动或增强[21]。NF-κβ作为重要的转录调节因子,参与多种细胞内外信号传导,调控病理过程中多种相关因子的核内转录[22]。NF-κβ可以调控多种炎症因子靶基因的表达,当NF-κβ激活后炎症相关因子的表达增加,引起炎症性疾病的发生发展。目前证明与NF-κβ密切相关的炎症疾病有肾小球肾炎、感染性休克、炎症性肠病、全身性炎症反应综合征、幽门螺旋杆菌相关性胃炎等。在许多炎症疾病中NF-κβ激活后产生强化正反馈而使炎症信号持续传导造成病情进展。有实验表明NF-κB还具有调控细胞凋亡的作用[23-24]。本研究发现中耳胆脂瘤标本上皮全层NF-κβ均有表达,且显著强于正常皮肤组织,部分胆脂瘤上皮出现明显的胞核NF-κβ阳性反应,说明NF-κβ在胆脂瘤中存在异常表达,可能在中耳胆脂瘤的发生和持续发展中起重要作用。
RAGE与NF-κβ之间也存在相互作用,两者通过复杂的信号传导通路共同调节细胞功能状态。RAGE与配体结合后细胞外信号传导入细胞内,经由MAPK通路或活化NADPH氧化酶使得细胞内活性氧簇水平升高[25-28],成为NF-κβ信号通路上游信号来源,通过NF-κβ将信号传导入细胞核内,核内基因表达启动或增强,促进炎症的发生;RAGE基因也属于NF-κβ调节的核内靶基因,NF-κβ入核也将引起RAGE表达的增加,两者互为信号通路的上下游,在病理状态下反复强化,将导致炎症反应的长期持续,疾病破坏的进一步加重。本研究表明中耳胆脂瘤中RAGE与NF-κβ表达具有弱相关性,并不能明确两者在中耳胆脂瘤中因果关系。这可能是由于细胞内信号通路的复杂性以及检测的半定量分析引入的系统混杂因素造成的,但二者在中耳胆脂瘤中的共同高表达提示了炎症反应在中耳胆脂瘤发生发展中的重要作用,抗炎抗氧化应激治疗有可能成为中耳胆脂瘤的一个新的治疗思路。如果可以抑制机体异常持续的炎症反应,那么就有可能通过非手术方法控制中耳胆脂瘤炎性碎屑的堆积,减少骨质破坏,缓解病情,为中耳胆脂瘤的防治开辟新途径。
4 结论
本研究通过对中耳胆脂瘤标本及正常外耳道皮肤的免疫组化检测,探究中耳胆脂瘤RAGE以及NF-κβ的表达分布特点,分析炎症信号通路在中耳胆脂瘤疾病发生发展过程中的作用。研究结果表明,中耳胆脂瘤中RAGE以及NF-κβ的表达较正常外耳皮肤有显著的升高,集中表现于中耳胆脂瘤上皮。炎症反应是中耳胆脂瘤发生持续发展并造成严重组织破坏的重要因素之一。
1Albino AP,Kimmelman CP,Parisier SC.Cholesteatoma:amolecular and cellular puzzle Am JO to,l 1998,19:7-191
2林刃舆,迟放鲁.中耳胆脂瘤形成机理的研究进展.国外医学耳鼻咽喉科学分册,2001,25:153-156.
3Haslbeck K M Schleicher E Bierhaus A et al.The AGE/RAGE/ NF-(kappa)B pathway may contribute to the pathogenesis of polyneuropathy in impaired glucose tolerance(IGT)[J].Exp Clin Endocrinol Diabetes,2005,113(5):288-91.
4Karin M,Greten FR.NF-kappaB:linking infamation and immunity to canncer devlopment and progressioon[J].Nat Rev Immunol,2005,5 (10):749-549
5Tak PP,Firestein GS.NF-κB:a key role in inflammatory diseases.J Clin Invest 2001;107:7-11
6Ghosh S,May MJ,Kopp EB.NF-κB and Rel proteins:evolu-tionarily conserved mediators of immune responses.Annu Rev Immunol 1998;16:225-260
7Greten FR,Weber CK,Greten TF,Schneider G,Wagner M,Adler G,Schmid RM.Stat3 and NF-kappaB activation pre-vents apoptosisinpancreaticcarcinogenesis.Gastroenterology2002,123:2052-2063
8Stem DM,Yan SD,Yan SF,et al.Receptor for advaneced glyea-tion end products(RAGE)And the complications of diabetes. Ageing Res Rev,2002,1(1):1-15 Review
9Kim JY,Park HK,Yoon JS,et al.Advanced glycation end product (AGE)-induced proliferation of HEL cells via receptor for AGE-re-lated signal pathways.Int J Oncol.2008 Sep;33(3):493-501
10Haslbeck K M Schleicher E Bierhaus A et al.The AGE/RAGE/ NF-(kappa)B pathway may contribute to the pathogenesis of polyneuropathy in impaired glucose tolerance(IGT)[J].Exp Clin Endocrinol Diabetes,2005,113(5):288-91.
11McNulty M Mahmud A Feely J.Advanced glycation end-products and arterial stiffness in hypertension[J].Am J Hypertens,2007,20 (3):242-7.
12Wautier MP,Chappey O,Corda S,et al.[J].Am J Physiol Endocrinol Metab,2001,280(5):E685-694.
13zill H,Bek S,hofmann,T,et al.[J].Biochem Biophys Res Commun,2003,300(2):311-315.
14Taguchi A,Blood DC,del Toro G,et al.[J].Nature,2000,405(6784):354-360.
15Bierhaus A,schiekofer s,Schwaninger M,et al.[J].Diabetes,2001,50 (12):2792-2808.
16Huijberts MS,Schaper NC,Schalkwijk CG,et al.Advanced glycation RAGE NF-B end products and diabetic foot disease[J].Diabetes Metab Res Rev,2008,24:19-24.
17Meerwaldt R,van der Vaart MG,van Dam GM,et al.Clinical relevance of advanced glycation endproducts for vascular surgery[J]. Eur J Vasc Endovasc Surg,2008,36:125-131.
18Brown KD,Claudio E,Siebenlist U.The roles of the classical and alternative nuclear factor-kappaB pathways:potential implications for autoimmunity and rheumatoid arthritis[J].Arthritis Res Ther,2008,10:212.
19Rasmussen MK,Iversen L,Johansen C,et al.IL-8 and p53 are inversely regulated through JNK,p38 and NF-kappaB p65 in HepG2 cells during an inflammatory response[J].Inflamm Res, 2008,57:329-339.
20Karin M,Ben-Neriah Y.Phosphorylation meets ubiquitination:the control of NF-kappaB activity.Annu Rev Immunol2000,18:621-663
21金伯泉,主编.细胞和分子免疫学.第二版.北京:科学出版社,2001. 572-577.
22罗军,靳风烁.核转录因子-KB与免疫应答.国外医学免疫学分册,2004,27:294-297.
23Li Q,Verma IM.NF-kappa B regulatioon in the immune system[J]. Nat Rev Immunol,2002,2(10):725-734
24Chen F,Castranova V.Nuclear factor-kappa B,an unapprecatied tumor suppressor[J].Cancer Res,2007,67(23):11093-11098
25Cortizo A M,Lettieri M G,Barrio D A,et al.Advanced glycation end-products(AGEs)induce concerted changes in the osteoblastic expression of their receptor RAGE and in the activation of extracellular signal-regulated kinases(ERK)[J].Mol Cell Biochem 2003,250(1-2):1-10.
26 Lander H M,Tauras J M,Ogiste J S,et al.Activation of the receptor for advanced glycation end products triggers a p21(ras)-dependent mitogen-activated protein kinase pathway regulated by oxidant stress[J].J Biol Chem,1997,272(28):17810-4.
27Wautier M P,Chappey O,Corda S,et al.Activation of NADPH oxidase by AGE links oxidant stress to altered gene expression via RAGE[J].Am J Physiol Endocrinol Metab,2001,280(5):E685 -94.
28Basta G,Lazzerini G,Del T S,et al.At least 2 distinct pathways generating reactive oxygen species mediate vascular cell adhesion molecule-1 induction by advanced glycation end products[J].Arterioscler Thromb Vasc Biol,2005,25(7):1401-7.
Expression of receptors for advanced glycation end product(RAGE)and nuclear factor-κβ(NF-κβ)in middle ear cholesteatoma
LIAO Jun,LIN Chang
Department of Otorhinolaryngology,Quanzhou First Hospital,Fujian Medical University,362000,Quanzhou
Department of Otorhinolaryngology,First Affiliated Hospital,Fujian Medical University,350000,Fuzhou,Corresponding author:LIN ChangEmail:linc301@yahoo.com
Objective To study the roles of NF-κβand RAGE in the pathogenesis of middle ear cholesteatoma.Methods Samples of middle ear cholesteatoma(n=23)and normal external ear canal skin(n=18)were collected during middle ear surgeries.Expression of NF-κβand RAGE was examined by immunohistochemistry.Results All epithelial cells in cholesteatoma revealed abundant plasma expression of NF-κβ and RAGE, significantly higher than that in normal skin(0.442±0.060 vs 0.293±0.047 and 0.175±0.017 vs 0.133±0.013, respectively;p<0.01).There was a weak correlation between NF-κβ and RAGE expression in middle ear cholesteatoma epithelium tissues(r=0.546,p=0.034).Conclusion NF-κβ and RAGE may be important factors involved in the occurrence and development of middle ear cholesteatom.The signal pathway of RAGE and NF-κβ may be a new drug target in non-surgical treatment of middle ear cholesteatoma.
middle ear cholesteatoma;NF-κβ;RAGE
R764.2
A
1672-2922(2015)04-737-5
2015-10-8审核人:郭维维)
10.3969/j.issn.1672-2922.2015.04.042
泉州市社会发展科技计划项目(2013Z60),并获泉州市卫生局资助。
廖军,硕士,主治医师,研究方向:耳科学
林昶,Email:linc301@yahoo.com
