趋化因子受体CXCR4在新生大鼠耳蜗的表达变化
2015-09-18张文张璐岳波宋勇莉陈晓栋陈阳邱建华陕西省人民医院耳鼻喉科西安70068第四军医大学附属西京医院耳鼻咽喉头颈外科西安7003
张文 张璐 岳波 宋勇莉 陈晓栋 陈阳 邱建华陕西省人民医院耳鼻喉科,西安,70068第四军医大学附属西京医院耳鼻咽喉头颈外科,西安,7003
·基础研究·
趋化因子受体CXCR4在新生大鼠耳蜗的表达变化
张文1张璐2岳波2宋勇莉2陈晓栋2陈阳2邱建华2
1陕西省人民医院耳鼻喉科,西安,710068
2第四军医大学附属西京医院耳鼻咽喉头颈外科,西安,710032
目的 通过检测CXCR4在大鼠耳蜗组织发育不同阶段的表达,探究其在哺乳动物耳蜗发育中的作用。方法 收集出生后1、7、14和28天的大鼠耳蜗组织,应用RT-PCR和Western Blot方法从mRNA和蛋白水平检测CXCR4的表达变化,同时检测14天和28天大鼠的听性脑干反应(auditory brainstem response,ABR)。结果 在新生大鼠耳蜗发育过程中,CXCR4在P1和P7的SD大鼠耳蜗有显著表达,而在P14和P28的大鼠耳蜗中表达微弱。P14大鼠ABR反应阈值范围在20~50dBSPL,平均33±9.23 dBSPL;P28大鼠ABR反应阈值范围在20~40dBSPL,平均30±8.58 dBSPL。结论 CXCR4与新生大鼠耳蜗的早期发育相关,可能参与调控大鼠耳蜗听觉的形成过程。
CXCR4;耳蜗;发育;新生鼠
CXCR4(C-X-C chemokine receptor type 4)是趋化因子基质细胞衍生因子1(SDF-1)的特异性受体,属于G-蛋白偶联受体(GPCR)超家族,具有7次穿膜结构。CXCR4和SDF-1广泛表达于多种细胞和组织中[1,2],在胚胎发育、肿瘤转移、免疫系统、循环系统及中枢神经系统的发育和修复中起着重要作用[3,4]。有研究发现,SDF-1/CXCR4与神经轴突的定向生长、神经内分泌及神经变性等均密切相关[5]。我们前期研究发现内耳螺旋神经节的雪旺细胞分泌SDF-1,在增强声环境下表达增强,并可能诱导移植的神经干细胞向受损的耳蜗迁移[6,7]。在哺乳动物正常听觉发育过程中,耳蜗中CXCR4的表达情况则尚未见文献报道。本文从mRNA水平和蛋白水平检测CXCR4在大鼠耳蜗组织发育过程中的表达变化,进而探讨其在哺乳动物耳蜗发育中的作用。
1 材料与方法
1.1实验动物及分组
选取80只健康清洁SD大鼠,雌雄不限,按照出生后的天数将大鼠分为出生后1天(P1组)、7天(P7组)、14天(P14组)和28天(P28组)共4组,每组20只。实验动物购自第四军医大学实验动物中心。
1.2实验方法
1.2.1RT-PCR反应
PCR反应引物的序列由广州复能基因有限公司设计并合成。取P1、P7、P14、P28的SD大鼠耳蜗组织,根据Promega公司的“Total RNA Isolation System”RNA提取试剂盒说明书提取各组耳蜗组织RNA。根据Fermentas公司的“RevertAid First Strand cDNA Synthesis Kits”反转录试剂盒说明书进行反转录,PCR反应试剂为北京TIANGEN公司的PCR Master Mix。
PCR反应体系:ddH2O 31.5μl,上下游引物各1μl,dNTP 0.5μl,SYBR Green1染料 10μl,cDNA 5μl,Taq酶1μl,总体积50μl,混匀后离心至无气泡,以GADPH为内参。
PCR的反应条件:62℃3 min:95℃10 min,95℃15 s共40个循环;60℃1 min。
1.2.2Western blot
取P1、P7、P14、P28的SD大鼠耳蜗蜗轴和基底膜组织,分别于蛋白裂解液中研磨匀浆,充分裂解。3000g离心10 min取其上清。各组样本蛋白中加入上样缓冲液,用沸水煮5 min。配制分离胶与浓缩胶,胶凝后将样品和蛋白分子量标准加样。先调电压至80V,电泳使溴酚兰接近分离胶顶端,然后将电压调至1OO V,溴酚兰至胶底部。取出凝胶后,用转移缓冲液浸泡10 min以上。甲醇预先浸泡PVDF膜(Millipore)15 s。再用转移缓冲液浸泡至少15 min。将电压调至200mA,转移1.5 h。转移结束后,TBS漂洗PVDF膜。5%脱脂奶粉封闭PVDF膜,室温孵育2 h,TBST洗膜3次,每次5 min。加入兔抗CXCR4多克隆抗体(1:500,Abcam),室温孵育2 h,以β-actin为内参。TBST洗膜3次,每次5 min。加入辣根过氧化物酶标记的二抗(1:1000),室温孵育2 h,TBST洗膜3次,每次5 min。化学发光试剂与膜作用后.X光片曝光1~2 min。显影3~5 min后定影,观察试验结果。CXCR4蛋白分子量约为39 kDa。
1.2.3听性脑干反应测试
P14和P28大鼠各20只,利用TDT听觉诱发电位仪(RZ6)对其进行听性脑干反应测试,技术参数设置:DSP数字处理器:2个或3个400MHz数字处理器最高采样率:200kHz,静电扬声器驱动:2通道,频响0~200kHz,光纤接口:4通道,25kHz。记录并分析测试结果。
2 结果
2.1CXCR4在P1,P7,P14,P28大鼠耳蜗的蛋白表达,P1和P7大鼠耳蜗组织样本中可见CXCR4的显著表达,P14和P28大鼠耳蜗组织样本中CXCR4表达微弱。

图1 CXCR4在P1,P7,P14,P28大鼠耳蜗的Western Blot结果
2.2CXCR4在P1,P7,P14,P28大鼠耳蜗的mRNA表达RT-PCR结果显示(图2),P1,P7,P14和P28大鼠耳蜗组织样本中均有CXCR4的表达,其中P7大鼠耳蜗组织表达最显著。
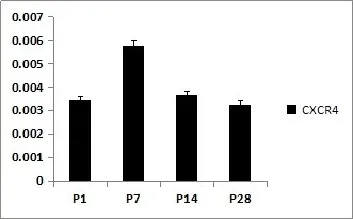
图2 CXCR4在P1,P7,P14,P28大鼠耳蜗的RT-PCR结果
2.3P14和P28大鼠听性脑干反应ABR
听性脑干反应ABR测试结果显示,P14大鼠ABR反应阈值范围在20~50 dB SPL,平均33±9.23 dB SPL。P28大鼠ABR反应阈值范围在20~40 dB SPL,平均30±8.58 dB SPL。
3 讨论
由于大鼠的胚胎期较短,出生后耳蜗听毛细胞与听器其他细胞形态结构仍不同程度地处于由不成熟到成熟的逐渐发育过程,出生后12-14天听觉发育基本成熟,可以记录到听性脑干反应[8]。根据大鼠耳蜗发育的这种特点,本文以出生后1、7、14和28天龄分组,观察CXCR4在出生后大鼠耳蜗发育过程中的表达变化。
CXCR4是趋化因子基质细胞衍生因子1 (SDF-1)的特异性受体,是具有7次跨膜结构的G-蛋白偶联受体。CXCR4与SDF-1结合后可以激活多条G蛋白耦联通路,如磷酸肌醇3激酶、促分裂原活化蛋白激酶、氨基末端激酶、P38等]和核转录因子NF-κB通路,从而诱导细胞内Ca2+的释放[9]。这些信号通路均与细胞的增殖、迁移、存活或凋亡有关[10]。
研究表明,CXCR4的表达最早始于胚胎期8.5 d (E 8.5)。在发育早期阶段,CXCR4主要在脑室区、脑室下区和边缘区表达[9]。出生后CXCR4在上述区域中的表达逐渐下调,但在海马齿状回颗粒下区和嗅球中的表达仍持续存在。在成年海马齿状回中,SDF-1/CXCR4能够通过GABA能神经元调节轴突生长、突触形成并促进表达CXCR4的GABA能神经元向颗粒细胞前体靶向传递,从而间接影响成年海马的神经发生[11]。我们前期研究发现成年大鼠耳蜗也有低水平的SDF-1表达,不同的声刺激环境下有不同的表达变化。在75 dB和90 dB的增强声环境中表达增强,而在115 dB的致聋声刺激下表达又下降[7]。在损伤的耳蜗移植神经干细胞后,神经干细胞有可能在SDF-1/CXCR4趋化作用下向受损区域移行[6]。但是,在正常大鼠耳蜗听觉发育形成过程中,SDF-1/ CXCR4是否参与调控尚未见报道。
本文从mRNA水平和蛋白水平检测CXCR4在新生大鼠耳蜗组织发育过程中的表达变化,探讨其在哺乳动物耳蜗发育中的作用。RT-PCR和Western Blot结果提示CXCR4在大鼠出生后1天和7天耳蜗的表达量较高,14天和18天则明显下降。而大鼠耳蜗功能正是在从生后12-14天逐渐成熟,P14和P28大鼠听性脑干反应ABR的阈值降低反映出耳蜗听觉功能的发育完善,说明CXCR4可能参与了大鼠出生后耳蜗听觉功能从无到有的过程,在成熟之后则不再参与功能的维持。因此,SDF-1/CXCR4有可能调节的是耳蜗毛细胞和螺旋神经元的突触形成与成熟过程,但其在内毛和外毛细胞的神经支配发育过程中究竟扮演了何种角色,还需要进一步深入研究。
1Noda M,Omatsu Y,Sugiyama T,et al.SDF-1-CXCR4 chemokine signaling is essential for NK-cell development in adult mice. Blood.2011;117(2):451-458.
2Huber BC,Brunner S,Segeth A,et al.Parathyroid hormone is a DPP-IV inhibitor and increases SDF-1-driven homing of CXCR4 (+)stem cells into the ischaemic heart.Cardiovasc Res.2011;90(3):529-537.
3Bellmann-Sickert K,Beck-Sickinger AG.Palmitoylated SDF 1α shows increased resistance against proteolytic degradation in liver homogenates.ChemMedChem.2011;6(1):193-200.
4Gouwy M,Struyf S,Berghmans N,et al.CXCR4 and CCR5 ligands cooperate in monocyte and lymphocyte migration and in inhibition of dual-tropic(R5/X4)HIV-1 infection.Eur J Immunol.2011;41(4):963-973.
5Berger O,Li G,Han SM,et al.Expression of SDF-1 and CXCR4 during reorganization of the postnatal dentate gyrus.Dev Neurosci.2007;29(1-2):48-58.
6Zhang PZ,He Y,Jiang XW,et al.Up-regulation of stromal cell-derived factor-1 enhances migration of transplanted neural stem cells to injury region following degeneration of spiral ganglion neurons in the adult rat inner ear.Neurosci Lett.2013,8(534):101-106.
7Zhang PZ,Cao XS,Jiang XW,et al.Acoustical stimulus changes the expression of stromal cell-derived factor-1 in the spiral ganglion neurons of the rat cochlea.Neurosci Lett.2014 Feb 21;561:140-145.
8Huang LC,Thorne PR,H ousley GD,et a1.Spatiotemporal definition of neurite outgrowth,refinement and retraction in the developing mouse cochlea.Development.2007;134-2925.
9Li M,Ransohoff RM.Multiple roles of chemokine SDF-1 in the central nervous system:A migration from immunology to neurobiology. Prog Neurobiol.2008;84(2):116-131.
10崔黎黎,赵传胜,赵珊珊。SDF一1/CXCR4在神经发生中的作用。中国神经免疫学和神经病学杂志。2012;19(2):142-145.
11Kolodziej A,Sehulz S,G-uyon A,et a1.Tonic activation of CXC chemokine receptor 4 in immature granule cells supports neurogenesis in the adult dentate gyrus.J Neurosci.2008;28(17):4488-4500 .
Expression of Chemokine Receptor Type 4 in New Born Rat Cochleae
ZHANG Wen1,ZHANG Lu2,YUE Bo2,SONG Yongli2,CHEN Xiaodong2,CHEN Yang2,QIU Jianhua2
1 Department of Otorhinolaryngology,People's Hospital of Shanxi Province
2 Department of Otorhinolaryngology Head and Neck Surgery,Xijing Hospital,Fourth Military Medical University,Xi'an,Shanxi 710032,PR.China Corresponding author:CHEN YangEmail:chendoc@fmmu.edu.cn
Objective To study the role of CXCR4 in mammals cochlea development by examining its expression in rat cochlear tissues at different times after birth.Methods Cochlear tissues were collected from SD rats on P1,P7,P14 and P28 days.RT-PCR was used to detect CXCR4 mRNA expression and Western Blot was used to detect CXCR4 protein expression.Auditory brainstem responses(ABR)were tested in 20 rats on P14 and P28 days and results were analyzed.Results The results showed that CXCR4 was highly expressed in cochlear tissues in rats on P1 and P7 days but expression declined on P14 and P28 days.Mean ABR threshold was 33±9.23 dB SPL on P14 day and 30±8.58 dB SPL on P28 day.Conclusion Our results indicate that CXCR4 may play a role in the maturation of rat cochleae and may be involved in modulating development of the new born cochlea.
CXCR4;Cochlear;development;new born rat
R764.35
A
1672-2922(2015)04-730-3
2015-11-10审核人:郭维维)
10.3969/j.issn.1672-2922.2015.04.040
国家自然科学基金面上项目(81371099)
张文,在读博士,主任医师,研究方向:耳科学
陈阳,Email:chendoc@fmmu.edu.cn
