广西汉族早老症家系三例病例研究
——线粒体DNA D-环区突变分析
2015-09-14李福记吴华裕韩焕钦陈凤平覃霞吕宇林有坤舒艳张伟峰方玲胡启平袁志刚舒伟
李福记,吴华裕,韩焕钦,陈凤平,覃霞,吕宇,林有坤,舒艳,张伟峰,方玲,胡启平,袁志刚,舒伟
广西汉族早老症家系三例病例研究
——线粒体DNA D-环区突变分析
李福记,吴华裕,韩焕钦,陈凤平,覃霞,吕宇,林有坤,舒艳,张伟峰,方玲,胡启平,袁志刚,舒伟
目的探讨广西汉族1个早老症家系中3例儿童早老症(HGPS)患者线粒体DNA D-环区(D-loop区)突变是否呈现年龄相关的突变累积。方法采用聚合酶链反应(PCR)对3例HGPS患者及其父母、8例正常老人(正常老人组)的线粒体DNA D-loop区进行扩增、测序。结果正常老年人线粒体DNA D-loop区较Cambridge序列存在较多的突变位点,HGPS患者与正常老人组线粒体DNA D-loop区突变率差异具有统计学意义(P<0.05);3例HGPS患者线粒体DNA D-loop区单体型与其母亲一致;未检测到3例HGPS患者线粒体DNA D-loop区发生新突变,也未检测到3例HGPS患者线粒体DNA D-loop区存在差异。结论该家系3例HGPS患者在7岁前未发生线粒体DNA D-loop突变累积,且不同年龄患者均未见年龄相关的突变累积,推论线粒体DNA突变不是该家系HGPS患者加速衰老的重要原因。
衰老,过早;早老症;DNA,线粒体;D-loop区;突变
李福记,吴华裕,韩焕钦,等.广西汉族早老症家系三例病例研究——线粒体DNA D-环区突变分析[J].中国全科医学,2015,18(29):3624-3627.[www.chinagp.net]
Li FJ,Wu HY,Han HQ,et al.Study of three cases of hutchinson-gilford progeria syndrome in a GuangxiHan family: analysis ofmitochondrial DNA D-loop regionmutations[J].Chinese General Practice,2015,18(29):3624-3627.
早老症(HGPS)患者一般在1岁左右就显示出皮肤硬化等病症,3岁左右可见明显的衰老表型(秃顶、皮肤色素沉着、典型小颌等),临床特征包括衰老面容、皮下脂肪缺失和骨质疏松等[1-2]。HGPS是由于编码A/C型核纤层蛋白(lamin A)的LMNA基因发生点突变而引起[3-5],LMNA基因突变引起衰老的分子机制有待进一步研究。人类线粒体DNA (mtDNA)全长16 569 bp,无内含子,唯一的非编码区是长为1 122 bp的D-环区(D-loop区)。mtDNA的H链和L链复制起始点均位于此区内,D-loop区调控着mtDNA的复制和转录[6]。多项研究表明,mtDNA突变与衰老及其相关的退行性疾病、恶性肿瘤等相关[7-13]。mtDNA发生突变频率最高的是D-loop区,而D-loop区又分为高突变区Ⅰ(HVRⅠ,mtDNA16024~16383)、高突变区Ⅱ(HVRⅡ,mtDNA57~372)和高突变区Ⅲ(HVRⅢ,mtDNA438~576)。HGPS被认为是研究正常衰老进程的一个特殊模型,已经初步认识到HGPS与人类生理性衰老有着类似的分子机制,HGPS放大了生理性衰老的过程。本研究通过检测早老症患者外周血mtDNA D-loop区的突变情况,探究早老症患者是否如正常老年人一样存在mtDNA突变及年龄相关的突变积累,为解释早老症的发病机制提供依据。
1 资料与方法
1.1 临床资料3例HGPS患者来自广西贺州汉族一家系,2013年曾就诊于广西医科大学第一附属医院,同年其父母陪同3例HGPS患者到广西医科大学细胞生物学与遗传学教研室进行该病的遗传咨询,在征得家属及患者的同意下取其家系所有成员(3例患者及其父母)外周血4 ml(EDTA抗凝,-20℃保存)进行基因诊断及该病的其他研究,并签订了知情同意书;8例正常老人(正常老人组,年龄80~90岁,男3例、女5例)外周血4 ml(EDTA抗凝,-20℃保存)来自广西百色平果县。
1.2 基因组DNA的提取和PCR扩增及测序取3例HGPS患者及其父母、正常老人组冻存外周血样本用酚氯仿法抽提全基因组DNA,用Nanodrop 2000测DNA浓度和质量,于-20℃保存备用。在美国国立生物技术信息中心(NCBI)数据库中查找Cambridge标准序列(NC_012920.1),用NCBI数据库的Primer-blast功能(http://www.ncbi.nlm.nih.gov/ tools/primer-blast/)在线设计引物,扩增片段长度为1 271 bp,含D-loop区全部序列,上游引物5'-CCAGTCTTGTAAACCGGAGATG-3';下游引物5'-TTCAGTGTATTGCTTTGAGGAGGT-3'。PCR反应体系为:94℃预变性5 min;94℃变性50 s,58℃退火40 s,72℃延伸1.5 min,共40个循环;72℃后延伸8 min。扩增产物经2%琼脂糖凝胶电泳验证成功后送往北京六合华大基因科技股份有限公司进行单向测序,扩增产物测序所用引物为5'-CCAGTCTTGTAAACCGGAGATG-3'和5'-TAAATAGCCCACACGTTCCCC-3'。
1.3 数据处理与分析3例HGPS患者及其父母、正常老人组mtDNA D-loop区的测序结果(SEQ格式)采用DNAMAP软件与GeneBank中的Cambridge标准序列(NC_012920.1)进行比对,并结合测序峰图统计突变位点。采用SPSS 16.0软件对早老症患者组与正常老人组mtDNA D-loop区突变率进行独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 HGPS患者的基本情况该家系于2009年就诊于广西医科大学第一附属医院,3例HGPS患者基本情况和临床特征见表1。基因诊断结果显示3例HGPS患者的突变位点均为LMNA R527C/R527C,发病年龄均在出生后6个月,均表现为血小板计数升高。
2.2 D-loop区的PCR扩增结果和测序结果成功扩增全部受试者外周血线粒体DNA D-loop区片段;成功测序全部受试者mtDNA D-loop区,先证者部分测序结果见图1。
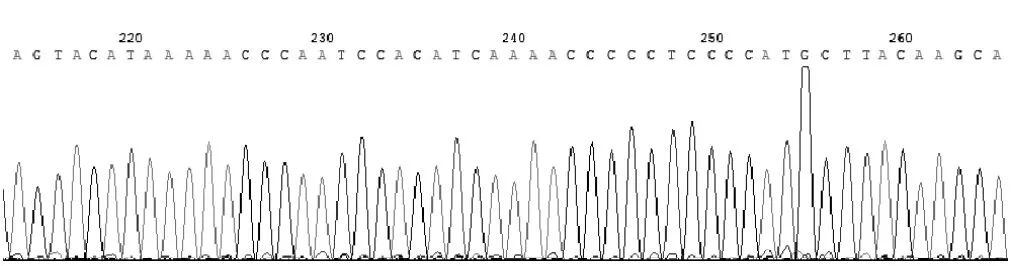
图1 HGPS家系先证者mtDNA D-loop区测序结果Figure1 Sequencing resultsof themtDNA D-loop region of the propositus of the HGPS family
2.3 mtDNA D-loop区的突变情况3例HGPS患者的mtDNA D-loop区序列与其母亲相同,mtDNA D-loop区单体型与其母亲一致,与其父亲有8个不同的位点(见表2)。未检测到3例HGPS患者mtDNA D-loop区新发生的突变,也未检测到3例HGPS患者mtDNA D-loop区存在差异(见表2)。
测序结果显示正常老年人组mtDNA D-loop区较Cambridge标准序列存在较多的突变位点(见表2),HGPS患者mtDNA D-loop区的突变率均为0.62%,正常老人组mtDNA D-loop区的突变率均大于0.70%,两组mtDNA D-loop区突变率间差异有统计学意义(t=-2.48,P=0.034,见表3)。

表1 3例HGPS患者的基本情况和临床特征Table 1 Basic information and clinical features of the three HGPSpatients
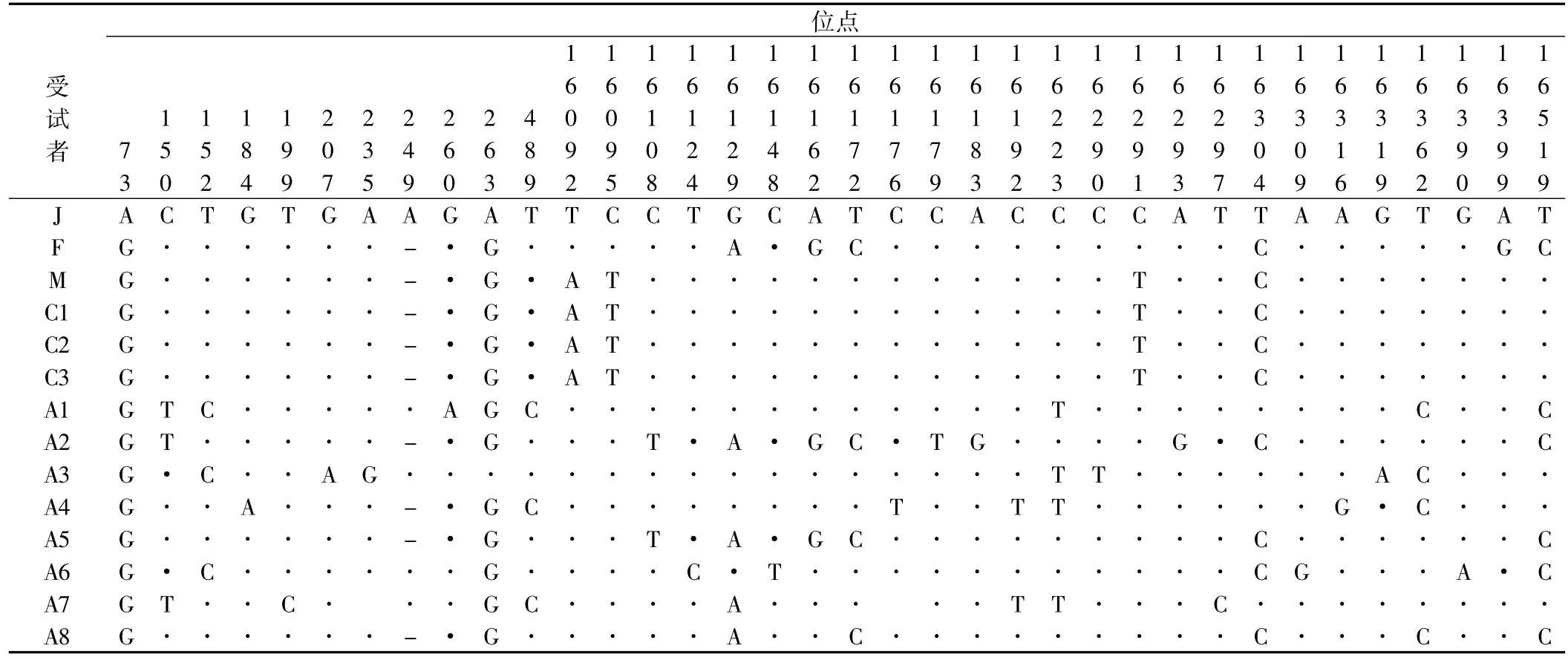
表2 HGPS家系与正常老人组mtDNA D-loop区突变结果Table 2 Statistic result of themtDNA D-loop region of the HGPS family and the normal seniors
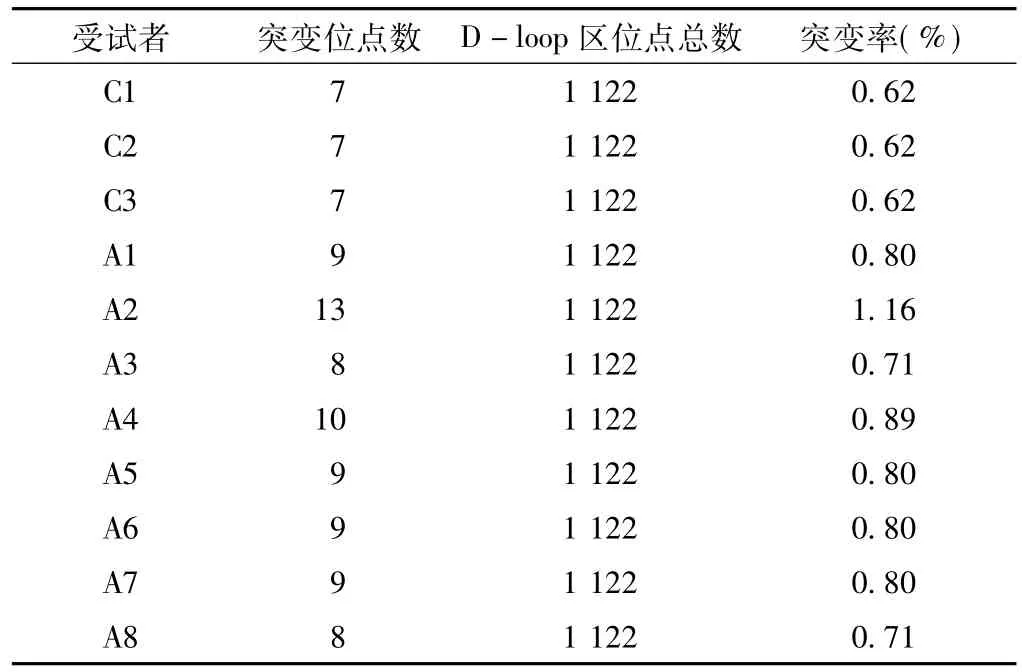
表3 HGPS患者与正常老人突变率比较Table3 Comparison ofmutation rate between the three HGPScasesand the normal elders
正常老年人组mtDNA D-loop区共75个突变位点,其中30个(40.0%)位于HVRⅠ,35个(46.7%)位于HVRⅡ,3个(4.0%)位于HVRⅢ,7个(9.3%)位于非高突变区(NoHVR)。
3 讨论
本研究报道了广西地区3例HGPS患者,并对其mtDNA D-loop区进行了分析。结果显示该家系HGPS患者mtDNA D-loop区没有发生突变,且不同年龄患者间未见年龄相关的突变累积。提示mtDNA的突变积累不一定是导致HGPS患者细胞加速衰老的重要原因,提示mtDNA突变可能是细胞衰老过程中(可能主要是衰老后期)由于基因组不稳定性增加而导致的结果。
HGPS患者mtDNA D-loop区的分析未见文献报道。本研究采用mtDNA和progeria为关键词检索不到关于HGPS患者mtDNA D-loop区突变的研究报告。但关于mtDNA突变与衰老的相关性却有大量文献报道,其因果关系存在较大争议[14-15]。Michikawa等[11]对人成纤维细胞mtDNA D-loop区的突变研究发现老年人中出现mtDNA突变的累积,其中T414G具有年龄相关性;Wang等[13]对肌肉组织中mtDNA D-loop区的突变研究中也发现了老年个体中存在大量的点突变; Theves等[12]对肌肉组织和口腔细胞mtDNA D-loop区的研究也得出了相同结论。以上研究结果提示mtDNA突变导致功能丧失和能量代谢障碍,从而导致细胞衰老,推论mtDNA突变可能是衰老的一个重要原因。Rivera-Torres等[16]对健康和HGPS患者纤维细胞研究发现,HGPS患者纤维细胞存在早老蛋白的累积,线粒体出现功能障碍,线粒体氧化磷酸化相关蛋白表达明显下调。此外,在有早老蛋白累积的LMNAG609G/ G609G突变小鼠和金属蛋白酶Zmpste24-/-缺失小鼠的纤维细胞中同样也发现了线粒体功能障碍。认为线粒体功能障碍加速了HGPS患者器官的衰退和老化。提示早老蛋白的累积可能影响线粒体氧化呼吸相关的基因表达,导致线粒体功能障碍,诱发细胞衰老。Trifunovic等[17]通过基因敲除技术改变小鼠POLG1基因的第3个外显子,使催化亚基polγA核酸外切酶活性结构域发生改变,导致聚合酶γ的核酸外切活性丧失,使mtDNA复制过程中出现的错配无法修复,结果检测到这些突变的老鼠出现了大量的mtDNA的点突变和缺失;且存在突变的老鼠出现了与HGPS相关的表型,如驼背、秃头、骨质疏松、体质量下降、身体脂肪量及肌肉量下降和心肌肥大等。这个研究结果进一步证实mtDNA突变导致线粒体功能丧失是细胞和机体衰老的重要原因。本研究显示LMNA R527C/R527C突变型的HGPS患者发病早中期并未发现mtDNA D-loop区存在突变,同时也未发现随着年龄增加的突变累积;因此推测LMNA的R527C突变并不一定通过增加mtDNA的突变来作为主要原因加速衰老过程。
mtDNA发生高频率的突变主要是由于:(1)mtDNA分子上为核苷酸结合蛋白,缺少组蛋白的保护;(2)mtDNA在复制时mtDNA聚合酶polγ的校读功能差[18];(3)mtDNA易受线粒体代谢过程中产生的活性氧的损伤[19]。本研究在检测HGPS家系的同时,也设置了正常老年人作为对照,发现正常老年人存在突变积累,这与相关报道相符[9-11]。并且,正常老年人的突变集中分布于HVRⅠ、Ⅱ,这与其他mtDNA D-loop区的研究相符[20-21]。同时,检测结果表明3例患者mtDNA D-loop区单体型与其母亲一致,与其父亲有8个不同的位点,与线粒体母系遗传规律相符。广西HGPS家系患者2和患者3均表现为秃头、皮肤干燥、皮下脂肪缺乏等衰老的表型。然而,本研究在此2例HGPS患者中并没有检测到mtDNA D-loop区的突变,该HGPS家系3例患者7岁前的mtDNA D-loop区检测没有出现与年龄相关的突变累积。此结果提示,LMNA R527C/R527C突变型HGPS的发病前中期并未造成mtDNA的损伤,或者可能并未造成线粒体功能的明显变化。线粒体功能障碍到底是衰老的原因还是结果,或者多大程度上可导致细胞加速衰老仍有待进一步研究。HGPS可以作为一种生理衰老的研究模型,对其线粒体功能与衰老的相关性研究将加深认识线粒体在衰老过程中的作用。
作者声明:文章为原创作品,数据准确,内容不涉及泄密,无一稿两投,无抄袭,无内容剽窃,无作者署名争议,无与他人课题以及专利技术的争执,内容真实,文责自负。
[1]Pollex RL,Hegele RA.Hutchinson-Gilford progeria syndrome[J].Clin Genet,2004,66(5):375-381.
[2]Hennekam RC.Hutchinson-Gilford progeria syndrome:review of the phenotype[J].Am J Med Genet A,2006,140(23):2603-2624.
[3]Gerhard-Herman M,Smoot LB,Wake N,et al.Mechanisms of premature vascular aging in children with Hutchinson-Gilford progeria syndrome[J].Hypertension,2012,59(1):92-97.
[4]Sarkar PK,Shinton RA.Hutchinson-Guilford progeria syndrome[J].Postgrad Med J,2001,77(907):312-317.
[5]De Sandre-Giovannoli A,Bernard R,Cau P,et al.Lamin a truncation in Hutchinson-Gilford progeria[J].Science,2003,300(5628):2055.
[6]Zeng T,Liu XG,Zhou ZJ.The pathogenic mechanisms and therapeutic strategiesof Hutchinson-Gilford Progeria Syndrome[J].Progress in Biochemistry and Biophysics,2007,34(7):687-694.(in Chinese)
曾涛,刘新光,周中军.早老症(HGPS)的发病机制和治疗策略[J].生物化学与生物物理进展,2007,34(7):687-694.[7]Eriksson M,Brown WT,Gordon LB,et al.Recurrent de novo point mutations in lamin a cause Hutchinson-Gilford progeria syndrome[J].Nature,2003,423(6937):293-298.
[8]Anderson S,Bankier AT,Barrell BG,et al.Sequence and organization of the human mitochondrial genome[J].Nature,1981,290(5806):457-465.
[9]Kukreja L,Kujoth GC,Prolla TA,et al.Increased mtDNA mutationswith aging promotesamyloid accumulation and brain atrophy in the APP/Ld transgenic mousemodel of Alzheimer's disease[J].Mol Neurodegener,2014,9:16.
[10]Zapico SC,Ubelaker DH.mtDNAmutations and their role in aging,diseases and forensic sciences[J].Aging Dis,2013,4(6): 364-380.doi:10.1186/1750-1326-9-16.
[11]Michikawa Y,Mazzucchelli F,Bresolin N,et al.Agingdependent large accumulation of point mutations in the human mtDNA control region for replication[J].Science,1999,286 (5440):774-779.
[12]Theves C,Keyser-Tracqui C,Crubezy E,et al.Detection and quantification of the age-related pointmutation A189G in the human mitochondrial DNA[J].JForensic Sci,2006,51(4):865-873.
[13]Wang Y,Michikawa Y,Mallidis C,et al.Muscle-specific mutations accumulate with aging in critical human mtDNA control sites for replication[J].Proc Natl Acad Sci USA,2001,98 (7):4022-4027.
[14]Liu SA,Jiang RS,WangWY,et al.Somaticmutations in the D-loop ofmitochondrial DNA in head and neck squamous cell carcinoma[J].Head Neck,2015,37(6):878-883.
[15]Sun Y,Yuan RT,Chen WT,et al.Screening of the genemutation in D-loop region of mitochondrial DNA in oral squamous cell carcinoma[J].Chinses Journal of Stomatology,2013,48(5): 285-287(in Chinese).
孙扬,袁荣涛,陈万涛,等.口腔鳞状细胞癌线粒体DNA D环区基因突变位点的筛选[J].中华口腔医学杂志,2013,48 (5):285-287.
[16]Rivera-Torres J,Acin-Perez R,Cabezas-Sanchez P,et al.Identification of mitochondrial dysfunction in Hutchinson-Gilford progeria syndrome through use of stable isotope labeling with amino acids in cell culture[J].JProteomics,2013,91:466-477.
[17]Trifunovic A,Wredenberg A,Falkenberg M,et al.Premature ageing in mice expressing defective mitochondrial DNA polymerase[J].Nature,2004,429(6990):417-423.
[18]Greaves LC,Taylor RW.Mitochondrial DNA mutations in human disease[J].IUBMB Life,2006,58(3):143-151.
[19]Szarka A,Banhegyi G,Sumegi B.Mitochondria,oxidative stress and aging[J].Orv Hetil,2014,155(12):447-452.
[20]Ji HL,Ji HJ,Du F,et al.The mutations of the D-loop hypervariable regionⅠandⅡof mitochondrial DNA in colorectal cancer,and its significance[J].Prac JMed&Pharm,2012,29 (7):630-633.(in Chinese)
姬宏莉,姬宏娟,杜芳,等.大肠癌线粒体DNA高突变Ⅰ区及Ⅱ区突变及其功能意义[J].实用医学杂志,2012,29(7): 630-633.
[21]Chen D,Zhan H.Study on the mutations in the D-loop region of mitochondrial DNA in cervical carcinoma[J].J Cancer Res Clin Oncol,2009,135(2):291-295.
Study of Three Cases of Hutchinson-Gilford Progeria Syndrome in A Guangxi Han Fam ily:Analysis of M itochondrial DNA D-loop Region M utations
LI Fu-ji,WU Hua-yu,H
AN Huan-qin,et al.Department of Cell Biology and Genetics,GuangxiMedical University,Nanning 530021,China
Objective To investigate whether age-related mutation accumulation occurs in the mitochondrial DNA (mtDNA)D-loop region of three cases with Hutchinson-Gilford progeria syndrome(HGPS)in a Guangxi Han family.M ethods Polymerase chain reaction(PCR)was used to amplify themtDNA D-loop region of the three HGPS cases and their parents,as well as 8 normal seniors,and all the PCR products were sequenced and analyzed.Results The normal elders had moremutation sites in themtDNA D-loop region compared with Cambridge standard sequence,and the three HGPS cases and the normal elders were significantly different in themutation in themtDNA D-loop region(P<0.05);the three HGPS cases had same haplotypewith theirmothers;no newmutationswere noted in themtDNA D-loop region of the three HGPS cases,and no differences were observed in the mtDNA D-loop region among the three HGPS cases.Conclusion No mutation accumulation was observed in themtDNA D-loop region of the three HGPS cases before they turned 7 years old,and no agerelated mutation accumulation was found in patients of differentage stages.Thismay lead to a conclusion thatmtDNAmutation is not amajor reason for the accelerated aging of the three HGPS patients in this family.
Aging,premature;Hutchinson-Gilford progeria syndrome;DNA,mitochondrial;D-loop;Mutation
R 441.9
A
10.3969/j.issn.1007-9572.2015.29.027
2015-03-15;
2015-07-20)
(本文编辑:赵跃翠)
广西自然科学青年基金资助项目(2013GXNSFBA019143);国家自然科学基金资助项目(81260479);广西高校大学生创新创业训练计划资助项目(201410598030)
530021广西南宁市,广西医科大学基础医学院细胞生物学与遗传学教研室(李福记,吴华裕,陈凤平,吕宇,方玲,胡启平,袁志刚,舒伟);广东医学院附属医院感染内科(韩焕钦);广西医科大学第一附属医院皮肤科(覃霞,林有坤);浙江省湖州市妇幼保健院(舒艳,张伟峰)
舒伟,530021广西南宁市,广西医科大学基础医学院细胞生物学与遗传学教研室;E-mail:shuwei7866@126.com
