p21活化激酶4在非小细胞肺癌中的表达及其临床意义*
2015-09-14李冬霞蔡松旺
李冬霞, 张 慧, 蔡松旺
(新乡医学院1基础医学院,2药学院,河南新乡453003,3中山大学附属第三医院胸外科,广东广州510630)
肺癌占据人类恶性肿瘤发病率第一位,80% ~85%的肺癌是非小细胞肺癌(non-small cell lung cancer,NSCLC)[1]。尽管外科手术技术的提高及影像设备、化疗和放疗等医学手段的飞速发展,由于目前大多数患者就诊时已是肺癌晚期,5年生存率仍然不到15%,治疗效果欠佳[1]。
p21活化激酶(p21-activated kinase,PAK)是一类丝氨酸/苏氨酸激酶蛋白,含有可与Cdc42/Rac相互作用的CRIB区域[2]。PAK表达上调已在多种癌症中报道,并在多种肿瘤细胞增殖、凋亡和转移等信号通路中起重要的作用[3-5]。PAK4最初当作Cdc42受体被发现,具有调节细胞骨架重构及丝状伪足的功能[3]。随后的研究发现PAK4在胃癌、肝癌、乳腺癌、大肠癌、卵巢癌等多种肿瘤组织中表达量上调,作为重要的癌基因促进肿瘤的增殖及转移,抑制凋亡,成为PAK家族中研究最多和最热门的一个基因[6]。然而,到目前为止,PAK4在非小细胞肺癌中的生物学作用尚不清楚。本文拟检测PAK4在非小细胞肺癌细胞系及人组织中的表达水平,并分析其与临床资料的相关性,探讨PAK4的表达与非小细胞肺癌患者生存的关系。
材料和方法
1 一般资料
HBE、A549、NCI-H520、NCI-H460 和 NCI-H596细胞购于中国科学院上海生科院细胞资源中心;选用中山大学第三附属医院2012~2013年非小细胞肺癌手术新鲜切除标本20例(10例原发性非小细胞肺癌和10例原发性非小细胞肺癌伴转移,切除后标本迅速放入液氮中),2005~2009年非小细胞肺癌210例(所有患者术前均未行放、化疗)。上述标本均经病理医生检查验证和归类。
2 方法
2.1 Western blot实验 利用10%的 SDS-PAGE分离蛋白,转膜,封闭,Ⅰ抗(1∶1 000)、Ⅱ抗(1∶1 000)孵育,发光检测,GAPDH作为内参照。使用Quantity One软件进行定量分析。
2.2 实时荧光定量PCR实验 按照一步法使用Invitrogen的TRIzol试剂来提取总RNA。使用Prime-Script RT Reagent Kit试剂盒逆转录成单链cDNA。使用ABI 7900HT Fast Real-Time PCR体系来进行实时荧光定量PCR。PAK4的上游引物为5'-ATGTGGTGGAGATGTACAACAGCTA-3',下游引物为5'-GTTCATCCTGGTGTGGGTGAC-3';内参照U6的上游引物为 5'-TGCGGGTGCTCGCTTCGGCAGC-3',下游引物为 5'-CCAGTGCAGGGTCCGAGGT-3'。阴性质控标准品采用灭菌双蒸水,待测样本按50 μL反应体系进行,反应条件为:93℃ 3 min预变性。然后93℃ 30 s,55 ℃ 45 s,72 ℃ 45 s,40 个循环。
2.3 免疫组化实验 所有组织标本经甲醛固定、石蜡包埋、5 μm厚连续切片。PAK4抗体工作浓度为1∶50。应用免疫组化SP法检测PAK4蛋白的表达。根据染色范围和染色强度来界定蛋白的表达情况,阳性范围计分如下:<10%记分为1分,10% ~35%记分为2分,35% ~70%记分为3分,>70%记分为4分;染色强度计分如下:不染色为0分,弱染色1分,中度染色为2分,强染色为3分。蛋白表达最终得分=染色范围×染色强度。两项乘积≥6分为PAK4高表达,<6分为PAK4低表达。
2.4 随访 通过电话及门诊问询随访,随访起始日期为手术时间,截止日期为2014年10月。
3 统计学处理
应用SPSS 17.0统计软件包对实验数据进行统计分析。A549、NCI-H520、NCI-H460 和 NCI-H596 细胞组与人支气管上皮细胞(human bronchial epithelial cells,HBE细胞)对照组间的比较采用Dunnett-t检验;采用t检验比较20例新鲜非小细胞肺癌组织与相应的癌旁组织中PAK4表达情况;采用χ2检验、Fisher精确概率法分析210例非小细胞肺癌患者PAK4蛋白表达与非小细胞肺癌生物学行为的关系;采用Kaplan-Meier法(log-rank检验)评估小细胞肺癌患者术后5年生存率;用Cox风险比例模型分析PAK4与非小细胞肺癌患者预后的关系。以P<0.05为差异有统计学意义。
结 果
1 PAK在非小细胞肺癌细胞及人支气管上皮细胞中的表达
非小细胞肺癌细胞(A549、NCI-H520、NCI-H460和NCI-H596细胞)PAK4蛋白和mRNA表达均明显高于HBE细胞(P<0.05),见图1。

Figure 1.PAK4 protein and mRNA expression in the NSCLC cell lines.Mean±SEM.n=3~5.*P<0.05 vs HBE.图1 PAK4在非小细胞肺癌细胞中的表达
2 PAK在非小细胞肺癌组织及癌旁组织中的表达
20例非小细胞肺癌组织中PAK4蛋白及mRNA的表达明显高于相应的癌旁组织(P<0.05),10例原发性非小细胞肺癌伴转移组PAK4的mRNA表达量明显高于原发性非小细胞肺癌组(P<0.05),见图2。
210 例非小细胞肺癌及癌旁组织免疫组化染色结果显示,PAK4阳性颗粒位于细胞膜及细胞浆,非小细胞肺癌PAK4蛋白的阳性表达率为65.2%,PAK4蛋白在非小细胞肺癌组织中的表达显著高于癌旁组织(P<0.01)。临床资料分析示PAK4蛋白表达与非小细胞肺癌的分化程度、淋巴结转移、远处转移及临床分期有关(P<0.05),见图2、表1。
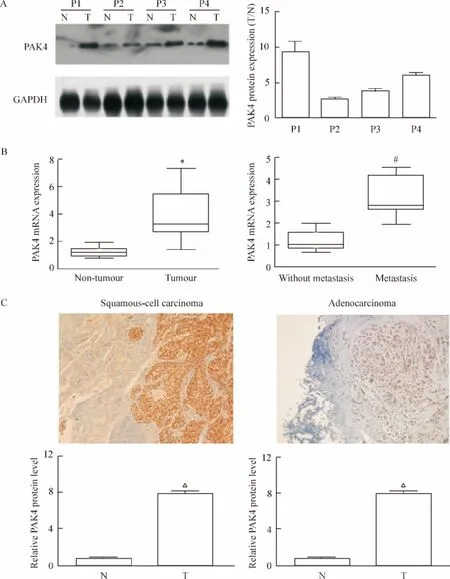
Figure 2.The expression of PAK4 and the association with the progression of NSCLC.A:Representative Western blots of PAK4 protein expression in the NSCLC tissues(T)and matched adjacent non-tumor tissues(N).Mean±SD.n=3.B:the mRNA expression of PAK4.Mean±SD.n=10.*P<0.05 vs non-tumor;#P<0.05 vs without metastasis.C:representative immunohistochemical staining and the quantitative analysis of squamous-cell carcinoma and adenocarcinoma of human NSCLC tissues(T)and matched adjacent non-tumor tissues(N).Positive cells are stained brown(×40).Mean±SD.n=20.△P<0.05 vs N.图2 PAK4表达与非小细胞肺癌进展
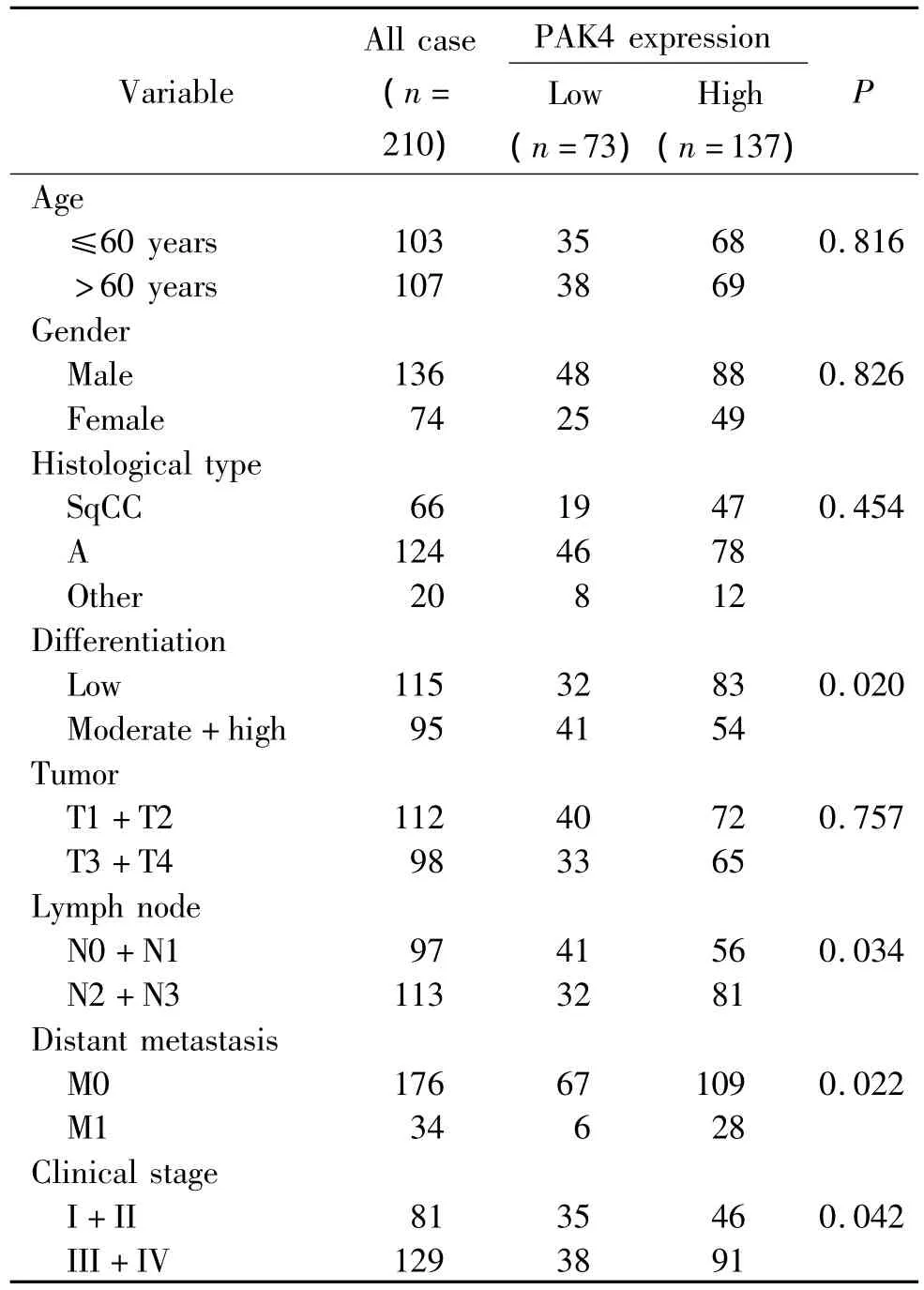
表1 PAK4表达与非小细胞肺癌临床病理参数的关系Table 1.Correlation of PAK4 expression with clinicopathological variables in 210 cases of NSCLC
3 非小细胞肺癌患者的预后分析
PAK4蛋白高表达组患者的生存率低于PAK4蛋白低表达组患者(log-rank检验,P<0.01),采用Kaplan-Meier法做出患者的生存曲线如图3所示;PAK4高表达组5年生存率为19%,PAK4低表达组5年生存率为45.2%。将单因素生存分析中得出的对非小细胞肺癌患者预后有显著影响的因素(淋巴结转移、分化、临床分期、远处转移和PAK4蛋白表达)引入Cox回归模型进行非小细胞肺癌预后的多因素分析,结果显示PAK4蛋白表达是非小细胞肺癌患者的独立预后因素,见表2。
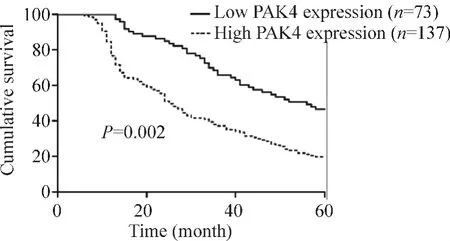
Figure 3.Kaplan-Meier survival curve illustrated the prognostic significance of PAK4 expression in NSCLC.The patients were divided into high or low PAK4 expression groups according to the proportion of positively stained tumor cells and staining intensity.Five-year survival was calculated using the Kaplan-Meier method and analyzed using the log-rank test.图3 非小细胞肺癌中PAK4表达相关的生存曲线
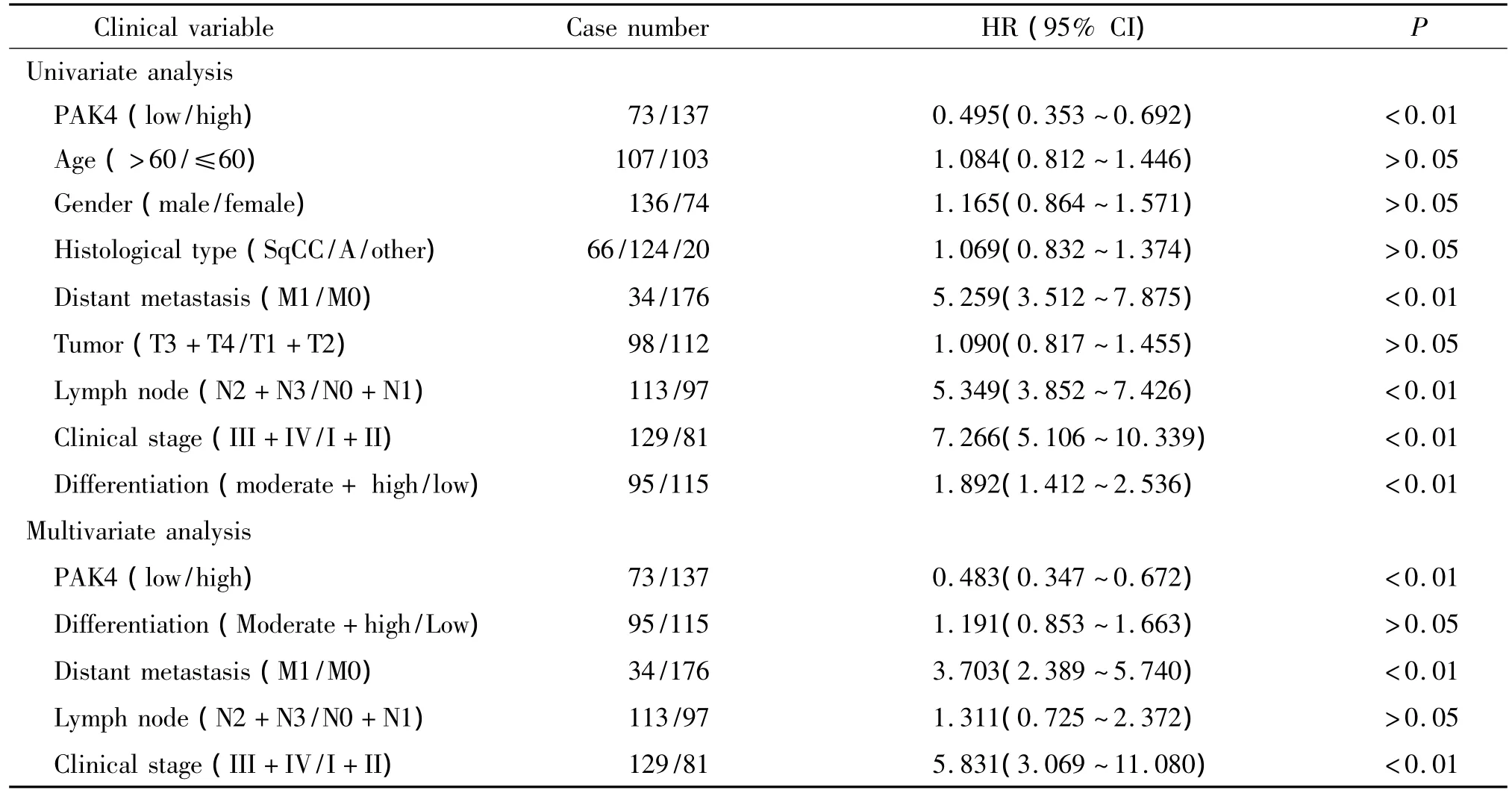
表2 非小细胞肺癌患者预后的单因素和多因素分析Table 2.Univariate and multivariate analysis of factors associated with overall survival of patients with NSCLC
讨 论
PAK4参与调节细胞骨架、细胞生长和细胞凋亡等多种生物学功能,在肿瘤的发生发展、侵袭及转移过程中发挥重要的作用[7-10]。目前已报道PAK4与乳腺癌、肝癌、胃癌等恶性肿瘤有关。但是PAK4与非小细胞肺癌有关的报道较少,促使我们探讨其是否在非小细胞肺癌发生发展过程中同样起重要作用。
我们的研究结果表明,非小细胞肺癌细胞及非小细胞肺癌组织中PAK4均高表达,且PAK4高表达与非小细胞肺癌的临床分期、分化、淋巴结转移及远处转移有关,并与非小细胞肺癌患者的预后密切相关,提示PAK4可能同样在非小细胞肺癌中起重要作用。
PAK4在不同肿瘤中可通过不同的信号通路影响肿瘤增殖及转移,如在绒毛膜癌中是通过下游的膜型基质金属蛋白1促进肿瘤细胞迁移及侵袭能力[7];在卵巢癌中是通过下游的c-Src/丝裂原活化蛋白激酶激酶1(MEK1)/细胞外信号调节激酶1/2和MMP-2通路促进肿瘤增殖及转移[11];在前列腺癌中是通过激活LIMK1/cofilin信号通路促进肿瘤细胞迁移[12],在胃癌中通过调节SCG10或LIMK1/cofilin信号通路促进肿瘤转移[9,13]。而PAK4在非小细胞肺癌中的生物学作用尚不清楚,我们将在下一步研究中探讨,并对其机制进行深入研究,明确PAK4在非小细胞肺癌中的生物学作用,希望为非小细胞肺癌的治疗提供新的靶点。
[1] Siegel R,Ma J,Zou Z,et al.Cancer statistics,2014[J].CA Cancer J Clin,2014,64(1):9-29.
[2] Radu M,Semenova G,Kosoff R,et al.PAK signalling during the development and progression of cancer[J].Nat Rev Cancer,2014,14(1):13-25.
[3] Abo A,Qu J,Cammarano MS,et al.PAK4,a novel effector for Cdc42Hs,is implicated in the reorganization of the actin cytoskeleton and in the formation of filopodia[J].EMBO J,1998,17(22):6527-6540.
[4] 蔡松旺,谢迭来,翁毅敏,等.p21活化激酶6对人非小细胞肺癌A549细胞侵袭及迁移能力的影响[J].中国病理生理杂志,2013,29(9):1637-1640.
[5] 蔡松旺,李冬霞,安 军,等.p21活化激酶6削弱非小细胞肺癌A549细胞侵袭及迁移能力的分子机制[J].中国病理生理杂志,2014,30(1):67-71.
[6] Dart AE,Wells CM.P21-activated kinase 4:not just one of the PAK[J].Eur J Cell Biol,2013,92(4-5):129-138.
[7] Lu W,Xia YH,Qu JJ,et al.p21-activated kinase 4 regulation of endometrial cancer cell migration and invasion involves the ERK1/2 pathway mediated MMP-2 secretion[J].Neoplasma,2013,60(5):493-503.
[8] Tabusa H,Brooks T,Massey AJ.Knockdown of PAK4 or PAK1 inhibits the proliferation of mutant KRAS colon cancer cells independently of RAF/MEK/ERK and PI3K/AKT signaling[J].Mol Cancer Res,2013,11(2):109-121.
[9] Guo Q,Su N,Zhang J,et al.PAK4 kinase-mediated SCG10 phosphorylation involved in gastric cancer metastasis[J].Oncogene,2014,33(25):3277-3287.
[10] Mak GW,Chan MM,Leong VY,et al.Overexpression of a novel activator of PAK4,the CDK5 kinase-associated protein CDK5RAP3,promotes hepatocellular carcinoma metastasis[J].Cancer Res,2011,71(8):2949-2958.
[11] Siu MK,Chan HY,Kong DS,et al.p21-activated kinase 4 regulates ovarian cancer cell proliferation,migration,and invasion and contributes to poor prognosis in patients[J].Proc Natl Acad Sci U S A,2010,107(43):18622-18627.
[12] Ahmed T,Shea K,Masters JR,et al.A PAK4-LIMK1 pathway drives prostate cancer cell migration downstream of HGF[J].Cell Signal,2008,20(7):1320-1328.
[13] Li X,Ke Q,Li Y,et al.DGCR6L,a novel PAK4 interaction protein,regulates PAK4-mediated migration of human gastric cancer cell via LIMK1[J].Int J Biochem Cell Biol,2010,42(1):70-79.
