Adipophilin通过ERK1/2-AP-1途径诱导炎症因子的表达*
2015-09-14袁中华谭艳美汪江波郭东铭唐朝克田国平
袁中华, 谭艳美, 陶 媛, 汪江波, 郭东铭, 王 佐, 唐朝克, 田国平,2△
(南华大学1心血管病研究所,动脉硬化学湖南省重点实验室,2附属第二医院,湖南 衡阳421001)
动脉粥样硬化(atherosclerosis,As)是心脑血管疾病形成的主要原因之一,关于其发病机制的研究目前主要集中在脂质侵润学说和损伤反应学说。1999年,Ross[1]在损伤反应学说基础上明确提出As是一类由炎症引起的疾病,它是具有慢性炎症反应特征的病理过程,其发展的全过程始终伴随着炎症反应。
脂肪分化相关蛋白(adipose differentiation-related protein,adipophilin),是脂滴周围蛋白PAT家族的成员之一。Jiang等[2]在1992年利用差别杂交筛选技术在脂肪细胞中分离提取到adipophilin这种蛋白,在之后的研究中发现它与脂肪代谢有关。研究发现,adipophlin不仅可促进细胞内脂质的蓄积,加速As的发生发展,而且近期也有研究表明,adipophilin还可影响炎症因子白细胞介素6(interleukin-6,IL-6)、单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的表达[3],但其具体机制并未阐明。此外,adipophlin可通过活化细胞外信号调节蛋白激酶1/2(extracellular signal-regulated protein kinases 1/2,ERK1/2)影响细胞中脂质蓄积[4],外界刺激激活ERK1/2磷酸化后,会引起核转录因子激活蛋白1(activator protein-1,AP-1)的活化[5],而 AP-1 与炎症反应和组织损伤也密切相关。因此,本实验以此为切入点,探讨adipophilin影响炎症因子表达的具体机制,以及在这个过程中ERK1/2和AP-1所发挥的可能作用。
材料和方法
1 材料与试剂
RAW264.7细胞购自中科院上海细胞生物学研究所细胞库;DMEM高糖培养基购于Gibco;小牛血清购于杭州四季春生物科技公司;IL-6、TNF-α和MCP-1酶联免疫分析试剂盒购于XS;无内毒素质粒小剂量快速提取试剂盒和无内毒素质粒大量快速提取试剂盒购于Omega;预染蛋白质分子量标准和EcoRⅠ、NotⅠ、BamHⅠ、HindⅢ内切酶购于 BioLabs;PD98059和curcumin购于Promega;鼠抗人IL-6、MCP-1、TNF-α、ERK1/2、p-ERK1/2、AP-1 和 p-AP-1的I抗购于 ABZOOM;β-actin的 I抗购于 Proteintech,其它试剂均为进口或国产分析纯。主要仪器有Labconco的单蒸水机和去离子水机;Labnet的PCR仪;Nikon的倒置式生物显微镜(UX620H);Eppendorf的台式多功能高速冷冻离心机(5804R型);Bio-Tek的酶标仪(ELx800型)。
2 细胞培养和实验分组
在10%小牛血清的高糖培养基中放入PA317细胞,并在10%小牛血清的高糖培养基中放入RAW264.7细胞,放置在湿度为95%,温度为37℃、5%CO2的培养箱中培养。再加入10 mmol/L的HEPES于培养液中。细胞贴壁达90%时传代。传代时弃去培养液,胰蛋白酶消化后,加5 mL血清培养液,每24~72 h传代1次。
本实验共分5组:对照(control,Con)组,未经处理的RAW264.7细胞;表达对照(Adi-Con)组,感染pQCXIP包装病毒的 RAW264.7细胞;高表达 adipophilin(Adi)组,感染pQCXIP-HA-Adi包装病毒的RAW264.7细胞;siRNA对照(siRNA-Con)组,感染pSUPER-retro-scramble-siRNA包装病毒的RAW264.7细胞;adipophilin siRNA(Adi siRNA)组,感染 pSUPER-retro-Adi-siRNA包装病毒的RAW264.7细胞。
3 方法
3.1 pQCXIP-HA-Adi和 pSUPER-retro-Adi-siRNA 表达载体的转化、鉴定和提取 根据分子克隆中CaCl2法制备DH5α感受态细胞,用本课题组袁中华教授已构建成功的 PQCXIP、PQCXIP-HA-Adi、pSUPER-scramble-siRNA和pSUPER-Adi-siRNA逆转录病毒载体,分别加入预冷的DH5α感受态细胞中,震荡混匀,利用 E.Z.N.A.®Endo-free Plasmid Mini Kit II进行质粒提取,对提取的质粒进行酶切(EcoRⅠ或NotⅠ)鉴定,使用 E.Z.N.A.®FastFilter Plasmid Maxi Kit对已鉴定的菌液进行质粒提取。
3.2 转染 pQCXIP-HA-Adi和 pSUPER-retro-AdisiRNA入PA317包装细胞以及重组DNA逆转录病毒液的收集 转染的前1 d将PA317包装细胞系按照每孔4×105接种在6孔板中,次日细胞转染时可达到95%汇片。将pQCXIP和pQCXIP-HA-Adi用无血清高糖培养基和Attractene稀释,并与DNA稀释液混匀,室温下孵育。然后,用无血清的培养基漂洗PA317细胞,每孔的包装细胞上再加入Attractene/DNA混合物,混匀,室温下10%血清培养基培养,48 h后用嘌呤霉素筛选,每2~3 d换1次培养基,持续培养3~4周,获得稳定转染并持续表达adipophilin的抗性克隆,将细胞克隆进行转移和扩增,收集含有病毒的培养液。
3.3 病毒感染RAW264.7细胞 将PA317细胞以每孔4×104细胞接种在24孔板中,次日将嘌呤霉素按不同浓度加入各孔中,每隔2~3 d换液1次,保持嘌呤霉素浓度不变,观察细胞。挑取嘌呤霉素的浓度为该培养的条件下细胞5 d内的大量死亡,第14天时全部死亡的最低浓度,确定PA317细胞最佳嘌呤霉素筛选浓度。接着,将RAW264.7细胞按照4×105接种到6孔板中,细胞培养箱过夜后分别以10-2、10-3、10-4倍稀释 pQCXIP 和 pQCXIP-HA-Adi病毒上清,再加入嘌呤霉素终浓度为8 mg/L,混匀。将RAW264.7细胞中的培养基弃去,各孔中加入病毒稀释液,每种病毒分2孔,感染至少6 h后,用含血清培养基逐步稀释嘌呤霉素浓度,持续培养2周,可见阳性的细胞克隆生长。
3.4 蛋白免疫印迹分析 将所需细胞处理后,裂解液裂解细胞,提取总蛋白。利用蛋白定量试剂盒定量后。使蛋白变性,将10%SDS-PAGE胶每孔加入10 μL 样本,110 V,40 min;之后切胶转移到 PVDF 膜上,200 mA,1 h;5%无抗脱脂奶粉封闭过夜。加入鼠源性I抗,置于空气浴摇床4 h,辣根过氧化物酶标记II抗置于空气浴摇床50 min。暗室压片,显影。
3.5 酶联免疫吸附实验 收集各组细胞上清液,用双抗体夹心法测定MCP-1、TNF-α和IL-6细胞水平,用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加MCP-1、TNF-α和IL-6细胞上清液再与 HRP标记的 MCP-1、TNF-α和 IL-6抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。按照说明书中方法计算,最后统计结果。
4 统计学处理
实验所得数据采用均数±标准差(mean±SD)表示,各实验组均与对照组比较,采用t检验,由GraphPad Prism 5统计软件完成,以P<0.05为差异有统计学意义。
结 果
1 Adipophilin对 IL-6、TNF-α和MCP-1表达的影响
与对照组(Con)相比,高表达adipophilin(Adi)组的IL-6、TNF-α和 MCP-1浓度明显升高,差别显著;低表达 adipophilin(Adi-siRNA)组的 IL-6、TNF-α和MCP-1浓度明显降低,差别显著;而表达对照(Adi-Con)组和siRNA对照(siRNA-Con)组的IL-6、TNF-α和MCP-1浓度没有明显变化,见图1。
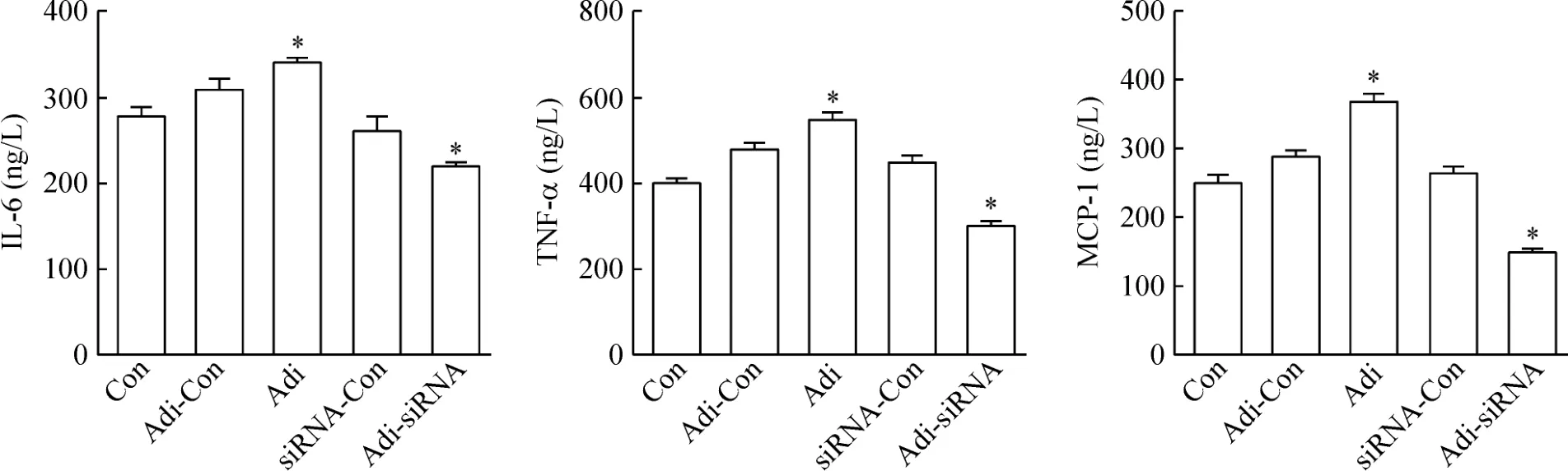
Figure 1.The effects of adipophilin(Adi)on the concentrations of IL-6,TNF-α and MCP-1.Mean±SD.n=3.*P <0.05 vs control(Con)group.图1 Adipophilin对 IL-6、TNF-α和MCP-1浓度的影响
2 Adipophilin对AP-1蛋白活性的影响
与Con组相比,Adi组的p-AP-1占其总蛋白的比值明显增高,差别有统计学意义,表明被活化的AP-1增加。Adi-siRNA组的p-AP-1占其总蛋白的比值明显下调,表明AP-1的活性被抑制。而Adi-Con组和siRNA-Con组p-AP-1占其总蛋白的比值没有明显变化,见图2。
3 Adipophilin对ERK1/2蛋白活性的影响
与Con组相比,Adi组p-ERK1/2占其总蛋白的比值增高,差别有统计学意义,表明被活化的ERK1/2增加;Adi-siRNA组p-ERK1/2占其总蛋白的比值下调,而Adi-Con组和siRNA-Con组没有明显变化,见图3。
4 ERK1/2抑制剂对adipophilin和AP-1蛋白水平的影响
将各组细胞培养48 h,待细胞约铺满95%以上,加入50 μmol/L ERK1/2阻断剂PD98059孵育2 h,收集各组细胞提取总蛋白,Western blot检测ERK1/2、p-ERK1/2、AP-1、p-AP-1 和 adipophilin 的蛋白水平。统计结果表明,用PD98059处理后,与Con组相比,其它各组中adipophilin蛋白表达均增高;Adi组和Adi-siRNA组的p-ERK1/2和p-AP-1占其总蛋白的比值下降,差别有统计学意义;而p-ERK1/2和p-AP-1占其总蛋白的比值在Adi-Con组和siRNA-Con组没有明显变化,见图4。

Figure 2.The effects of adipophilin(Adi)on the protein levels of AP-1 and p-AP-1.Mean±SD.n=3.*P<0.05 vs control(Con)group.图2 Adipophilin对AP-1及p-AP-1蛋白水平的影响
5 AP-1抑制剂对adipophilin、ERK1/2及炎症因子表达的影响
将各组细胞培养48 h,待细胞约铺满95%以上,加入20 μmol/L AP-1阻断剂curcumin孵育2 h,提取各组总蛋白并收集细胞上清液。Western blot检测adipophilin、AP-1、p-AP-1、ERK1/2 和 p-ERK1/2 的蛋白水平,ELISA方法检测炎症因子在上清液的浓度变化。Western blot结果表明,p-AP-1占其总蛋白的比值在各组中均降低。与Con组相比,adipophilin和p-ERK1/2蛋白在Adi组中表达增高,差异有统计学意义,其它蛋白变化不明显。ELISA结果显示,与Con组相比,IL-6、TNF-α 和 MCP-1的浓度在 Adi组和Adi-siRNA组明显降低,差异有统计学意义;Adi-Con组和siRNA-Con组无明显变化,但与未加入AP-1抑制剂相比,加入AP-1抑制剂各组中炎症因子浓度明显降低,见图5、6。
讨 论
Adipophilin是一种不完全包被蛋白,在正常的状态下,它主要位于细胞内的新生脂滴周围,在许多细胞株上都有表达,但在组织水平只在少数细胞有表达。国内外研究证明,adipophilin与泡沫细胞的形成密切相关[6-7],且在 As发生发展中发挥重要作用,但其具体机制还不是很明确。
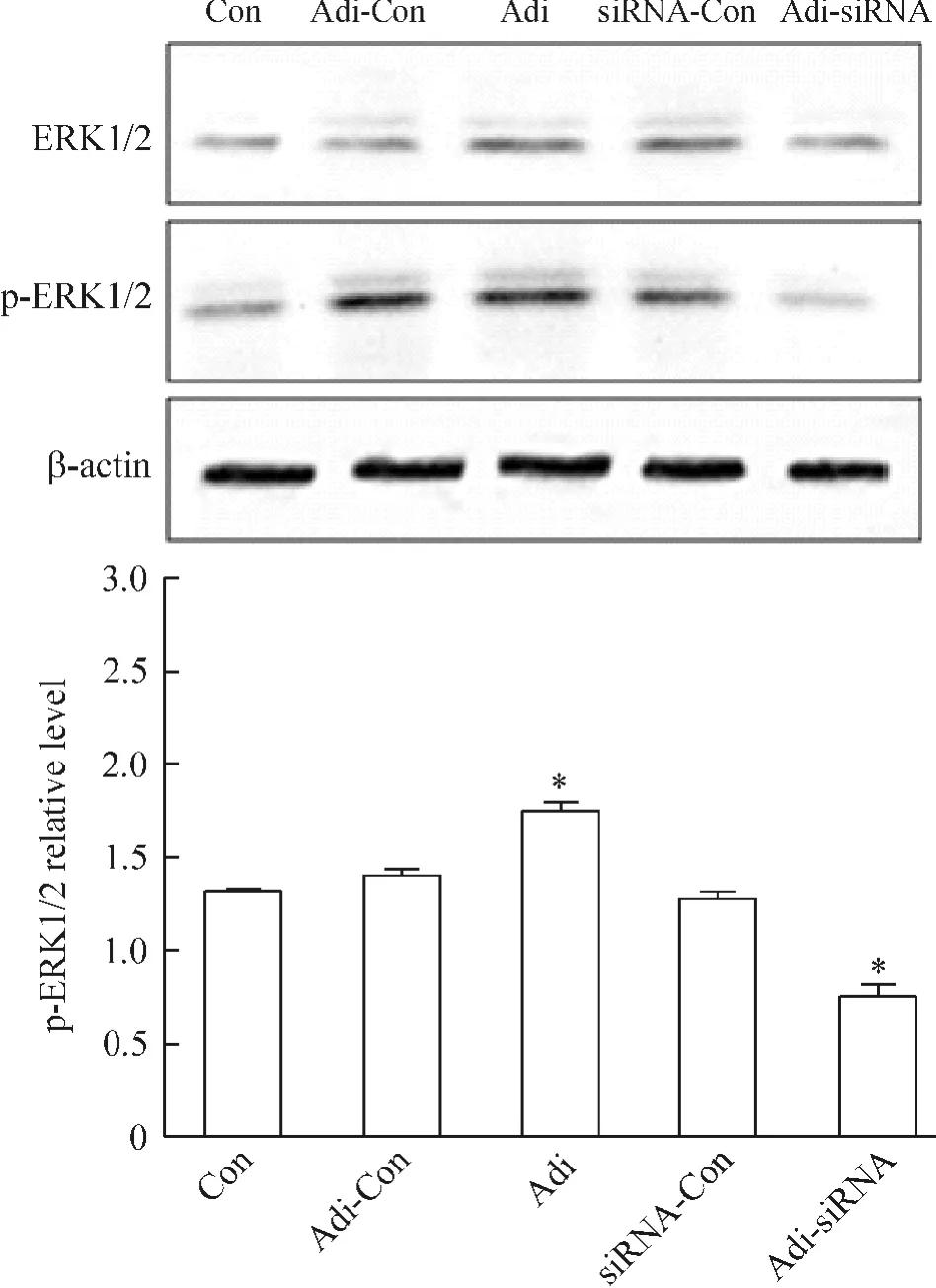
Figure 3.The effects of adipophilin(Adi)on the protein levels of ERK1/2 and p-ERK1/2.Mean±SD.n=3.*P<0.05 vs control(Con)group.图3 Adipophilin对 ERK1/2及p-ERK1/2蛋白水平的影响
ERK1/2是促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中重要的一员,主要被各种生长因子、离子射线、过氧化氢等磷酸化而激活,进入细胞核作用于c-Jun、NF-κB和AP-1等转录因子,促进某些基因的转录和表达,与细胞的增殖分化密切相关。此外,新近研究发现,ERK1/2还介导应激和炎症反应。ERK1/2是MAPK家族中一条重要的信号转导通路,有研究显示ERK1/2与动脉粥样硬化密切相关[8]。本课题组前期研究发现,在RAW264.7细胞中,氧化低密度脂蛋白(oxidized lowdensity lipoprotein,oxLDL)以时间依赖方式活化ERK1/2,并调控了adipophilin表达,且与细胞中脂质蓄积相关[4],在巨噬细胞中,oxLDL诱导 ERK1/2磷酸化[9],使单核巨噬细胞黏附到内皮细胞,促进动脉粥样硬化发展[10]。
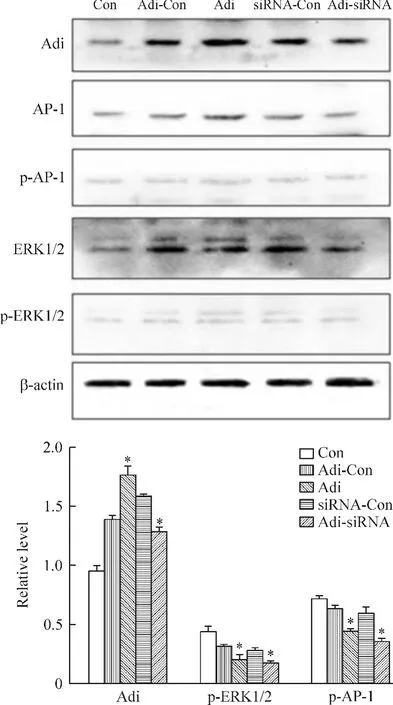
Figure 4.The effects of ERK1/2 inhibitor on the protein levels of adipophilin(Adi),AP-1 and ERK1/2.Mean±SD.n=3.*P <0.05 vs control(Con)group.图4 ERK1/2抑制剂对adipophilin、AP-1和ERK1/2蛋白水平的影响
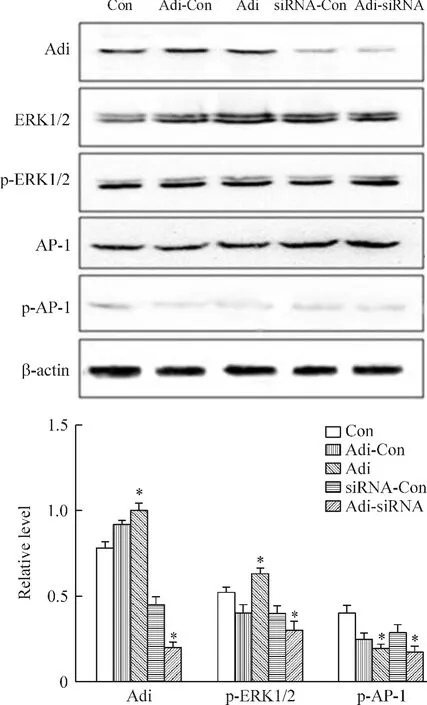
Figure 5.The effects of AP-1 inhibitor on the protein levels of adipophilin(Adi),AP-1 and ERK1/2.Mean±SD.n=3.*P <0.05 vs control(Con)group.图5 AP-1抑制剂对adipophilin、AP-1和ERK1/2的蛋白水平的影响

Figure 6.The effects of AP-1 inhibitor on the concentrations of IL-6,TNF-α and MCP-1.Mean±SD.n=3.*P <0.05 vs control(Con)group.图6 AP-1抑制剂对IL-6、TNF-α和MCP-1浓度的影响
AP-1是一类重要的真核细胞转录因子,是由c-Jun和c-Fos组成的异源二聚体,正常情况下无活性或活性很低,可被各种刺激激活,它的活性失调与炎症、肿瘤等多种疾病发生发展密切相关。AP-1是ERK1/2重要下游靶信号分子,外界刺激激活ERK1/2磷酸化常常导致核转录因子AP-1、NF-κB等活化。
近年来,有关As炎症反应机制的研究日渐增多,本课题组前期的研究多集中于adipophilin在As脂质蓄积中的作用,然而,Chen等[3]研究发现,在THP-1巨噬细胞中adipophilin可增加炎症因子表达,这一现象为我们提供了一个新的研究方向,因此本实验即致力于研究adipophilin影响炎症因子表达的机制。
为了进一步验证Chen等的实验结果,我们首先构建了稳定高表达和沉默adipophilin的RAW264.7细胞株,观察了不同adipophilin表达状态下细胞中炎症因子的变化。实验结果表明,在RAW264.7细胞中,随着 adipophilin的表达上调炎症因子 IL-6、TNF-α和MCP-1的浓度明显上升,尤其是TNF-α上调更明显;而沉默adipophilin使IL-6、TNF-α和MCP-1的浓度明显下降。说明adipophilin可以影响炎症因子IL-6、TNF-α和 MCP-1表达,与Chen等的实验结果相吻合。但adipophilin是通过什么途径影响炎症因子IL-6、TNF-α和MCP-1表达,这其中的机制我们还不清楚。
ERK1/2在动脉粥样硬化中具有重要的作用,有研究表明许多促炎基因表达都受到ERK1/2的调节。Liu等[4]也已证实,在巨噬细胞脂质蓄积中,ERK1/2和adipophilin有关。此外,AP-1是ERK1/2重要下游靶分子,p-ERK1/2可活化AP-1,在人体主动脉平滑肌细胞中,转录因子AP-1经ERK1/2激活,调节基质金属蛋白酶9的表达[5]。有报道显示[11],oxLDL、乙酰化低密度脂蛋白等外界因素的刺激激活了MAPK,MAPK的激活促使转录因子如NF-κB、AP-1、P53等的活化并加重了炎症反应。这些证据显示,ERK1/2调控 adipophilin表达,而 ERK1/2可激活转录因子AP-1进一步调节炎症因子表达,我们推测adipophilin影响炎症因子表达,可能是通过ERK1/2-AP-1途径。
实验结果提示,在 adipophilin表达增高时ERK1/2和AP-1两者的活性形式 p-ERK1/2和p-AP-1的水平明显增高,沉默adipophilin时p-ERK1/2和p-AP-1占其总蛋白的比值也明显降低,说明ERK1/2和AP-1可以被adipophilin调控。参考文献[12-14],用ERK1/2抑制剂 PD98059的最佳使用浓度50 μmol/L预处理细胞2 h,p-ERK1/2及p-AP-1占其总蛋白的比值明显下调,这可能是ERK1/2参与AP-1表达的调控。随后用AP-1抑制剂curcumin(20 μmol/L)预处理细胞2 h,Adi组中 adipophilin 和p-ERK1/2蛋白水平增高,但p-AP-1占其总蛋白的比值明显降低,此外我们还发现炎症因子IL-6、TNF-α和MCP-1在细胞上清液的浓度明显下调。这提示ERK1/2-AP-1途径调节了炎症因子表达。
已有的ERK1/2和AP-1的相关实验显示,激活ERK1/2、JNK、p38 MAPK 和 JAK-STAT信号,显著增加了膀胱癌细胞中AP-1和ERK1/2的结合活性[15]。低盐可通过促进ERK1/2磷酸化、增加AP-1等信号的转导来实现细胞环氧化酶2的表达增加[16]。结合我们的实验,可以认为,adipophilin对炎症因子影响,首先通过激活 ERK1/2,ERK1/2在转录水平活化AP-1,进而调控炎症因子的表达。本实验结果为证实adipophilin在动脉粥样硬化的发生发展中起到的作用提供了有力的实验依据。
[1] Ross R.Atherosclerosis:an inflammatory disease[J].N Engl J Med,1999,340(2):115-126.
[2] Jiang HP,Serrero G.Isolation and characterization of a full-length cDNA coding for an adipose differentiation-related protein[J].Proc Natl Acad Sci U S A,1992,89(17):7856-7860.
[3] Chen FL,Yang ZH,Wang XC,et al.Adipophilin affects the expression of TNF-α,MCP-1,and IL-6 in THP-1 macrophages[J].Mol Cell Biochem,2010,337(1-2):193-199.
[4] Liu Q,Dai Z,Liu Z,et al.Oxidized low-density lipoprotein activates adipophilin through ERK1/2 signal pathway in RAW264.7 cells[J].Acta Biochim Biophys Sin(Shanghai),2010,42(9):635-645.
[5] Moon SK,Cha BY,Kim CH.ERK1/2 mediates TNF-αinduced matrix metalloproteinase-9 expression in human vascular smooth muscle cells via the regulation of NF-κB and AP-1:involvement of the ras dependent pathway[J].J Cell Physiol,2004,198(3):417-427.
[6] Chang BH,Li L,Paul A,et al.Protection against fatty liver but normal adipogenesis in mice lacking adipose differentiation-related protein[J].Mol Cell Biol,2006,26(3):1063-1076.
[7] Shiffman D,Mikita T,Tai JT,et al.Large scale gene expression analysis of cholesterol-loaded macrophages[J].J Biol Chem,2000,275(48):37324-37332.
[8] Zhang Z,Zhang M,Li Y,et al.Simvastatin inhibits the additive activation of ERK1/2 and proliferation of rat vascular smooth muscle cells induced by combined mechanical stress and oxLDL through LOX-1 pathway[J].Cell Signal,2013,25(1):332-340.
[9] Taketa K,Matsumura T,Yano M,et al.Oxidized low density lipoprotein activates peroxisome proliferator-activated receptor-α (PPARα)and PPARγ through MAPK-de-pendent COX-2 expression in macrophages[J].J Biol Chem,2008,283(15):9852-9862.
[10] Wu CC,Wang SH,Kuan II,et al.OxLDL upregulates caveolin-1 expression in macrophages:role for caveolin-1 in the adhesion of oxLDL-treated macrophages to endothelium[J].J Cell Biochem,2009,107(3):460-472.
[11] Zatechka DS Jr,Kador PF,Garcia-Castineiras S,et al.Diabetes can alter the signal transduction pathways in the lens of rats[J].Diabetes,2003,52(4):1014-1022.
[12] Liu JF,Hou SM,Tsai CH,et al.CCN4 induces vascular cell adhesion molecule-1 expression in human synovial fibroblasts and promotes monocyte adhesion[J].Biochim Biophys Acta,2013,1833(5):966-975.
[13] Barrie AP,Clohessy AM,Buensuceso CS,et al.Pituitary adenylyl cyclase-activating peptide stimulates extracellular signal-regulated kinase 1 or 2(ERK1/2)activity in a Ras-independent,mitogen-activated protein kinase/ERK kinase 1 or 2-dependent manner in PC12 cells[J].J Biol Chem,1997,272(32):19666-19671.
[14] Negishi M,Shimizu H,Okada S,et al.9HODE stimulates cell proliferation and extracellular matrix synthesis in human mesangial cells via PPARγ[J].Exp Biol Med(Maywood),2004,229(10):1053-1060.
[15] Lee SJ,Cho SC,Lee EJ,et al.Interleukin-20 promotes migration of bladder cancer cells through extracellular signal-regulated kinase(ERK)-mediated MMP-9 protein expression leading to nuclear factor(NF-κB)activation by inducing the up-regulation of p21WAF1protein expression[J].J Biol Chem,2013,288(8):5539-5552.
[16] 刘冬妍,李学旺,李 航,等.低盐通过激活 ERK和AP-1通路诱导小鼠致密斑细胞系COX-2的表达[J].基础医学与临床,2007,27(5):485-489.
